重组花生过敏原Ara h 2的生物合成
2010-09-13胡纯秋高金燕罗春萍陈红兵
胡纯秋,高金燕,罗春萍,陈红兵,*,朱 盼
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学生命科学与食品工程学院,江西 南昌 330047)
重组花生过敏原Ara h 2的生物合成
胡纯秋1,2,高金燕1,3,罗春萍1,2,陈红兵1,2,*,朱 盼1,2
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.南昌大学 中德联合研究院,江西 南昌 330047;3.南昌大学生命科学与食品工程学院,江西 南昌 330047)
为获得重组花生过敏原Ara h 2。通过RT-PCR合成cDNA,并以此为模板进行PCR扩增目的基因Ara h 2,扩增产物经纯化后克隆至pMD19-T Simple载体中,构建重组质粒pMD19-T-Ara h 2。上述重组质粒经酶切纯化后定向克隆到pGEX-4T-1表达载体中,构建原核表达载体pGEX-4T-1-Ara h 2,并转化表达宿主菌BL21-codonPlus(DE3)-RIPL中,经IPTG诱导表达。SDS-PAGE电泳结果表明,该表达蛋白大小约为46kD,与理论值相符。通过Glutathione Sepharose 4B凝胶亲和层析方法纯化融合蛋白GST-Ara h 2,获得融合蛋白纯度约为90%。Western blotting分析表明,经纯化的融合蛋白能与抗Ara h 2兔血清发生特异性反应,说明该蛋白具有良好的免疫原性。
食物过敏;花生过敏原Ara h 2;生物合成
Abstract :Ara h 2 is one of paramount allergens in peanut. The goal of the present study was to biosynthesize recombinant peanut allergen Ara h 2. Peanut cDNA was synthesized from total RNA using Oligo primers by RT-PCR in order to provide a template for the PCR amplification of Ara h 2 gene. The purified amplification products were cloned into the pMD19-T simple vector to construct a recombinant vector carrying Ara h 2 gene, named pMD19-T-Ara h 2. The recombinant plasmid was digested by Nco I and Hind III. The purified digestion products were then ligated to the pGEX-4T-1 expression vector and transformed into the BL21-codonPlus(DE3)-RIPL for 24 h expression under IPTG induction. The target product, GST-Ara h 2 fusion protein, was purified with Glutathione Sepharose 4B. The results of SDS-PAGE and western-blotting showed that GST-Ara h 2 fusion protein was 46 kD in size, with 90% purity and could specifically react with anti-Ara h 2 sera from rabbits, indicating that the recombinant protein has high specificity of immune reaction.
Key words:food allergy;peanut allergen Ara h 2;biosynthesis
花生是一种重要的食物过敏原,属于世界粮农组织(FAO)报告的八大过敏食物之一[1]。目前已发现11种花生过敏蛋白,其中,Ara h 1和Ara h 2被认为是主要的花生过敏原,90%的花生过敏患者对其过敏[2-3]。Ara h 2是分子质量为17~20kD同种异型蛋白[4],约占花生蛋白总量的10%[5],是花生中致敏性最强的组分之一[6]。成功地制备花生过敏原Ara h 2,尤其是重组蛋白的生物合成,可为Ara h 2进一步相关研究提供标准化的实验材料。同时对开发食品中花生过敏原Ara h 2检测试剂等也具有重要的经济价值。为此,本实验拟以花生过敏原Ara h 2为对象,通过RT-PCR技术,克隆该基因并在原核系统中进行表达,利用Glutathione Sepharose 4B凝胶亲和层析纯化融合蛋白,探索制备花生过敏原Ara h 2的生物合成方法。
1 材料与方法
1.1 材料
花生产自江西省,为湘花花生品种,购自江西省南昌市青山湖市场。
1.2 兔抗Ara h 2血清的采集
本血清为实验室自制并保存。主要方法是从花生种子中分离纯化Ara h 2,并按常规方法免疫新西兰大白兔,达到一定效价后采血,分离血清,-80℃保存。
1.3 质粒和菌株
pMD19-T Simple载体 TaKaRa工程有限公司;pGEX-4T-1载体、大肠杆菌E.coli DH5α 本实验室保存;BL21-codonPlus(DE3)-RIPL Stratagene公司。
1.4 工具酶和试剂
RT-PCR cDNA第一链合成试剂盒、Cocktail片剂Roche公司;限制性核酸内切酶EcoRⅠ和NotⅠ、Taq DNA聚合酶 TaKaRa工程有限公司;T4连接酶Promage公司;质粒提取试剂盒、凝胶回收试剂盒 天根公司;硝酸纤维素膜 Millipore公司;DNA Ladder Marker 北京全式金公司;低分子质量蛋白标准Marker Fermentas公司;Glutathione Sepharose 4B Amersham公司;羊抗兔IgG酶标二抗、4-氯-1-萘酚 Sigma公司;氨苄、IPTG、X-gal 上海生物工程有限公司。
1.5 引物设计与合成
根据GenBank已报道花生过敏原Ara h 2基因序列(登录号AY158467),设计了1对引物(下划线对应部分为酶切位点):P1(上游):5′-CGGAATTCATGGCCAA GCTCACCATACTAGTA-3′(EcoR Ⅰ);P2(下游):5′-ATAAGAATGCGGCCGCTTAGTATCTGTCTCTGCC-3′(NotⅠ)。
1.6 仪器与设备
迷你型蛋白电泳仪、凝胶成像仪 美国Bio-Rad公司;PCR梯度扩增仪 德国Biometra公司;ALLEGRA-64R高速冷冻离心机 美国Backman公司;超声波细胞粉碎机 宁波新芝生物技术公司。
1.7 方法
1.7.1 总RNA的提取
具体方法见文献[7]。
1.7.2 RT-PCR扩增Ara h 2基因
以总RNA为模板,Oligo(dT)为引物,反转录合成cDNA。反应体系:10×Reaction Buffer 2.0μL、MgCl2(25mmol/L)4.0μL、dNTP(10mmol/L)2.0μL、Oligo(dT)(0.8μg/μL)引物 2.0μL、RNase Inhibitor (50U/μL)1.0μL、AMV逆转录酶(≥2.5U/μL) 0.8μL、无RNase水5.2μL、总RNA样品3.0μL。反应条件为:25℃温浴10min,42℃反应1h,合成cDNA,然后99℃变性5min,最后4℃放置5min。再以此反转录产物为模板,P1、P2为特异性引物,进行扩增,反应体系:10×Reaction Buffer 10.0μL、dNTP(2.5mmol/L)8.0μL、引物P1/P2(60pmol/L)10.0μL、Taq酶(5U/μL)1.0μL、双蒸水59.0μL、cDNA 2.0μL。反应条件为:94℃预变性30s;94℃变性30s,55℃退火30s,72℃延伸1min,30个循环;循环结束后72℃再延伸10min。PCR产物经1.0%琼脂糖凝胶电泳检测。
1.7.3 Ara h 2基因的克隆及筛选
采用DNA回收试剂盒纯化PCR产物,操作步骤按说明书进行。将纯化的PCR产物经琼脂糖电泳鉴定纯度后,与pMD19-T Simple载体连接,16℃反应1h,并转化入E.coli DH5α感受态细胞,构建的重组质粒pMD19-T-Ara h 2,铺平板,过夜培养,筛选阳性克隆子,提取质粒。重组质粒采用EcoRⅠ和NotⅠ双酶切鉴定。重组质粒及酶切产物经1.0%琼脂糖凝胶电泳鉴定。
1.7.4 Ara h 2基因的测序、序列分析
将鉴定的阳性克隆质粒送上海生物公司进行双向测序,通过Blast比对进行同源性分析。
1.7.5 原核表达重组质粒的构建
将经测序正确的重组质粒及表达载体pGEX-4T-1,均用EcoRⅠ和NotⅠ双酶切,同时回收小片段及酶切后的载体。用T4连接酶连接两个回收片段,转化E. coli DH 5α感受态细胞后,涂布于含氨苄的平板,挑菌扩大培养,提取质粒,筛选阳性重组质粒pGEX-4T-1-Ara h 2,并通过EcoRⅠ和NotⅠ双酶切鉴定。重组质粒及酶切产物经1.0%琼脂糖凝胶电泳鉴定。
1.7.6 Ara h 2基因的诱导表达及检测
将经鉴定为阳性的重组质粒,转化到表达宿主菌BL21-codonPlus(DE3)-RIPL中,涂布于含氨苄的平板,37℃过夜培养。挑单菌落接种于2mL含氨苄的LB培养基,37℃振荡培养过夜。次日吸取1mL的过夜培养菌液接种于50mL新鲜培养基中,37℃振荡培养至OD600nm值为0.6~0.7,加IPTG至终浓度为1.0mmol/L,诱导表达,并设IPTG未诱导为对照。离心分别收集培养2、4、6、8h的菌体,经PBS缓冲液洗涤两次后,再用PBS缓冲液溶解、等体积的2×SDS悬浮,100℃水浴5min,SDS -PAGE电泳分析。
1.7.7 融合蛋白的纯化
将含有pGEX-4T-1-Ara h 2的重组质粒的菌液,诱导表达2h后,收集菌液。离心、洗涤沉淀。用PBS缓冲液溶解菌体,加入蛋白酶抑制剂Cocktail片剂,混匀。用超声波破碎细胞,超声条件为:功率300W,超声3s、间隔3s,共60次。样品经超声后4℃、10000r/min离心15min。取出上清液转移至新离心管中,在相同条件下再次离心30min,取上清。将所得上清采用Glutathione Sepharose 4B凝胶亲和层析纯化,方法按Amersham公司操作手册进行。并取纯化产物5μL,加等体积的2×SDS悬浮,100℃水浴5min,SDS-PAGE电泳分析。
1.7.8 融合蛋白的免疫印迹
将纯化产物经SDS-PAGE电泳后,转移电转至PVDF膜上,条件为:恒流40mA,1h;然后将膜取出,用5%的脱脂乳封阻,37℃温育1h;用TBST洗涤3次,每次洗涤10min,加入1:3000稀释的兔抗Ara h 2血清将膜浸没,37℃温育1h;洗涤(方法如前述);加入1:5000稀释的HRP酶标羊抗兔IgG二抗,37℃温育1h;洗涤(方法如前述);最后加入4-氯-1-萘酚显色5min即可。
2 结果与分析
2.1 Ara h 2 cDNA片段的扩增
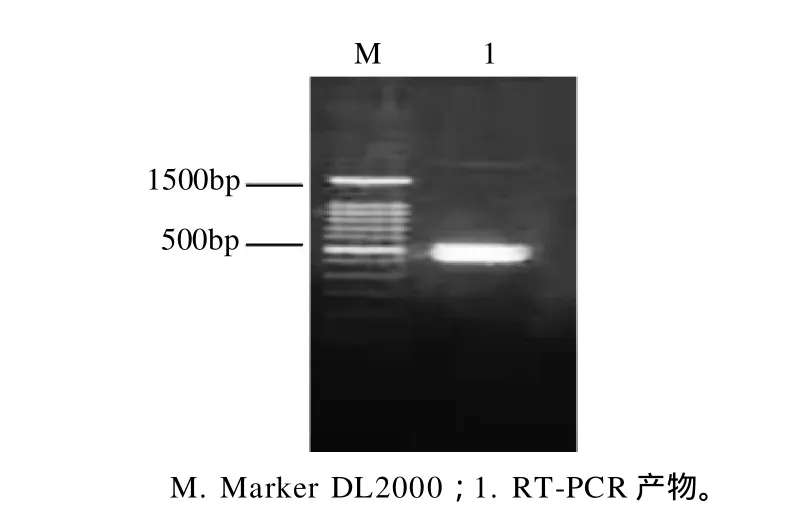
图1 RT-PCR产物电泳结果Fig.1 Agarose gel electrophoretic pattern of the RT-PCR products of peanut Ara h 2 cDNA fragment
以总RNA为基因来源,通过RT-PCR扩增Ara h 2 cDNA片段,产物经1.0%琼脂糖凝胶电泳鉴定,结果如图1所示,在约500bp处有特异性条带,其大小与预计的Ara h 2相符合,可以初步确定为Ara h 2 cDNA片段。
2.2 重组质粒的酶切鉴定
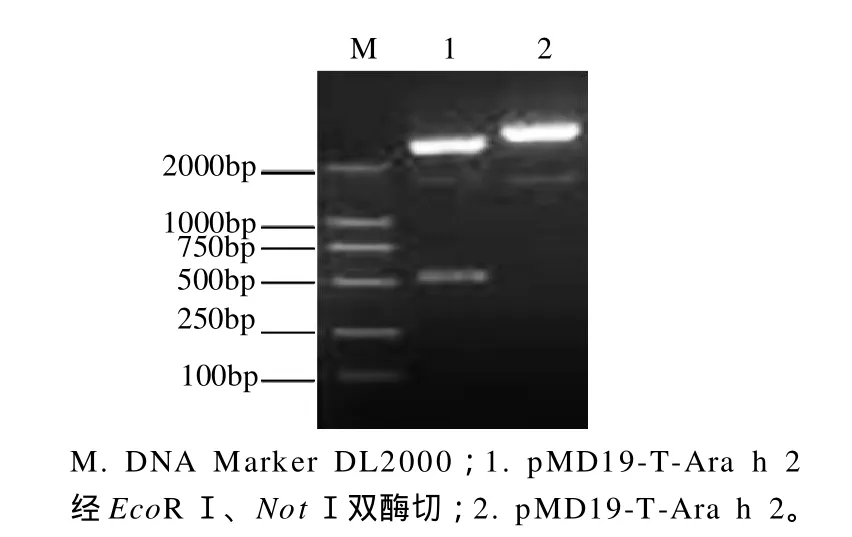
图2 重组质粒的酶切鉴定Fig.2 Agarose gel electrophoretic patterns of pMD19-T-Ara h 2 before and after digestion with EcoR I and Not I
将重组质粒pMD19-T-Ara h 2分别经EcoRⅠ和NotⅠ双酶切后,用1.0%琼脂糖凝胶电泳分析,结果如图2所示。酶切所得的小片段约为500bp,与目的基因片段大小相符,另一片段为载体大小,初步证明重组质粒构建成功。
2.3 Ara h 2基因的测序及序列分析
将测序结果用Blast工具分析其同源性,结果表明,克隆的基因序列与已经公布的Ara h 2.02基因序列同源性达到100%。由此可证明已经成功克隆到正确的Ara h 2.02基因序列。
2.4 重组表达质粒的双酶切鉴定
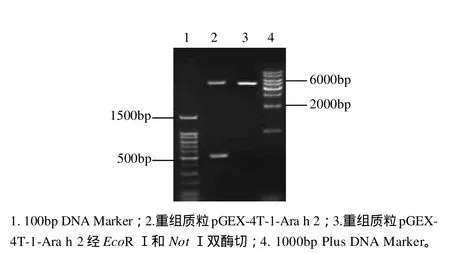
图3 pGEX-4T-1-Ara h 2的双酶切鉴定结果Fig.3 Agarose gel electrophoretic patterns of pGEX-4T-1-Ara h 2 before and after digestion with EcoR I and Not I
用限制性内切酶EcoRⅠ、NotⅠ双酶切重组质粒pGEX-4T-1-Ara h 2,产物经1.0%琼脂糖凝胶电泳鉴定,如图3所示。结果发现有一约500bp大小的酶切片段,与目的基因片段大小相符,另一片段为表达载体大小。测序结果表明,目的基因Ara h 2.02的编码基因正确的融合到表达载体上,方向正确,无任何其他的外基因插入,可以确认构建成功。
2.5 表达产物的SDS-PAGE分析
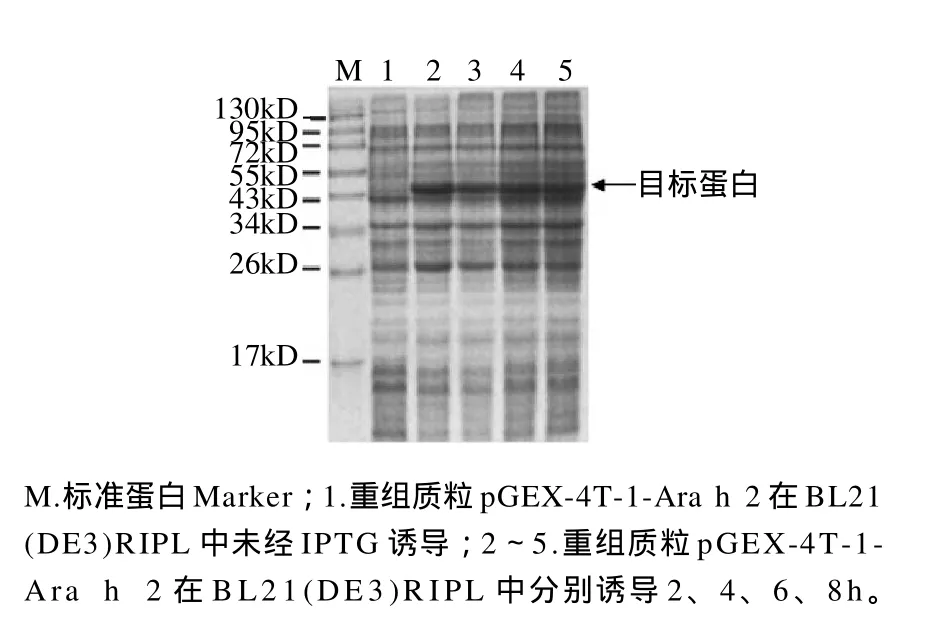
图4 重组质粒pGEX-4T-1-Ara h 2在BL21(DE3)RIPL中经不同时间诱导表达产物的电泳图Fig.4 SDS-PAGE analysis of the bacterial lysates of BL21(DE3)RIPL harboring pGEX-4T-1-Ara h 2 induced with IPTG for different times
含pGEX-4T-1-Ara h 2重组质粒的BL21(DE3)RIPL经IPTG诱导后,在约46kD处有明显的蛋白条带,而未经诱导的阳性菌在此位置未见有目标蛋白。载体pGEX-4T-1所带的标签蛋白GST分子质量约为26kD,加上Ara h 2蛋白的分子质量,所表达的融合蛋白分子质量应为46kD。可见,融合蛋白分子质量与理论值相符。蛋白经不同时间诱导,其表达量也有所不同。通过Quantity One凝胶成像系统软件分析结果显示,融合蛋白经诱导表达2h后,其蛋白含量占总蛋白量的22.5%。当诱导时间增加,其蛋白含量略有减少,且随着时间的不断增加蛋白含量也在不断降低。
2.6 GST-Ara h 2融合蛋白的纯化
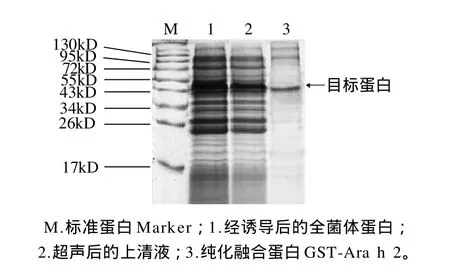
图5 目标蛋白的纯化电泳图Fig.5 SDS-PAGE analysis of GST-Ara h 2 fusion protein purified from the bacterial lysates of BL21(DE3)RIPL harboring pGEX-4T-1-Ara h 2 after 24 h IPTG induction
超声破碎细胞后,上清液通过Glutathione Sepharose 4B亲和纯化,结果如图5所示。通过Quantity One凝胶成像系统软件分析其纯度约为90%,且每1000mL培养菌可获得0.1mg左右的重组蛋白。
2.7 GST-Ara h 2融合蛋白的免疫印迹结果
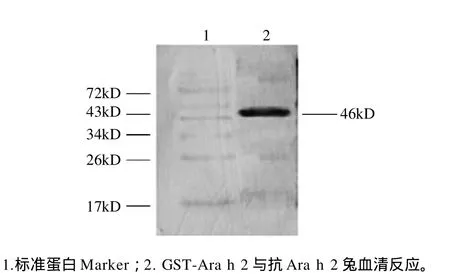
图6 融合蛋白的免疫印迹分析Fig.6 Western blotting analysis of the specific reaction of GST-Ara h 2 fusion protein with the anti-Ara h 2 sera from rabbits
纯化的融合蛋白经转膜后,与兔抗Ara h 2血清反应,在目标蛋白处有明显特异性印迹,而与兔阴性血清反应无任何印迹出现,如图6所示。该结果表明该重组蛋白具有良好的免疫反应原性。
3 讨 论
对于大多数E.coli,密码子AGG/AGA(arginine)、AUA(isoleucine)、CUA(leucine)、CGA(arginine)及 CCC(proline)使用率最低,被称之为稀有密码子。当带有上述密码子的外源基因mRNA在E.coli中表达,可能会导致翻译终止或错误[8-10]。目的基因Ara h 2.02中含有大量的AGG/AGA稀有密码子,其含量接近整个编码基因的10%。因此,为有效表达该目的基因,选择了添加了稀有密码子的大肠杆菌BL21(DE3)codonPlus-RIPL作为表达宿主菌。研究结果表明,选择的载体和宿主菌可以表达出Ara h 2,与理论分析一致。实际上相似的结果也被Lehmann等[11]证实,他们通过将克隆的Ara h 2基因与表达载体pET32a连接,并引入带有编码大肠杆菌精氨酸稀有密码子AGG/AGA的tRNA基因pUBS520质粒,最后将该重组质粒转入表达宿主菌E.coli Origami(DE3)中,也实现了Ara h 2蛋白的表达。
本研究利用基因重组技术克隆了Ara h 2.02基因,通过原核系统实现了体外有效表达,并采用亲和纯化获得了高纯度的Ara h 2融合蛋白。实验中选择pGEX表达载体,因纯化条件温和,整个过程无变性剂的加入,可最大限度地保持了蛋白的天然构象和活性。另外,由于GST标签与目的蛋白之间设计了凝血酶(或Xa因子)的识别切割位点,使得纯化后的融合蛋白即可将GST切下、去除,从而可得到无标签的高纯度目的蛋白。本实验得到了纯度较高的融合蛋白Ara h 2,但电泳结果显示在目的蛋白下方位置还有个别条带出现,这可能是因目的蛋白发生部分降解而导致,可通过实验过程中尽量保持低温操作及加入适量的蛋白酶抑制剂来改善。但由于目的蛋白大多数以包涵体的形式存在,使得所得的纯化蛋白量很有限,可通过优化表达条件来尽可能的提高可溶性蛋白含量,或通过将包涵体变性复性的途径来获取更多目标蛋白。目的蛋白免疫印迹结果表明了该重组蛋白具有很好的免疫原性,可用于今后的相关研究。
此外,通过基因工程的手段生产重组蛋白是制备食物过敏原的重要途径。重组食物过敏原不仅可以大量生产且具有高纯度、品质稳定等优点,甚至可替代天然提取物用于灵敏性更高、特异性更强的食物过敏原的检测[12]。大量文献表明,重组食物过敏原在食物过敏原的检测以及食物过敏的诊断与治疗等方面都显示了重要的价值,是天然过敏原的最佳替代物[13-14]。由于不同的表达体系对不同的外源基因会产生异样的表达效果,加之Ara h 2编码基因中含有大量的AGG/AGA稀有密码子。因此,本研究工作只是一个初步探索,Ara h 2重组蛋白的原核表达体系,优化条件还值得进一步研究,甚至可以开展Ara h 2重组蛋白的真核表达工作。
[1] SHEWRY P R, NAPIER J A, TATHAM A S. Seed storage proteins:structures and biosynthesis[J]. Plant Cell, 1995, 7(7): 945-956.
[2] SHIN D S, COMPADRE C M, MALEKI S J, et al. Biochemical and structural analysis of the IgE binding sites on Ara h 1, an abundant and highly allergenic peanut protein[J]. J Biol Chem, 1998, 273(22): 13753-13759.
[3] van WIJK F, HARTGRING S, KOPPELMAN S J, et al. Mixed antibody and T cell responses to peanut and the peanut allergens Ara h 1, Ara h 2, Ara h 3 and Ara h 6 in an oral sensitization model[J]. Clinical &Experimental Allergy, 2004, 34(9): 1422-1428.
[4] CHATEL J M, BERNARD H, ORSON F M. Isolation and characterization of two complete Ara h 2 isoforms cDNA[J]. Int Arch Allergy Immunol,2003, 131(1): 14-18.
[6] STANLEY J S, KING N, BURKS A W, et al. Identification and mutational analysis of the immunodominant IgE binding epitopes of the major peanut allergen Ara h 2[J]. Arch Biochem Biophys, 1997, 342:244-253.
[7] 胡纯秋, 高金燕, 陈红兵. 一种提取花生种子中总RNA的简易方法[J]. 食品科学, 2007, 28(10): 373-375.
[8] IKEMURA T. Correlation between the abundance of Escherichia coli transfer RNAs and the occurrence of the respective codons in its protein genes:a proposal for a synonymous codon choice that is optimal for the E.coli translational system[J]. Journal of Molecular Biology, 1981,151(3): 389-409.
[9] BRINKMANN U, MATTES R E, BUCKEL P. High-level expression of recombinant genes in Escherichia coli is dependent on the availability of the dnaY gene product[J]. Gene, 1989, 85(1): 109-114.
[10] CALDERONE T L, STEVENS R D, OAS T G. High-level misincorporation of lysine for arginine at AGA codons in a fusion protein expressed in Escherichia coli[J]. J Mol Biol, 1996, 262(4): 407-412.
[11] LEHMANN K, HOFFMANN S, NEUDECKER P, et al. High-yield expression in Escherichia coli, purification, and characterization of properly folded major peanut allergen Ara h 2[J]. Protein Expr Purif,2003, 31(2): 250-259.
[12] LORENZ A R, SCHEURER S, HAUSTEIN D, et al. Recombinant food allergens[J]. J Chromatogr B Biomed Sci Appl, 2001, 756(1/2): 255-279.
[13] BALLMER-WEBER B K, LIDHOLM J, VIETHS S. Recombinant allergens in the diagnosis of food allergy: Which are the advantages?[J].2007, 47(3): 126-128.
[14] VALENTA R, KRAFT D. Recombinant allergens: from production and characterization to diagnosis, treatment, and prevention of allergy[J].Methods, 2004, 32(3): 207-208.
Preliminary Investigation on the Biosynthesis of Recombinant Peanut Allergen Ara h 2
HU Chun-qiu1,2,GAO Jin-yan1,3,LUO Chun-ping1,2,CHEN Hong-bing1,2,*,ZHU Pan1,2
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China;2. Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China;3. School of Life Sciences and Food Engineering,Nanchang University, Nanchang 330047, China)
Q786
A
1002-6630(2010)15-0203-05
2010-05-07
南昌大学食品科学与技术国家重点实验室目标导向项目(SKLF-MB-200807);
江西省主要学科学术和技术带头人培养项目([2004]234号);教育部新世纪优秀人才支持计划项目(NCET-08-07-04)
胡纯秋(1980—),女,博士研究生,研究方向为食品营养与安全。E-mail:hchqiu@yahoo.com.cn
*通信作者:陈红兵(1967—),男,教授,博士,研究方向为食品营养与安全。E-mail:chbgjy@hotmail.com
