鲜奶中产γ-氨基丁酸乳酸菌株的筛选与鉴定
2010-09-13李远宏吕凤霞邹晓葵陆兆新
李远宏,吕凤霞,邹晓葵,李 颖,2,陆兆新,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.无锡市宜兴食品药品监督管理局,江苏 宜兴 214206)
鲜奶中产γ-氨基丁酸乳酸菌株的筛选与鉴定
李远宏1,吕凤霞1,邹晓葵1,李 颖1,2,陆兆新1,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.无锡市宜兴食品药品监督管理局,江苏 宜兴 214206)
从新鲜牛奶中筛选高产γ-氨基丁酸(GABA)的乳酸菌株fmbl12-4,通过形态特征、生理生化特征和16S rDNA 序列分析,鉴定菌株为乳酸乳球菌乳酸亚种(Lactococcus lactis subsp. lactis)。当fmbl12-4的湿菌体与100mmol/L L-谷氨酸钠溶液(L-MSG)按1:20(m/V)混合,于30℃、100r/min振荡反应24h,转化液中GABA浓度达到82.36mmol/L。在质量浓度为2.5g/100mL L-MSG的MRS培养基中培养6d,GABA质量浓度达到4.68g/L。
γ-氨基丁酸;乳酸菌;筛选;鉴定
Abstract :A lactic acid bacterial strain with high γ-aminobutyric acid (γ-GABA)-producing ability, named fmbl12-4, was isolated from fresh milk. Based on the studies of morphological, physiological and biochemical characteristics and 16S rDNA sequence and phylogenic analyses, fmbl12-4 was identified as Lactococcus lactis subsp. lactis. After 24 h shake (100 r/min)incubation of the wet mycelia of fmbl12-4 in a 20-fold volume of 100 mmol/L L-monosodium glutamate solution at 30 ℃, aγ-GABA content of 82.36 mmol/L was obtained. Incubation in a MRS medium containing 25 g/L L-MSG for 6 days gave 4.68 g/L γ-GABA content.
Key words:γ-aminobutyric acid;lactic acid bacteria;isolation and screening;identification
γ-氨基丁酸(GABA)是一种天然存在的非蛋白质组成氨基酸,广泛存在于原核生物和真核生物中[1]。GABA是哺乳动物中枢神经系统中一种重要的抑制性神经递质,具有很多重要的生理功能,如降低血压、利尿、镇静安神、促进睡眠、增强记忆力、预防糖尿病、治疗癫痫、促进生殖[2]等。作为一种新型的功能性因子,GABA在食品保健、医药、化工和农业等行业具有广阔的应用前景。
制备GABA的方法主要有化学合成法和生物合成法,其中生物合成法又包括植物富集法和微生物发酵法。生物合成法是利用生物体内的谷氨酸脱羧酶(glutamate decarboxylase,GAD)作为催化剂,将L-谷氨酸(L-Glu)或其钠盐α-脱羧生成GABA。相比而言,化学合成GABA安全性差、环境污染严重。植物富集的GABA含量较低,微生物发酵法制备GABA由于不受资源、环境和空间的限制,具有明显优势。
乳酸菌是具保健作用的益生菌,是一种公认安全的微生物,广泛地应用于食品工业中。目前,Lactobacillus plantarum[3]、Lactobacillus brevis[4]、Lactococcus lactis[5]、Lactobacillus paracasei[6]、Streptococcus salivarius subsp. thermophilus[7]中已发现具有生物合成GABA的能力。从乳酸菌中筛选高产GABA的菌株是一个很好的策略。本研究从新鲜牛奶中筛选高产GABA的乳酸菌菌株,对其进行鉴定,并对其生理生化特性进行初步研究。
1 材料与方法
1.1 材料与试剂
γ-氨基丁酸(99.0%)、异硫氰酸苯酯 (PITC) Sigma公司;乙腈、乙酸、三乙胺(均为色谱纯) Tedia公司;细菌总DNA提取试剂盒 上海生工生物工程技术服务有限公司;其他试剂为国产分析纯级试剂。
乳酸菌分离培养基为含20g/L CaCO3的MRS固体培养基[8];菌种活化培养基为体积分数10%的脱脂牛乳培养基;种子培养基为MRS液体培养基;发酵培养基为含不同质量浓度L-谷氨酸钠(L-MSG)的MRS液体培养基。
1.2 仪器与设备
Agilent 1100 series 高效液相色谱系统(全波长紫外检测器) 美国安捷伦科技公司;5804R高速冷冻离心机德国Eppendorf 公司;LNG-T88台式快速冷冻离心浓缩干燥器 太仓市华美生化仪器厂。
1.3 样品中乳酸菌菌株分离培养及纯化
新鲜牛奶取自安徽科技学院畜牧科技园。对样品进行梯度稀释,涂布于MRS平板上,于30℃培养48h。挑取肉眼可见、生长较快、单个有溶钙圈的菌落分离并纯化,根据菌落特征进行初步归类,将革兰氏染色阳性、无芽孢、接触酶阴性菌株作为进一步筛选的乳酸菌疑似菌株,并将其编号、保存。
1.4 生产GABA菌株的筛选
1.4.1 菌种的活化培养
将上述分离纯化并保存的菌株接种于脱脂牛乳培养基中,30℃培养至凝乳,然后按体积分数2%的接种量接种于MRS液体培养基中,30℃静置培养16h。
1.4.2 细胞转化
将活化后的菌种按体积分数2%的接种量接种于MRS培养基中,于30℃静置培养24h。取培养物在5000r/min、4℃离心15min收集菌体,加入与培养液等量的生理盐水洗涤菌体3次。湿菌体与100mmol/L的L-谷氨酸钠溶液按1:20(m/V)充分混合均匀,于30℃、100r/min振荡反应24h。取细胞转化液进行定性分析,并对高产GABA的细胞转化液进行定量分析。
1.5 分析方法
1.5.1 定性分析
采用纸层析法。展开剂组成:V(正丁醇):V(冰乙酸):V(水)=4:1:3,内含质量浓度为0.4g/100mL的茚三酮。以GABA标准品做参比,待测样品点样5μL。采用新华一号层析纸展开后于90℃条件下烘干显色20min。
1.5.2 定量分析
高效液相色谱法测定参照文献[9]进行,洗脱条件略有改动,洗脱程序如表1所示。色谱条件:色谱柱采用Agilent:ZORBAX.Eclips XDB-C18柱(15cm×4.6mm,5μm),紫外检测器,检测波长为254nm。流动相:流动相A为乙酸钠10.254g、三乙胺0.5mL和乙酸0.7mL,调节pH5.8,定容至1000mL;流动相B为乙腈;流动相C为水。标准曲线的制作:精密配制2.000mmol/L的GABA标准溶液,并将其稀释至0.125、0.250、0.500、0.750、1.000mmol/L。对GABA标准样品衍生化后定量测定,以GABA浓度为横坐标,峰面积为纵坐标,绘制标准曲线。
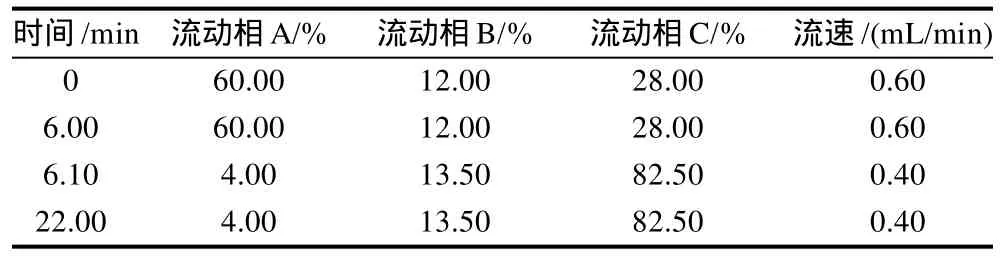
表1 流动相梯度洗脱程序表Table 1 Gradient elution program for HPLC determination ofγ-GABA
1.6 菌株鉴定
1.6.1 形态观察及生理生化鉴定
按照参考文献[8-10]进行。
1.6.2 16S rDNA 的扩增与测序
采用细菌总DNA提取试剂盒提取基因组DNA,采用细菌的16S rDNA通用引物进行PCR扩增。正向引物P1:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物P2:5'-GGTTACCTTGTTACGACTT-3'。PCR 反应体系(总体积50μL):10×PCR缓冲液5μL;正、反向引物P1、P2 均为10mmol/L各2.5μL;dNTP (10mmol/L)4μL;基因组DNA 1.0μL;Taq DNA聚合酶0.5μL;双蒸水34.5μL。PCR 反应条件为:94℃预变性2min;94℃变性45s,55℃退火55s,72℃延伸2min,共进行34个循环;再72℃延伸10min。PCR产物测序由南京金思特生物技术公司完成。
1.6.3 序列比对及系统发育分析
将16S rDNA序列与GenBank+EMBL+DDBJ+PDB数据库中的核苷酸序列进行同源性分析(http://www.ncbi.nlm.nih.gov/blast)。选择同源性较高及已报道产GAD的细菌16S rDNA核苷酸序列,利用clustalx 2.0进行多重联配,然后再利用MEGA 4.0软件采用Neighbour-joining方法以E.coli O157:H7为外群(out-group)构建系统发育树,并进行Bootstrap分析。
1.7 温度对GABA积累的影响
将活化的产GABA菌株以体积分数2%的接种量,接入含质量浓度为2.5g/100mL的L-MSG的发酵培养基中,分别于25、30、37、40℃静置培养。每24h测定发酵液中GABA的质量浓度。
1.8 底物质量浓度对GABA积累的影响
将活化的产GABA菌株以2%的接种量,分别接入含质量浓度为0.5、1、2.5、5g/100mL的L-MSG的发酵培养基中,于30℃静置培养。每24h测定发酵液中GABA的质量浓度。
2 结果与分析
2.1 菌株的分离及纯化
从新鲜牛奶中分离出大量疑似乳酸菌株,对革兰氏阳性、无芽孢、接触酶阴性的菌株产GABA能力进行研究。为了能够从分离的大量疑似乳酸菌菌株中筛选到高产GABA菌株,共对60株疑似乳酸菌菌株进行了分离、纯化,并作为产GABA菌株的筛选对象。
2.2 产GABA乳酸菌菌株的筛选
2.2.1 定性分析

图1 菌株转化液纸层析图谱Fig.1 Paper chromatographic patterns showing the production ofγ-GABA derived from strain fmbl12-4 incubated in L-monosodium glutamate solution
如图1所示,菌株fmbl12-4的细胞转化液存在明显与GABA标准品Rf一致的茚三酮显色斑点。初步判定菌株fmbl12-4为产GABA菌株。
2.2.2 定量分析
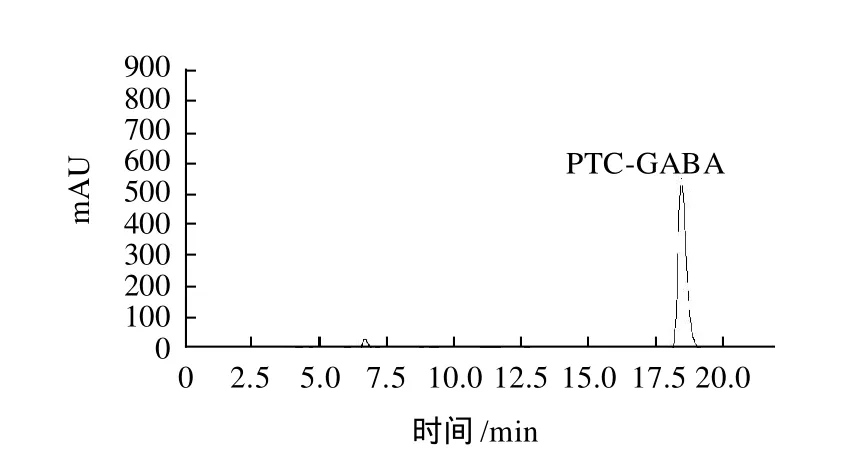
图2 GABA标准品的高效液相色谱图Fig.2 HPLC chromatogram ofγ-GABA standard
按照参照文献[9]提供的方法处理GABA标准品,再进行HPLC测定,以峰面积(y)对GABA浓度(x)作线性回归,制作GABA标准曲线,结果在GABA浓度为 0~1mmol/L范围内,GABA获得了良好的分离,其线性方程为y=23871x+89.099(R2=0.9993)。通过HPLC定量测定样品中的GABA质量浓度,由此确定菌株产GABA的能力。结果发现菌株fmbl12-4的细胞转化液中均存在一种与GABA标准样品保留时间相同的物质,进一步证明了菌株fmbl12-4具有转化底物L-MSG合成GABA的能力。菌株fmbl12-4细胞转化液中的L-MSG几乎全部被转化,GABA质量浓度达到82.36mmol/L,GABA标准样品及细胞转化液的高效液相色谱图谱如图2、3所示。

图3 菌株fmbl12-4细胞转化液的高效液相色谱图Fig.3 HPLC chromatogram of the metabolic products after incubation of strain fmbl12-4 in L-monosodium glutamate solution
2.3 菌株fmbl12-4的鉴定
2.3.1 菌落形态特征
菌株fmbl12-4在MRS固体培养基中培养48h,其菌落表面光滑、湿润、呈乳白色、边缘整齐,直径约1mm,经革兰氏染色镜检为阳性,符合乳酸菌特性。
2.3.2 生理生化特性
参照文献[8,10]对菌株fmbl12-4进行生理生化实验,结果见表2。各项检测特征均符合文献[8,10]中关于乳酸乳球菌的描述,初步判定菌株fmbl12-4为乳酸乳球菌。

表2 菌株fmbl12-4生理生化鉴定结果Table 2 Physiological and biochemical characteristics of strain fmb12-4
2.3.3 分子生物学鉴定
2.3.3.1 16S rDNA扩增与测序
以菌株fmbl12-4的总DNA为模板,P1、P2为引物,进行 PCR扩增,得到约1.5kb左右的特异性扩增条带。扩增产物经南京金思特生物技术公司测序,核苷酸序列大小为1425bp。该序列已经在Genbank上进行了登记,登记号为FJ824739.1。
2.3.3.2 序列比对及系统发育分析
将菌株fmbl12-4的16S rDNA核苷酸序列分别与GenBank+EMBL+DDBJ+PDB 数据库中报道的16S rDNA核苷酸序列进行比对,结果显示,菌株fmbl12-4的16S rDNA核苷酸序列与数据库报道的5种菌株的16S rDNA核苷酸序列的同源性达到99%,分别为乳酸乳球菌乳酸亚种(Lactococcus lactis subsp. lactis)、乳酸乳球菌乳脂亚种(Lactococcus lactis subsp. cremoris)、格氏乳杆菌(Lactococcus garvieae)、根瘤土壤杆菌(Agrobacterium tumefaciens)、耐久肠杆菌(Enterococcus durans)以及11株不可培养微生物。其中明确种属的有Lactococcus lactis subsp. lactis、Lactococcus lactis subsp. cremoris、Lactococcus garvieae、Agrobacterium tumefaciens、Enterococcus durans。选择已报道产GAD的细菌16S rDNA核苷酸序列构建系统发育树,结果如图4所示。
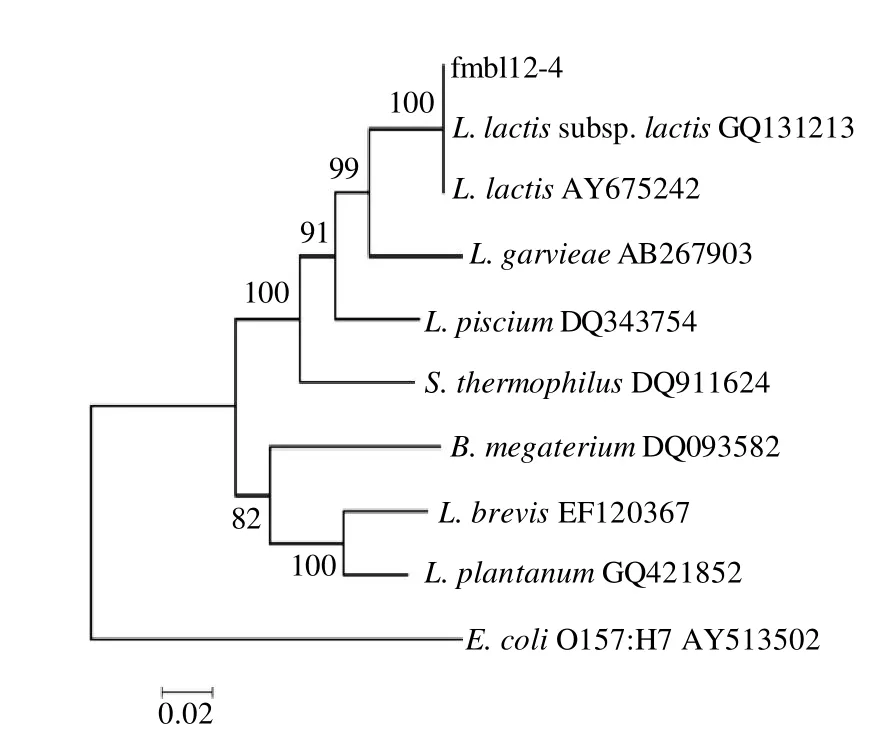
图4 基于具有GAD活性细菌的16S rDNA序列为基础的系统发育树Fig.4 Phylogenetic tree of 16S rDNA sequences based on the 6S rDNA sequences of bacterial strains with GAD activity
由图4可知,fmbl12-4与Lactococcus lactis subsp.lactis位于同一个簇群,且同源性达99%的微生物大部分为Lactococcus lactis subsp. lactis,其他产GAD细菌的发育关系相对较远。
根据fmbl12-4的形态特征、生理生化特征、16S rDNA序列比对分析和系统发育分析,将fmbl12-4鉴定为乳酸乳球菌乳酸亚种(Lactococcus lactis subsp. lactis)。
2.4 温度对GABA积累的影响
GABA在生物体内的合成从本质上说是酶参与的催化反应,主要是GAD参与L-Glu或其盐类α-羧基脱羧而合成的。不同温度条件下GABA的积累情况如图5所示。
由图5可知,菌株fmbl12-4在30℃时的积累量最大,当温度升高或降低,发酵液中GABA的积累量都有所降低。这可能是由于菌株fmbl12-4细胞内的GAD活性在30℃时相对较高。
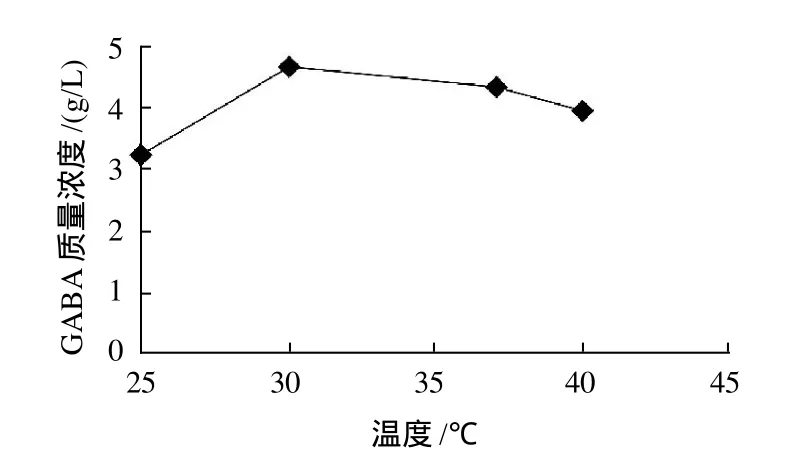
图5 温度对GABA积累的影响Fig.5 Effect of incubation temperature on GABA production
2.5 底物质量浓度对GABA积累的影响
GABA是在GAD的催化作用下,将L-MSG的α-羧基脱羧而生成的。L-MSG作为生物合成GABA的前体,对发酵液中GABA的积累有重要影响。当培养基中添加不同质量浓度L-MSG时,发酵液中GABA的积累情况如图6所示。
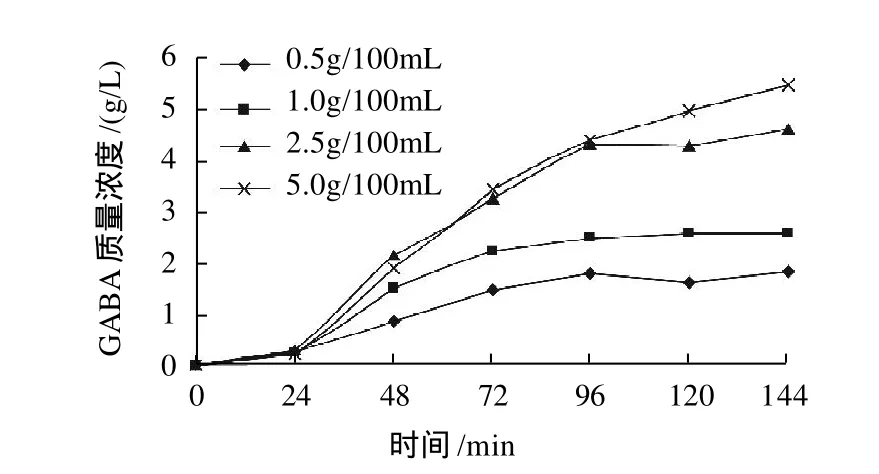
图6 L-MSG质量浓度对GABA合成的影响Fig.6 Effect of L-MSG concentration on GABA production
由图6可见,在发酵过程中,GABA的积累量随着时间的延长不断增加,在前4d GABA质量浓度增加较快,发酵后期GABA质量浓度增幅趋缓,基本趋于稳定。当培养基中L-MSG的质量浓度较低时,发酵液中GABA的积累随着L-MSG的增加而显著增加;在含质量浓度为2.5g/100mL的L-MSG的MRS培养基中,菌株fmbl12-4对 GABA的最大积累量达到4.68g/L;而当L-MSG添加量达到5g/100mL时,发酵液中GABA的最大积累量为5.50g/L,GABA的积累量增加趋缓,发酵液中残留的L-MSG相对较多。这可能是因为培养基中高质量浓度的L-MSG抑制了菌体生长,从而导致生物量降低。
3 结 论
由于反应液中仅加入底物L-MSG,成分简单,同时GAD是生物催化L-Glu及其盐类的α-羧基脱羧反应生成GABA的唯一酶[11],因而最终细胞转化液中仅存在底物L-MSG和(或)产物GABA,纸层析后表现为显色条带仅为一条或两条,易于观察,筛选效率大大提高。发酵液中的成分复杂,尤其是含有大量其他种类的氨基酸和蛋白质等产物也可以与茚三酮反应呈色,GABA显色斑点易受干扰。相比于利用纸层析分析发酵液[12-15]中是否存在GABA来初步筛选GABA产生菌株而言,利用纸层析分析细胞转化液是一种较为理想的初步筛选GABA生产菌株的方法。本实验通过纸层析定性分析细胞转化液中是否存在GABA,然后再对存在明显GABA显色斑点的细胞转化液进行HPLC定量测定,进一步验证菌株是否为GABA产生菌株的方法,从新鲜牛奶样品中分离筛选了1株高产GABA的乳酸菌菌株fmbl12-4。当fmbl12-4的湿菌体与100mmol/L L-MSG 按1:20混合,于30℃、100r/min振荡反应24h,转化液中GABA浓度达到82.36mmol/L。在含质量浓度为2.5g/100mL的LMSG的MRS培养基中静置培养6d,GABA质量浓度达到4.68g/L。通过形态特征、生理生化特征和16S rDNA 序列分析鉴定菌株为乳酸乳球菌乳酸亚种(Lactococcus lactis subsp. lactis)。
[1] MANYA B V, KATZ L, HARE T A, et al. Isoniazid-induced elevation of cerebrospinal fluid (CSF) GABA levels and effects on chorea in huntington's disease[J]. Annals of Neurology, 1981, 10(1): 35-37.
[2] 杨胜远, 陆兆新, 吕凤霞, 等. γ-氨基丁酸的生理功能和研究开发进展[J]. 食品科学, 2005, 26(9): 546-551.
[3] SIRAGUSA S, ANGELIS M D, CAGNO R D, et al. Synthesis ofγaminobutyric acid by lactic acid bacteria isolated from a variety of Italian cheeses[J]. Applied and Environmental Microbioogy, 2007, 73(22): 7283-7290.
[4] UENO Y, HAYAKAWA K,TAKAHASH S, et al. Purification and characterization of glutamate decarboxylase from Lactobacillus brevis IFO12005[J]. Bioscience, Biotechnology, and Biochemistry, 1997, 61:1168-1171.
[5] NOMURA M, NAKJIMA I, FUJITA Y, et al. Lactococcus lactis conteins only one glutamate decarboxylase gene[J]. Microbiology, 1999, 145:1375-1380.
[6] KOMATSUZAKI N, SHIMA J, KAWAMOTO S, et al. Production of γ-aminobutyric acid (GABA) by Lactobacillus paracasei isolated from traditional fermented foods[J]. Food Microbiology, 2005, 22: 497-504.
[7] 杨胜远, 陆兆新, 吕凤霞, 等. 一株产谷氨酸脱羧酶乳酸菌的鉴定及其酶学性质[J]. 工业微生物, 2007, 37(6): 25-30.
[8] 凌代文, 东秀珠. 乳酸细菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 4-5; 35; 46-47; 85.
[9] 杨胜远, 陆兆新, 焦阳, 等. 高效液相色谱法测定发酵醪中的γ-氨基丁酸[J]. 广西农业生物科学, 2007, 26(4): 331-334.
[10] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001:260-264; 370-373.
[11] 杨胜远, 陆兆新, 吕凤霞, 等. 微生物谷氨酸脱羧酶研究进展[J]. 食品科学, 2007, 28(1): 354-360.
[12] 夏江, 梅乐和, 黄俊, 等. 产γ-氨基丁酸的乳酸菌株筛选及诱变[J].核农学报, 2006, 20(5): 379-382.
[13] 冀林立, 方芳, 魏小雁, 等. 传统乳制品中产γ- 氨基丁酸乳酸菌的筛选[J]. 中国乳品工业, 2008, 36(5): 4-7; 15.
[14] 徐冬云, 周立平, 童振宇, 等. 产γ-氨基丁酸乳酸菌的分离筛选[J].现代食品科技, 2006, 22(3): 59-64.
[15] 李海星, 江英英, 曹郁生. 产γ-氨基丁酸乳酸菌的筛选及初步鉴定[J]. 天然产物研究与开发, 2007, 19(3): 455-457; 510.
Isolation and Screening of a Gamma-Aminobutyric Acid-producing Lactic Acid Bacterial (LCB) Strain from Fresh Milk
LI Yuan-hong1,LFeng-xia1,ZOU Xiao-kui1,LI Ying1,2,LU Zhao-xin1,*
(1. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China;2. Yixing Food and Drug Administration, Yixing 214206, China)
Q939
A
1002-6630(2010)15-0198-05
2009-10-27
国家“863”计划项目(2007AA10Z357)
李远宏(1984—),男,硕士研究生,研究方向为食品科学。E-mail:ahyhongl@sina.com
*通信作者:陆兆新(1957—),男,教授,博士,研究方向为食品微生物和食品生物技术。E-mail:fmb@njau.edu.cn
