Nisin-rbLF-N融合基因的构建及其在大肠杆菌中的表达
2010-09-13袁晓宇许文涛黄昆仑罗云波谷新晰田洪涛
袁晓宇,许文涛,黄昆仑,罗云波,谷新晰,田洪涛,,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.中国农业大学食品科学与营养工程学院,北京 100083)
Nisin-rbLF-N融合基因的构建及其在大肠杆菌中的表达
袁晓宇1,许文涛2,黄昆仑2,罗云波2,谷新晰1,田洪涛1,2,*
(1.河北农业大学食品科技学院,河北 保定 071001;2.中国农业大学食品科学与营养工程学院,北京 100083)
针对乳链菌肽(nisin)抑菌谱窄的缺点,选择对抗菌谱较广且具有较强抗性的牛乳铁蛋白氨基末端多肽(rbLF-N)为材料,构建融合基因Nisin-rbLF-N。将融合基因克隆到原核表达载体pGEX-4T1中,转化E. coli BL21(DE3)进行诱导表达,将诱导表达的产物进行Tricine-SDS-PAGE蛋白电泳及抑菌活性检测。结果表明,克隆菌经诱导后可表达出可观的融合蛋白,融合蛋白以包涵体形式存在,包涵体经洗涤、尿素溶解、复性后具有抗菌生物活性。
融合基因;诱导表达;抑菌活性
Abstract :Considering that Nisin has a narrow antibacterial spectrum, rbLF-N with strong inhibitory activity against a wide range of bacteria was used to construct fusion gene Nisin-rbLF-N. The fusion gene was cloned into the expression vector pGEX-4T1, followed by transformation into the E. coli BL21 prokaryotic expression system for protein expression under IPTG induction.The expressed protein encoded by Nisin- rbLF-N gene was detected by Tricine-SDS-PAGE protein electrophoresis and it inhibitory activities against Gram positive and negative bacteria were also assayed. A considerable amount of fusion protein was expressed in E. coli BL21 cells and the protein was mainly found in inclusion bodies. The product obtained from the inclusion bodies subjected to washing, dissolution in 8 mol/L urea and protein refolding had good inhibitory activity against Gram positive bacteria rather than their negative counterparts.
Key words:fusion gene;inducible expression;antibacterial activity
乳链菌肽(nisin)又称乳酸链球菌素、尼生素等,它是由乳酸乳球菌某些菌株生长过程中产生的次级代谢产物。对食品传播的病原菌和腐败微生物有强的抑制作用[1]。食用后的Nisin在人体的生理pH值条件和α-胰凝乳蛋白酶作用下很快水解成氨基酸,不会改变人体肠道内正常菌群以及产生如其他抗菌素所出现的抗性问题,更不会与其他抗菌素出现交叉抗性,是一种高效、无毒、安全、性能卓越的天然食品防腐剂[2-3]。Nisin应用前景广阔,但存在局限性,它只具有G+菌抗性,而不能抑制食品中许多G-致病菌[4-5],因此扩大Nisin抗菌谱的研究不仅具有理论价值,而且具有十分重要的应用价值。
乳铁蛋白肽(LFcin)是乳铁蛋白在酸性环境下经胃蛋白酶作用N端释放的一段多肽,广泛存在于动物的多种组织中[6-7]。具有抗菌、抗病毒、抗癌、调节机体免疫等多种生物功能,在众多的功能中,抗菌功能是最引人注目的。乳铁蛋白活性多肽具有广谱抗菌性,对G+菌、G-菌、酵母菌、真菌等均有抗性,其中牛乳铁蛋白N端多肽(rbLF-N)的抗菌活性较其他的乳铁蛋白肽活性高,具有很好的应用前景[8-10]。
本研究针对Nisin抑菌谱窄的缺点及对rbLF-N的众多优点的考虑,选择对抗菌谱较广且具有较强抗性的rbLF-N为材料,构建Nisin-rbLF-N融合基因,并在原核表达系统中表达,尝试获得具有更强G+菌抗性和G-菌抗性的融合蛋白,以期为进一步构建性能优良的融合抗菌蛋白提供参考。
1 材料与方法
1.1 材料
新鲜牛肉购自北京市牛街清真市场。
1.2 表达载体与菌株
pGEM-T easy质粒 大连TaKaRa生物工程有限公司;pGEX-4T1表达质粒 中国农业大学食品与营养工程生物技术实验室;大肠杆菌E. coli DH5α、BL21(DE3)感受态 北京欣经科生物技术有限公司;干酪乳杆菌、大肠杆菌E. coli 本实验室保存。
1.3 工具酶与试剂
BamHⅠ和 EcoRⅠ酶制剂 NEB(北京)公司;T4连接酶 Promage公司;DNA Marker DL2000和DNA回收试剂盒 北京Tiangen生化科技有限公司;Tris-base、EDTA、X-Gal、IPTG、氨苄青霉素 Sigma公司;其他试剂均为国产分析纯;引物由TaKaRa生物工程(大连)有限公司合成。
1.4 仪器与设备
20G高速台式冷冻离心机、20G高速台式冷冻离心机 上海安亭科学仪器厂;LRH-150B型生化培养箱 广东省医疗器械厂;DYY-III31A/31B型电泳槽、DYY-III2型稳压稳流电泳仪 北京六一仪器厂;THZ-C型空气浴恒温振荡器 江苏太仓市实验设备厂;SX-300型凝胶成像系统 上海小源科技有限公司;REVCO超低温冰箱(-80℃) 美国来亨公司。
1.5 方法
1.5.1 Nisin基因优化及引物合成
根据Genebank公布的Nisin基因序列及蛋白序列,为使目的基因获得稳定表达,用适于在BL21中表达的密码子代替那些不适合于在其中表达的密码子优化Nisin基因[11],并在5'端和3'端设计EcoRⅠ和BamHⅠ酶切位点。优化后的Nisin基因序列由宝生物合成克隆于pMD19-T载体。根据目的序列分别设计引物,上游引物F1:5'-CGGGATCC ATGAGCACCAAAGAT-3';下游引物R1:5'-TTTGCTCACATGAATGCTGC-3'。由上海生工生物工程有限公司合成。在上游引物设计酶切位点EcoRⅠ(下划线标记)和保护碱基。
1.5.2 提取牛肉总DNA、引物合成
从牛肉中提取总DNA的方法参照文献[12],根据GenBank (Original accession number:NM180998) 已知的牛乳铁蛋白cDNA序列设计引物,上游引物F2:5'-GCAGCATTCATGTGAGCAAATGTCTGGCTGCCCCGA-3';下游引物R2:5'-CGGAATTC TTACCGGATAC ATGCCAAGGC-3',由上海生工生物工程有限公司合成。在上游引物设计与Nisin互补配对的序列(下划线标记),下游引物设计酶切位点BamHⅠ(下划线标记)、终止密码子和保护碱基。
1.5.3 重组质粒pGEM-T easy/Nisin- rbLF-N的构建与鉴定
以合成的pMD19-T/Nisin质粒为模板,用引物F1、R1进行PCR扩增Nisin基因为179bp,PCR产物纯化回收;以提取牛肉总DNA为模板,用引物F2、R2进行PCR扩增rbLF-N基因为181bp,PCR产物纯化回收;以纯化回收后的Nisin基因和rbLF-N基因为模板,用引物F1、R2进行PCR扩增,Nisin-rbLF-N融合基因约为336bp,PCR产物纯化回收后与pGEM-T easy载体连接,并转化E. coli DH5α,用PCR及EcoRⅠ和BamHⅠ双酶切鉴定阳性克隆。PCR参数为:95℃、4min,94℃、30s;退火温度58℃、60s,延伸72℃、30s,35个循环、72℃保温10min。
1.5.4 重组表达质粒pGEX-4T1/Nisin-rbLF-N和基因工程菌的构建
用EcoRⅠ和BamHⅠ双酶切pGEM-T easy/NisinrbLF-N质粒,琼脂糖凝胶电泳分离后,回收NisinrbLF-N片段,并将其连接到以同样酶切割的载体pGEX-4T1上,构建表达载体,重组质粒进行酶切鉴定。将重组表达质粒pGEX-4T1/Nisin-rbLF-N转化E. coli BL21(DE3),构建基因工程菌株。插入pGEX-4T1中的Nisin-rbLF-N基因序列分析由上海生工生物工程有限公司完成。
1.5.5 Nisin-rbLF-N融合基因的诱导表达[13-15]
挑取含有重组质粒的BL21(DE3)白色菌落接种于LB液体培养基中37℃过夜培养,按体积分数5%接种于LB液体培养中于37℃扩大培养直至菌液OD600nm值达0.6~0.8时;加入IPTG使其终浓度为1mmol/L,继续培养4h;将菌液离心(5000×g,离心10min)收集菌体与pH7.3的0.01mol/L PBS缓冲液中超声破碎7s,间隔10s,共15次。于4℃、2000×g离心15min,弃去沉淀(基本为菌体和碎片),上清液于12000×g离心30min,收集沉淀(包涵体)。
1.5.6 表达产物的复性及抗菌活性的初步检测
将收集的包涵体用8mol/L尿素溶解,采用浓度梯度透析复性[16]。复性透析溶液Ⅰ至Ⅵ分别是6、4、2、1、0.5、0mol/L尿素与20mmol/L Tris-HCl,500mmol/L NaCl溶液配制的pH8.0溶液,每一溶液透析复性8h,复性后溶液于5000×g离心20min收集上清。测试菌株为本实验室保存的干酪乳杆菌和大肠杆菌,采用琼脂扩散法检测抗菌活性。
2 结果与分析
2.1 目的基因的获得和重组质粒双酶切鉴定
以合成的pMD19-T/Nisin质粒为模板,用引物F1、R1进行PCR扩增Nisin基因片段,以提取牛肉总DNA为模板,用引物F2、R2进行PCR扩增rbLF-N基因片段(图1)。以纯化回收后的Nisin基因片段和rbLF-N基因片段为模板,用引物F1、R2进行PCR扩增Nisin-rbLF-N融合基因片段(图2)。由图1可以看出,在靠近250bp附近有两条亮带,大小与欲扩增的目的基因片段相符(Nisin基因为179bp,rbLF-N基因为181bp)。由图2可以看出,在靠近500bp附近有一条亮带,测序结果证明与欲扩增的目的基因片段(336bp)的序列相吻合,其编码的氨基酸阅读框不变。
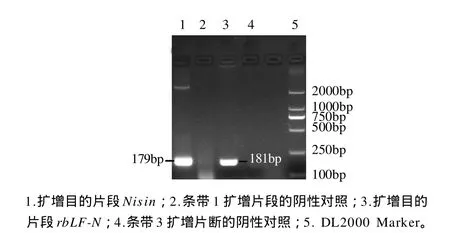
图1 目的基因PCR产物Fig.1 Agarose gel electrophoretic patterns of PCR products of the target gene
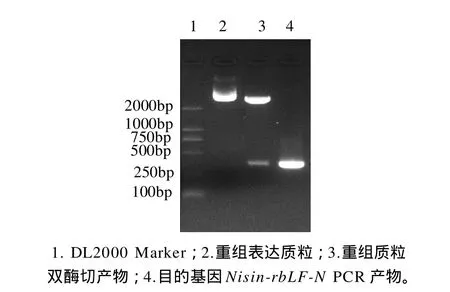
图2 重组质粒酶切结果Fig.2 Agarose gel electrophoretic patterns of PCR products of recombinant plasmid pGEX-4T containing Nisin-rbLF-N gene digested by EcoRⅠand BamHⅠtogether
2.2 重组融合蛋白的表达
Nisin-rbLF-N基因全长336bp,加上谷胱甘肽S-转移酶(GST)编码区,重组蛋白由333个氨基酸构成。工程菌经IPTG诱导后,Nisin-rbLF-N基因得到了高效表达,菌体总蛋白中出现了分子质量约为38kD的重组融合蛋白(图3),并且融合蛋白的表达量占到菌体蛋白总量的25.3%,产率为1.63g/L。菌体经超声破碎、离心、Tricine-SDS-PAGE分析[17]发现,Nisin-rbLF-N-GST重组融合蛋白主要以包涵体的形式存在。
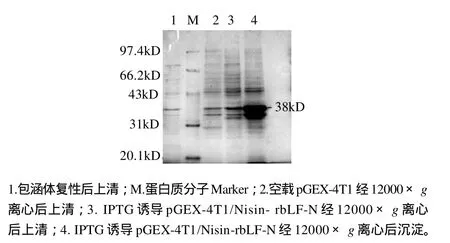
图3 GST-Nisin- rbLF-N融合蛋白在大肠杆菌中的表达Fig.3 SDS-PAGE patterns showing the heterologous expression of GST-Nisin- rbLF-N fusion protein in E. coli BL21 (DE3)
2.3 重组蛋白的复性及抗菌活性的初步检测
将离心得到的包涵体用8mol/L尿素溶解,最终质量浓度为0.2g/L,采用浓度梯度透析复性。由图3可以看出,复性后的上清液中含有目的蛋白(箭头表示),但复性率仅为13.32%,融合蛋白含量为0.027g/L。取复性后上清液,采用琼脂扩散法检测抗菌活性,测试菌株为本实验室保存的干酪乳杆菌(G+菌)和大肠杆菌(G-菌),抗菌活性见图4、5。抑菌活性检测表明,Nisin-rbLF-NGST融合蛋白具有革兰氏阳性菌抗性,但没有革兰氏阴性菌抗性。

图4 融合蛋白对G+菌的抑菌活性Fig.4 Inhibitory effect of GST-Nisin-rbLF-N fusion protein on Gram positive bacteria

图5 融合蛋白对G-菌的抑菌活性Fig.5 Noninhibitory effect of GST-Nisin-rbLF-N fusion protein on Gram negative bacteria
3 讨 论
Nisin是目前国际上最为看好和应用效果最好的微生物型天然食品防腐剂,但也存在局限性,如不能够抑制G-、酵母菌以及霉菌,在中性及碱性环境中溶解度低、不稳定而且抗菌效果大大降低等[2-3],而且由于Nisin复杂的翻译后加工及其独特的分子结构,单纯对其基因进行改造以扩大其抗菌谱及提高其活性难度较大。因此尝试通过构建融合基因来扩大Nisin的抗菌谱,得到同时抗G-菌和G+菌的融合蛋白,并将其在原核表达系统中进行表达,以期获得广谱的重组蛋白生产菌株。
rbLF-N具有广谱抗菌性,对G+菌、G-菌、酵母菌、真菌等均有抗性,并且因为rbLF-N来源于动物本身,具有传统抗生素没有的作用效果,而且它不会使细菌产生抗药性,也不会残留于产品中,加之其物化性质和生物学活性独特,是一种健康安全的产品[6-8]。
本研究将Nisin基因与rbLF-N基因相连,考虑到Nisin复杂的成熟过程,在设计融合基因时,将Nisin设计在融合基因的N端,得到融合基因Nisin-rbLF-N,连接到克隆载体上,经过双酶切目的片段连接到表达载体pGEX-4T1上转化到大肠杆菌BL21(DE3)中表达。选用的pEGX-4T1质粒是表达GST融合蛋白的大肠杆菌高效表达载体,选择该载体的主要原因是:1)含有非常强的tac启动子,IPTG可诱导目的基因的高效表达;2)表达产物利于分离纯化:融合蛋白可通过谷胱甘肽S-转移酶(GST)亲和层析纯化,温和的抽提条件对融合蛋白的抗原性和功能活性影响极小,再用凝血酶或Xa因子将GST切除,可方便地获得目的蛋白[8]。
大肠杆菌是目前最常用的外源蛋白表达菌株,容易培养、生长迅速、周期短,成本低,以及有大量可供选择的克隆载体与表达载体,成为人们克隆表达外源基因的主要菌株。但表达的蛋白多以包涵体形式存在,包涵体是具有膜结构的非结晶性蛋白质聚集体,无生物活性。因此需要用变性剂对包涵体进行处理,在适当的条件下使它经过变性/复性才能具有天然结构和活性。本研究采用浓度梯度透析法对融合蛋白包涵体进行了体外复性,经复性后的融合蛋白进行抗菌活性测定,结果表明Nisin- rbLF-N-GST融合蛋白只具有革兰氏阳性菌抗性,但没有革兰氏阴性菌抗性,分析产生这样的原因可能有:一是复性率低,仅为13.32%,目的融合蛋白含量减少到0.027g/L,这对抑菌的效果产生了很大影响,因此有必要对Nisin-rbLF-N-GST融合蛋白复性条件(蛋白的初始质量浓度、pH值、温度、尿素浓度)的优化做进一步研究,减少目的融合蛋白的损失,同时尝试将融合基因Nisin-rbLF-N转入毕赤酵母中进行可溶性表达;二是复性可能造成目的融合蛋白的功能损失,要对如何减少或避免因复性造成功能损失做进一步研究,如在复性溶液中加入低分子质量的还原和氧化的含硫基化合物,提供合适的氧化还原电位,帮助二硫键的正确形成。
[1] 张百刚, 高华. Nisin抑菌作用的研究[J]. 中国乳品工业, 2008, 36(10): 26-30.
[2] DELVES-BROUGHTON J. Nisin as a food preservative[J]. Food Australia, 2005, 57(12): 525-527.
[3] 王立国. 乳酸链球菌素(nisin)在食品中的应用[J]. 食品研究与开发,2008, 29(10): 177-180.
[4] de RUYTER P G, KUIPERS O P, BEERTHUVZEN M M, et al.Functional analysis of promoters in the nisin gene cluster of Lactococcus lactis[J]. Journal of Bacterilogy, 1996, 178(12): 3434-3439.
[5] GUIOTO A, POZZOBON M, CANEVARI M, et al. PEGylation of the antimicrobial peptide nisin A: problems and perspectives[J]. Farmaco,2003, 58(1): 45-50.
[6] LUO Hongxia, CHEN Shangwu, REN Fazheng, et a1. In vitro reconstitution of anti-bacterial pathogen activity by expressed recombinant bovine lactoferrin N-terminal peptide in Escherichia coli[J]. Journal Dairy Research, 2007, 74(2): 1-6.
[7] BELLAMY W, TAKASE M, WAKABAYASHI H, et al. Antibacterial spectrum of lactoferricin B, a potent bactericidal peptide derived from the N-termrinal egion of bovine lactoferrin[J]. Journal of Applied Bacteriology,1992, 73(6): 472-479.
[8] 罗红霞. 牛乳铁蛋白N末端多肽基因的克隆、表达及抗菌活性的研究[D]. 北京: 中国农业大学, 2006.
[9] 高树新, 韩玉国, 苏道, 等. 乳铁蛋白及其生理机能的研究进展[J].中国牛业科学, 2008, 34(2): 44-47.
[10] FARNAUD S, EVANS R W. Lactoferrin: a multifunctional protein with antimicrobial properties[J]. Molecular Immunology, 2003, 40: 395-405.
[11] 秦伟, 黄昆仑, 罗云波, 等. 水稻密码子优化的cry2A冰基因在大肠杆菌中的表达及其表达产物的纯化[J]. 食品科学, 2008, 29(7): 267-271.
[12] 罗红霞, 郭慧媛, 林少华, 等. 鲁西黄牛乳铁蛋白N-末端多肽基因的表达与活性检测[J]. 中国乳品工业, 2005, 33(12): 4-7.
[13] SALUTA M, BELL P A. Troubleshooting GST fusion protein expression in E. coli[J]. Life Science News, 1998, 1: 1-3.
[14] ERGIN A, BüSSOW K, SIEPER J, et al. Homologous high-throughput expression and purification of highly conserved E. coli proteins[J].Microb Cell Fact, 2007, 6(1): 18.
[15] 许文涛, 黄昆仑, 罗云波. bar基因在大肠杆菌中的高效表达及其表达产物的分离和纯化[J]. 农业生物技术学报, 2004, 12(5): 583-588.
[16] 杨晓仪, 林键, 吴文言. 重组蛋白包涵体的复性研究[J]. 生命科学研究, 2004, 8(2): 100-105.
[17] 郭尧君. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 1999.
Construction of Nisin-rbLF-N Fusion Gene and Its Expression in Escherichia coli
YUAN Xiao-yu1,XU Wen-tao2,HUANG Kun-lun2,LUO Yun-bo2,GU Xin-xi1,TIAN Hong-tao1,2,*
(1. College of Food Science and Technology, Hebei Agricultural University, Baoding 071001, China;2. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Q786
A
1002-6630(2010)15-0194-04
2009-10-05
国家“863”计划项目(2006AA10Z440);农业部“948”项目(2007-Z8)
袁晓宇(1982—),女,硕士,研究方向为益生菌的开发利用。E-mail:yuanxiaoyu168521@yahoo.com.cn
*通信作者:田洪涛(1963—),男,教授,博士,研究方向为发酵工程。E-mail:cauxwt@yahoo.cn
