海洋小链霉菌DY2741抗菌物质的溶解性质及分离纯化
2010-09-13蔡敬民潘仁瑞
刘 伟,徐 涛,蔡敬民,*,潘仁瑞,吴 缨
(1.安徽农业大学生命科学学院,安徽 合肥 230036;2.合肥学院生物与环境工程系,安徽 合肥 230022;3.合肥学院化学与材料工程系,安徽 合肥 230022)
海洋小链霉菌DY2741抗菌物质的溶解性质及分离纯化
刘 伟1,2,徐 涛2,蔡敬民1,2,*,潘仁瑞2,吴 缨3
(1.安徽农业大学生命科学学院,安徽 合肥 230036;2.合肥学院生物与环境工程系,安徽 合肥 230022;3.合肥学院化学与材料工程系,安徽 合肥 230022)
在拮抗金黄色葡萄球菌和大肠杆菌活性的指示下将一株海洋小链霉菌DY2741的代谢产物分离纯化。通过对该菌发酵液中抗菌物质的溶解性质测定,可推知该物质极性中等。Sephadex LH-20柱色谱分离后,经抗菌活性检测发现两个活性峰,其中第2个峰的抑菌活性较强。将第2个峰的洗脱液各组分进行薄层色谱分析,选取斑点清晰且单一的组分进行气相色谱-质谱联用分析,总离子流图表明该组分成分单一,根据质谱图谱与标准谱库比对以及红外光谱分析,初步判断该组分为邻苯二甲酸二丁酯(DBP)。该成分为小链霉菌DY2741的主要抗菌物质之一。
海洋小链霉菌;抗菌物质;溶解性质;分离纯化
Abstract:One aliquot of the fermentation supernatant of Streptomyces parvus DY2741 using soybean powder as substrate was vacuum dried and the residue was extracted with water or 5 different organic solvent alone. The ethyl acetate extract was found to have good inhibitory activity against both S. aureus and E. coli. Another aliquot of the fermentation supernatant was directly extracted with ethyl acetate 3 times and the extracts were then pooled and condensed in a rotation evaporator and blown to dryness under nitrogen. Finally, the residue was dissolved in methanol and filtrated before purification/fractionization on Sephadex LH-20 column. As a result, two antibacterial fractions were obtained and the second eluting peak presented stronger inhibitory activities against both bacterial species. Thin layer chromatography was used to further fractionize the fraction with higher antibacterial activity. The subfaraction displaying a clear single spot was demonstrated by gas chromatography-mass spectrometry to contain a single composition, which was preliminarily identified to be dibutyl phthalate (DBP) based on searching Wiley Registry of Mass Spectral Data and infrared spectral analysis. Therefore, DBP is one of the major antibacterial substances produced by Streptomyces parvus DY2741.
Key words:marine Streptomyces parvus;antibacterial substance;solubility;separation and purification
海洋巨大的资源库意味着巨大的财富,因此在20世纪90年代引起各国学者研究热潮。海洋环境的独特性和极端性特点,所发现的抗生素往往是新颖的,可能具有很好的应用前景。国内很早就使用海洋生物治疗疾病,但从海洋微生物中寻找抗菌物质的研究则起步较晚,黄维真等[1]在福建鼓浪屿沿海的海泥中分离到一株海洋放线菌——鲁特格链霉菌鼓浪屿亚种(Str. rutgersensis subsp. gulangyunensis),它产生广谱、低毒性的抗生物质(minobiosamine)和肌醇胺霉素等,对绿脓杆菌和一些耐药性革兰氏阴性菌具有较强的抗性。王书锦等[2]在黄、渤海、辽宁近海地区采样,分离到5608株海洋细菌,测定表明,约有25%的菌株具有不同程度的抗病原真菌、病原细菌的能力。刘全永等[3]从海洋细菌LUB02中分离到广谱抗真菌活性物质,对人和动物条件病原菌白色念珠菌(Candida albicans)有较强的抑制作用。王莹等[4]从东海温州海域采样,分离到195株海洋细菌,筛选出22株菌具有抗菌活性,并对其中抗菌活性较强的6株进行16S rDNA序列分析。近年来不断有新发现的海洋微生物菌种及其产生新的抗菌物质的报道[5-6]。
因此,从海洋中筛选产高效、新颖、低毒的抗菌活性物质潜力巨大。本实验室从厦门附近海域筛选到一株具有广谱抗菌活性的小链霉菌。本实验在研究其抗菌物质溶解性质的基础上,采用Sephadex LH-20柱色谱进行分离、纯化,使用气相色谱-质谱联用(GC-MS)和红外光谱研究其成分。为进一步研究和确定小链霉菌DY2741的代谢产物提供重要参考。
1 材料与方法
1.1 菌种
小链霉菌DY2741自厦门大屿岛海域潮间带海洋软体动物中分离。抗菌活性检测指示菌株:革兰氏阳性金黄色葡萄球菌(S.aureus)、革兰氏阴性菌大肠杆菌(E.coli)来源于合肥学院生物与环境工程系菌种保藏中心。
1.2 培养基
菌株DY2741培养用培养基:1)菌株斜面培养保存培养基:高氏合成Ⅰ号培养基[7];2)菌种种子培养基:葡萄糖酵母粉培养基[7];3)菌株液体发酵培养基:黄豆粉培养基[8]。链霉菌DY2741所用培养基均为人工海水配制,所有培养基均于121℃灭菌20min。指示菌培养基:牛肉膏蛋白胨培养基[7]。
1.3 仪器与设备
QP5050气相色谱-质谱联用仪 日本岛津公司;Nicolet 8700傅里叶红外光谱仪 美国热电仪器公司;RE-52C旋转蒸发仪 上海青浦沪西仪器厂;NAS-12氮吹仪 合肥艾本森科学仪器有限公司;SP-752紫外-可见分光光度计 上海光谱仪器有限公司。
1.4 菌种DY2741发酵液的制备
将小链霉菌DY2741接种于高氏Ⅰ号合成培养基斜面上,28℃培养7d。取新鲜培养的DY2741斜面用10mL无菌水洗下孢子,振荡,制成菌悬液。将菌悬液按体积分数10%的接种量接种于种子培养基中,于28℃、180r/min培养3d。然后按体积分数5%的接种量接种于发酵培养基中,于28℃、180r/min培养5d。收集发酵液,5000r/min离心15min,丢弃菌体,留上清。
1.5 指示菌平板的制备
将金黄色葡萄球菌和大肠杆菌接种于牛肉膏蛋白胨培养基斜面上,37℃培养24h。取新鲜培养的指示菌斜面用0.85g/100mL的生理盐水洗下,并将其稀释成109个/mL的菌悬液(波长650nm,控制透光率为20%)。取5mL经调整到达合适浓度的指示菌菌悬液,同100mL冷却至60℃的牛肉膏蛋白胨培养基充分混合,倾注于平皿中。
1.6 抗菌物质在不同溶剂中的溶解性测定
取发酵上清液,每份10mL,经真空冷冻干燥成粉后,分别加入无菌水、甲醇、正丁醇、乙酸乙酯、二氯甲烷、石油醚各1mL萃取过夜,以各个纯溶剂为对照。采用管碟法[9]以金黄色葡萄球菌和大肠杆菌为指示菌进行萃取液的抑菌活性测定。测量抑菌圈直径并记录抑菌结果,所有实验重复3次。
1.7 不同pH值下不同萃取剂的萃取实验
取发酵上清液,每份10mL,分别调节发酵液pH值至3.0、4.0、5.0、6.0、7.0、8.0、9.0,加入等量的乙酸乙酯,充分混匀,静置萃取过夜。采用管碟法以金黄色葡萄球菌和大肠杆菌为指示菌分别检测有机相和下层水相(pH值调回7.0)的抑菌活性,设纯溶剂为对照组。测量抑菌圈直径并记录抑菌结果,所有实验重复3次。
1.8 发酵液的萃取实验
取发酵液上清,调整pH值至7.0,用等体积的乙酸乙酯萃取3次,合并萃取液以旋转蒸发仪浓缩、氮吹仪吹干,加入少量甲醇溶解后用0.22μm的尼龙微孔滤膜过滤备用。
1.9 Sephadex LH-20柱色谱分离
将经萃取处理的浓缩液进行葡聚糖凝胶色谱分离,所用色谱分离介质为Sephadex LH-20(2.6cm×100cm),以体积分数1%上样体积进行凝胶层析。1.5L洗脱液,其组成为甲醇与水体积比6:4,流速为1mL/min,每管收集7mL。通过薄层色谱法(TLC)分析,合并相同组分并减压浓缩,冻干,适量甲醇溶解。采用管碟法以金黄色葡萄球菌和大肠杆菌为指示菌检测洗脱液的抑菌活性,每个牛津杯中加入200μL洗脱液。测量抑菌圈直径并记录抑菌结果。
1.10 活性成分分析
薄层色谱分析:薄层板为Merck Silica gel 60 F254,展开剂为石油醚、乙酸乙酯、甲醇其体积比为3:1:0.5,紫外灯254、365nm波长处显影和茴香醛染色观察。
GC-MS分析:毛细管色谱柱型号为Rtx-5ms(30m×0.25mm,0.25μm),柱温升温程序:初始升温150℃,保持4min,以4℃/min升温至250℃,保持10min[10];进样量:5μL,全扫描质量范围:m/z 40~400。样品分析前经0.22μm尼龙微孔滤膜过滤。
傅里叶红外变换光谱分析:将1mg样品加入到干燥的KBr晶体粉末中,压片后再转移至窗片中央直接测定。样品测定前先用KBr晶体粉末做空白实验测定,样品实测的FTIR均需扣去空白峰,以消除空气中水汽影响。分辨率:4cm-1,扫描次数:32次,增强因子:1.8,半峰宽:20.2cm-1。
1.11 数据处理
2 结果与分析
2.1 抗菌物质的溶解性测定
2.1.1 抗菌物质在不同溶剂中的溶解性质
发酵上清液冻干粉在不同溶剂中溶解后,通过萃取液对细菌的抑菌活性大小反映抗菌物质在不同溶剂中的溶解性质,结果见表1。
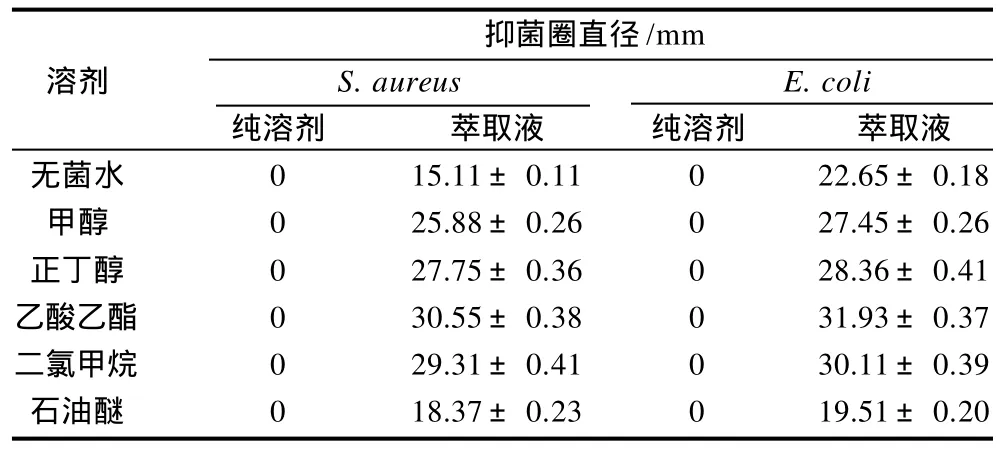
表1 抗菌物质在不同溶剂中的溶解情况Table 1 Anti-S. aureus and E. coli activities of different solvent extracts of the freeze-dried residue of the fermentation supernatant of Streptomyces parvus DY2741
从表1可以看出,乙酸乙酯萃取液对金黄色葡萄球菌和大肠杆菌的抑菌圈直径最大,其次是二氯甲烷、正丁醇,其他溶剂抑菌活性相对较低。由此可推知,该抗菌物质可能是一种中等极性的脂溶性物质。抗菌物质在乙酸乙酯中的溶解性最好,也可溶于正丁醇、氯仿和甲醇,微溶于石油醚和水,抗菌物质溶解性质的研究结果为进一步分离纯化提供了理论参考。
2.1.2 不同pH值条件下不同萃取物的抑菌效果
为了进一步分离纯化小链霉菌DY2741的抗菌物质,应研究其极性,因此对发酵液不同pH值条件下抗菌物质的萃取效果进行研究。萃取剂与不同pH值的发酵上清液的体积比为1:1。萃取相(有机相)及水相的抑菌活性见表2。
从表2可以看出,在不同pH值条件下乙酸乙酯的水相均表现为抑菌圈为0mm,无抑菌活性;而有机相的抑菌圈大小与pH值存在相关性。在接近pH值中性条件下有机相的抑菌圈直径最大。对照组(纯溶剂)均无抑菌活性。由此判断该抗菌物质极性中等。
2.2 Sephadex LH-20柱色谱分离组分的抑菌活性
为了分离纯化经乙酸乙酯萃取的粗提物,使用Sephadex LH-20柱色谱进行分离,共收集洗脱液182管。以金黄色葡萄球菌和大肠杆菌为指示菌检测洗脱液的抑菌活性,结果见图1。

图1 Sephadex LH-20柱色谱分离后洗脱液的抑菌活性Fig.1 Anti-S. aureus and E. coli activities of each elution fraction of the ethyl acetate (at pH 7) extract of the fermentation supernatant of Streptomyces parvus DY2741 on Sephadex LH-20 column
由图1可知,洗脱液经检测出现了两个抑菌活性峰,B峰对金黄色葡萄球菌和大肠杆菌都有明显的抑菌活性,故选取此峰作进一步研究。
2.3 活性成分分析
对B峰中各组分进行薄层色谱(TLC)分析,其中89~97管样品Rf=0.25,紫外、荧光显影和茴香醛染色显示其斑点单一且清晰,提示该样品组分单一。
对89~97管样品进行气质联用(GC-MS)分析,总离子流图(TIC)为单一峰(图2);MS图谱(图3)与标准谱库WILEY7(图4)进行比对,该组分与邻苯二甲酸二丁酯(DBP)相似度达87%。

表2 在不同pH值条件下萃取物的抑菌活性Table 2 Anti-S. aureus and E. coli activities of lower and upper phases resulting from extraction of the fermentation supernatant of Streptomyces parvus DY2741 with ethyl acetate under varying pH conditions
89~97管样品的红外光谱分析如下:1706cm-1对应于C=O的伸缩振动,1289cm-1和1136cm-1对应于C—O的伸缩振动,推测该化合物结构中有酯键。3067cm-1对应于芳环上C—H的伸缩振动,1600cm-1处的组合峰对应于芳环上C—C的的伸缩振动,推测该化合物结构中有苯环。2958cm-1对应于甲基(—CH3)的C—H伸缩振动,2930cm-1和2856cm-1对应于亚甲基(—CH2—)的C—H伸缩振动,1456cm-1对应于甲基(—CH3)不对称变形振动或是亚甲基(—CH2—)对称变形振动。综上所述,该物质红外光谱具有明显的芳香酯类特征。
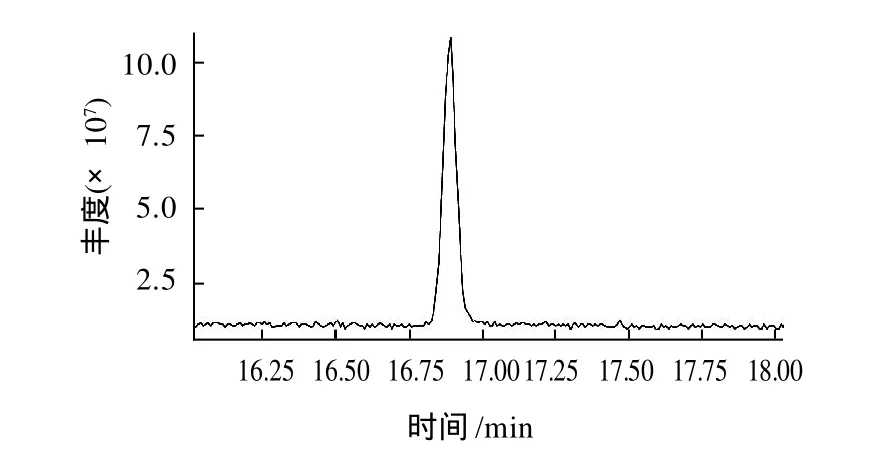
图2 89~97管样品总离子流图(TIC)Fig.2 Total ion chromatogram (TIC) of pooled fractions 89 through 97
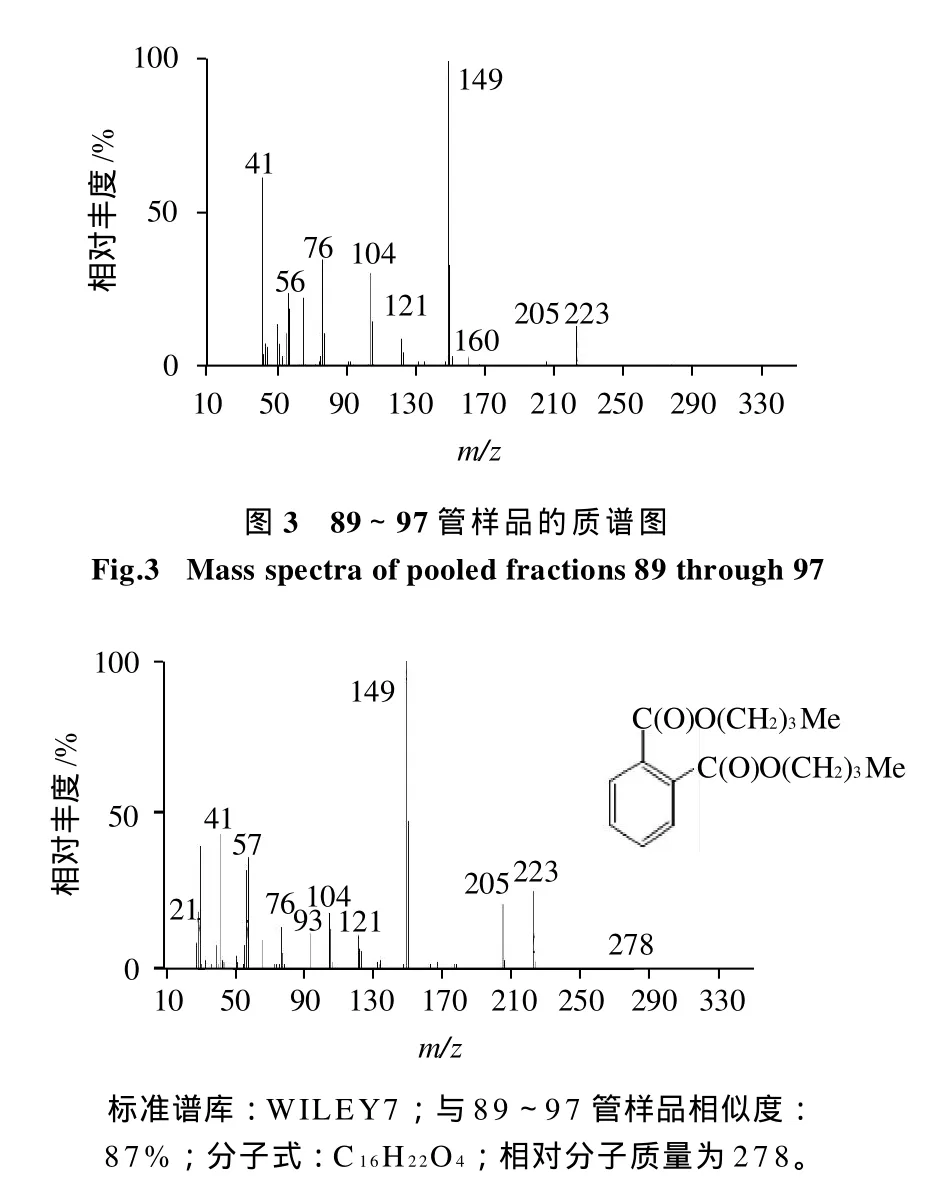
图4 标准谱库中邻苯二甲酸二丁酯(DBP)质谱图Fig.4 Standard mass spectrum of DBP
El-Naggar[11]报道了链霉菌Streptomyces nasri submutant H35产生的邻苯二甲酸二丁酯(DBP)具有抗菌活性。不久,Lee[12]报道链霉菌Str. melanosporofaciens也产DBP,证明它是葡萄糖苷酶的抑制剂。Roy等[10]研究表明链霉菌Str. albidoflavus产生的DBP对G+细菌G-细菌及单细胞的和丝状真菌都有较强的活性;动物实验未观察到急性毒性。Foster等[13]报道DBP对SD大鼠的最小可见损害作用水平为66mg/(kg bw·d)。Mylchreest等[14]报道大剂量给药(650mg/(kg bw·d))会导致繁殖力下降,减少精子数量和精子畸形。Watanuki等[15]报道DBP对吞噬细胞功能有调节作用。因此,DBP的药理及毒理作用有待进一步研究。目前,未发现有小链霉菌产生DBP的报道。因此,其生物合成和药物作用机理等方面值得进一步研究。
3 结 论
本实验室自厦门海域采集的海洋软体动物中分离得到一株小链霉菌DY2741,其发酵产物具有较强的抗菌活性,对大肠杆菌、金黄色葡萄球菌等致病菌均有较好的抑菌效果。通过对其溶解性质分析初步确定菌株DY2741的抗菌产物为中等极性抗菌物质。Sephadex LH-20柱色谱将其分离,通过金黄色葡萄球菌和大肠杆菌为指示菌检测洗脱液的抑菌活性,出现两个活性峰。其中B峰对金黄色葡萄球菌和大肠杆菌均有较好的抑菌效果。通过对B峰的洗脱液各组分进行薄层色谱分析,选取斑点清晰且单一的89~97管样品进行气相色谱-质谱联用分析,总离子流图表明该组分成分单一;根据质谱图谱与标准谱库WILEY7对比及FTIR光谱分析,初步判断该组分为邻苯二甲酸二丁酯(DBP)。
[1] 黄维真, 方金瑞, 苏国成, 等. 福建沿海底栖放线菌及其产生的抗菌物质[J]. 中国海洋药物, 1991, 10(3): 1-6.
[2] 王书锦, 胡江春, 薛德林, 等. 中国黄海、渤海、辽宁近海地区海洋微生物资源的研究[J]. 锦州师范学院学报, 2001, 22(1): 1-5.
[3] 刘全永, 胡江春, 薛德林, 等. 海洋微生物生物活性物质研究[J]. 应用生态学报, 2002, 13(7): 901-905.
[4] 王莹, 吴根福. 东海海洋有抗菌活性细菌的筛选及系统发育分析[J].农机化研究, 2007(5): 34-38.
[5] CHO K W, LEE H S, RHO J R, et al. New lactone-containing metabolites from a marine-derived bacterium of the genus Streptomyces[J].Journal of Natural Products, 2001, 64(5): 664-667.
[6] MUKKU V J, SPEITLING M, LAATSCH H, et al. New butenolides from two marine Streptomycetes[J]. Journal of Natural Products, 2000,63(11): 1570-1572.
[7] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999: 214-215.
[8] ZHENG Zhonghui, ZENG Wei, HUANG Yaojian, et al. Detection of antitumor and antimicrobial activities in marine organism associated actinomycetes isolated from the Taiwan Strait, China[J]. FEMS Microbiol Lett, 2000, 188(1): 87-91.
[9] 周德庆. 微生物学实验手册[M]. 上海: 上海科学技术出版社, 1986.
[10] ROY R N, LASKAR S, SEN S K. Dibutyl phthalate the bioactive compound produced by Streptomyces albidoflavus 321.2[J]. Microbiol Res, 2006, 161(2): 121-126.
[11] EL-NAGGAR M Y M. Dibutyl phthalate and the antitumor agent F5A1,two metabolites produced by Streptomyces nasri submutant H35[J].Biomed Lett, 1997, 55: 125-131.
[12] LEE D S. Dibutyl phthalate, an α-glucosidase inhibitor from Streptomyces melanosporofaciens[J]. J Biosci Bioeng, 2000, 89(3): 271-273.
[13] FOSTER P M D, CATTLEY R C, MYLCHREEST E. Effects of di-nbutyl phthalate (DBP) on male reproductive development in rat: implications for human risk assessment[J]. Food Chem Toxicol, 2000, 38(Suppl 1): 97-99.
[14] MYLCHREEST E, SAR M, CATTLEY R C, et al. Disruption of androgen-regulated male reproductive development by di(n-butyl) phthalate during late gestation in rats is different from flutamide[J]. Toxicol Appl Pharmacol, 1999, 156(2): 81-95.
[15] WATANUKI H, GUSHIKEN Y, SAKAI M. In vitro modulation of common carp (Cyprinus carpio L.) phagocytic cells by di-n-butyl phthalate and di-2-ethylhexyl phthalate[J]. Aquat Toxical, 2003, 63(2): 119-126.
Isolation, Purification and Solubility of Antibacterial Substances from Fermentation Supernatant of Marine Streptomyces parvus DY2741
LIU Wei1,2,XU Tao2,CAI Jing-min1,2,*,PAN Ren-rui2,WU Ying3
(1. School of Life Sciences, Anhui Agricultural University, Hefei 230036, China;2. Department of Biological and Environmental Engineering, Hefei University, Hefei 230022, China;3. Department of Chemical and Materials Engineering, Hefei University, Hefei 230022, China)
R282.77
A
1002-6630(2010)15-0177-04
2010-04-07
安徽省优秀青年科技基金项目(04043051);国家自然科学基金项目(30270321);
合肥学院(引进)人才科研启动基金计划项目(08RC12);安徽省教育厅自然科学研究项目(KJ2008B229)
刘伟(1982—),男,硕士研究生,主要从事海洋微生物天然产物研究。E-mail:bbliuwei@foxmail.com
*通信作者:蔡敬民(1963—),男,教授,博士,主要从事微生物酶学和海洋微生物活性产物研究。E-mail:caijingmin@hfuu.edu.cn
