表没食子儿茶素没食子酸酯的甲基化分子修饰
2010-09-13吕海鹏孙业良谭俊峰
吕海鹏,孙业良,林 智*,谭俊峰,郭 丽
(中国农业科学院茶叶研究所,茶叶加工工程研究中心,浙江 杭州 310008)
表没食子儿茶素没食子酸酯的甲基化分子修饰
吕海鹏,孙业良,林 智*,谭俊峰,郭 丽
(中国农业科学院茶叶研究所,茶叶加工工程研究中心,浙江 杭州 310008)
研究表没食子儿茶素没食子酸酯(EGCG)的甲基化分子修饰。以碘甲烷作为甲基供体,采用化学合成方法研究EGCG的甲基化分子修饰,并通过HPLC-MS和NMR等对反应产物进行结构鉴定。结果表明:采用化学合成方法能有效完成EGCG的甲基化分子修饰,并分离鉴定出5个EGCG甲基化衍生物,分别为4″-Me-EGCG、4′,4″-di-Me-EGCG、5,3′,4′,5′,3″,4″,5″-hepta-Me-EGCG、5,7,3′,4′,3″,4″,5″-hepta-Me-EGCG、5,7,3′,4′,5′,3″,4″,5″-octa-Me-EGCG。
表没食子儿茶素没食子酸酯;甲基化;分子修饰;碘甲烷;化学合成
Abstract :For EGCG methylation via chemosynthesis, methyl iodide was used as methyl donor and two reaction systems (No.1 and No.2) were designed, in which the molar ratios between EGCG and methyl iodide were set at 1:80 and 1:1, respectively.Reaction products TRI-1 and TRI-2 obtained from reaction system No.1 and No.2, respectively were characterized by HPLCMS and NMR. The results showed that the molecular modification of EGCG could be successfully accomplished by the use of chemosynthesis, and five EGCG derivatives, namely 4″-Me-EGCG, 4′,4″-di-Me-EGCG, 5,3′,4′,5′,3″,4″,5″-hepta- Me-EGCG, 5,7,3′,4′,3″,4″,5″-hepta- Me-EGCG and 5,7,3′,4′,5′,3″,4″,5″-octa- Me-EGCG were identified in the two reaction products, of which, 3 were contained in reaction product TRI-1 and 2 in reaction product TRI-2.
Key words:EGCG;methylation;molecular modification;methyl iodide;chemosynthesis
表没食子儿茶素没食子酸(EGCG)有多种保健功能,是茶叶中的核心功能活性成分之一,在医药和食品研究领域倍受关注。近年来,随着研究的不断深入,发现EGCG经分子修饰后形成的一些衍生物生物利用度明显提高,并且在某些方面表现出了比EGCG更强的生理活性,例如甲基化儿茶素具有更强的抗过敏活性[1]、乙酰化儿茶素对蛋白酶具有更强的抑制活性[2]、糖苷化儿茶素具有更强的抗褐变活性[3]、以及酯化制备所得到的脂溶性儿茶素在水不溶体系中也能充分发挥其优越的抗氧化性能[4]等。因此,EGCG的分子修饰及其产物已经成为了当前茶叶天然产物研究领域的热点之一[5-7]。
甲基儿茶素的天然资源十分有限,在茶叶中含量普遍较低,只有极少数的茶树品种中的甲基儿茶素的含量在1%以上[8-11];可见,仅靠从茶叶中提取制备不能满足当前研究和后续产品开发等多方面的需求;如果能够利用现有的茶叶提取物(茶多酚或儿茶素单体)为原料,通过化学合成等方法制备甲基儿茶素,对于今后进一步研究甲基儿茶素及其天然药物和功能食品将具有重要的理论意义和实际应用价值。目前,一些类型的甲基儿茶素(如EGCG 4′Me、EGCG 4″Me)的化学合成已有初步报道[12-13]。
本研究从化学合成的角度出发,采用碘甲烷为甲基供体,以EGCG为反应底物,通过控制反应条件合成系列甲基EGCG衍生物,并采用HPLC-MS和NMR对其结构进行鉴定,探索EGCG甲基化分子修饰的反应体系。
1 材料与方法
1.1 材料、试剂与仪器
EGCG(纯度为98%) 杭州禾田生物技术有限公司;碘甲烷、碳酸钾、丙酮均为分析纯;乙腈、甲醇均为色谱纯;氘代氯仿、氘代甲醇、氘代二甲基亚砜(DMSO)均为光谱纯。
Rotavapor R-124型旋转蒸发仪 瑞士步琪有限公司;Waters 2690-996(PAD)色谱系统;Agilent 1100液相/Bruker esquire 3000plus 离子阱ESI质谱仪;1H-NMR分析仪(Bruker AM 300 MHz);13C-NMR分析仪(Bruker AM 100MHz)。
1.2 分析方法
1.2.1 HPLC参数条件
Varian Prostar 1.0高效液相色谱仪;流动相:A为H2O、B为CH3CN;制备柱:Merck C18(25mm×250mm,10μm);制备时间:180min;组分收集:15mL/管;0~15min,流动相A保持92%,流动相B保持8%;在15~180min,梯度洗脱,流动相A由92%降低至62%,流动相B由8%增加至38%。
1.2.2 HPLC-MS分析条件
分析操作系统:Agilent Chem-workstation/Bruker Daltonic data analysis V3.1;流动相:A 为H2O, B为99.9% CH3CN 和0.1% HCOOH;分析柱:Merck C18(2.0mm×50mm,3μm);分析时间:15min;流速:0.5mL/min;检测波长:210nm;柱温:25℃;在0~9min梯度洗脱,流动相A由100%降低至0,流动相B由0增加至100%;之后等梯度保持至第12min;在12.1min,流动相A为100%,流动相B为0;之后等梯度保持至第15min。
1.2.3 NMR测试系统
1H-NMR测试仪:Bruker AM 300MHz;13C-NMR测试仪:Bruker AM 100MHz;溶剂:氘代试剂。
1.3 方法
本实验设计了两个反应体系。按化学反应方程式计算,每8mol的碘甲烷可与1mol的EGCG完全反应,为研究EGCG的8个羟基是否都能被甲基化,反应体系I采用了过量的碘甲烷(10倍)与EGCG进行甲基化反应;为研究EGCG的8个羟基中哪些羟基最易甲基化,反应体系II采用了EGCG与碘甲烷物质的量比为1:1的反应体系。具体如下:
反应体系I:取EGCG 2.3g加入100mL丙酮中,加入2.5g K2CO3做催化剂,在60℃磁力搅拌回流,在回流过程中滴加25mL(EGCG与碘甲烷的物质的量比为1:80)的碘甲烷,反应4h,在60℃旋转蒸发除掉丙酮,得到淡黄色晶体(TRI-1)2.7g。
反应体系II:取EGCG 4.584g加入100mL丙酮中,加入2.5g K2CO3作催化剂,在60℃磁力搅拌回流,在回流过程中滴加碘甲烷0.623mL(EGCG与碘甲烷的物质的量比为1:1),反应4h,在60℃旋转蒸发除掉丙酮,得到淡红棕色晶体(TRI-2)4.8g。
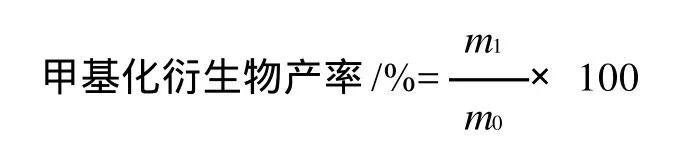
式中:m1为甲基化EGCG单体质量/g;m0为EGCG质量/g。
2 结果与分析
2.1 TRI-1和TRI-2的化学成分
采用制备HPLC,从反应体系I的产物TRI-1分离纯化得到3个化合物;采用HPLC-MS和NMR进行结构分析,分别为TRI-1-1(5,3′,4′,5′,3″,4″,5″-hepta-Me-EGCG)、TRI-1-2(5,7,3′,4′,3″,4″,5″-hepta-Me-EGCG)和TRI-1-3(5,7,3′,4′,5′,3″,4″,5″-octa- Me-EGCG);从反应体系II的产物TRI-2分离鉴定出两个化合物,分别为TRI-2-1(4″-Me-EGCG)和TRI-2-2(4′,4″-di-Me-EGCG)。可见,在反应体系产物中,有单甲基化、双甲基化、七甲基化以及八甲基化的EGCG衍生物存在;此外,通过分析产物的化学结构发现,EGCG的4″位易被甲基化。EGCG经甲基化分子修饰后得到的5个化合物的化学结构如图1所示。
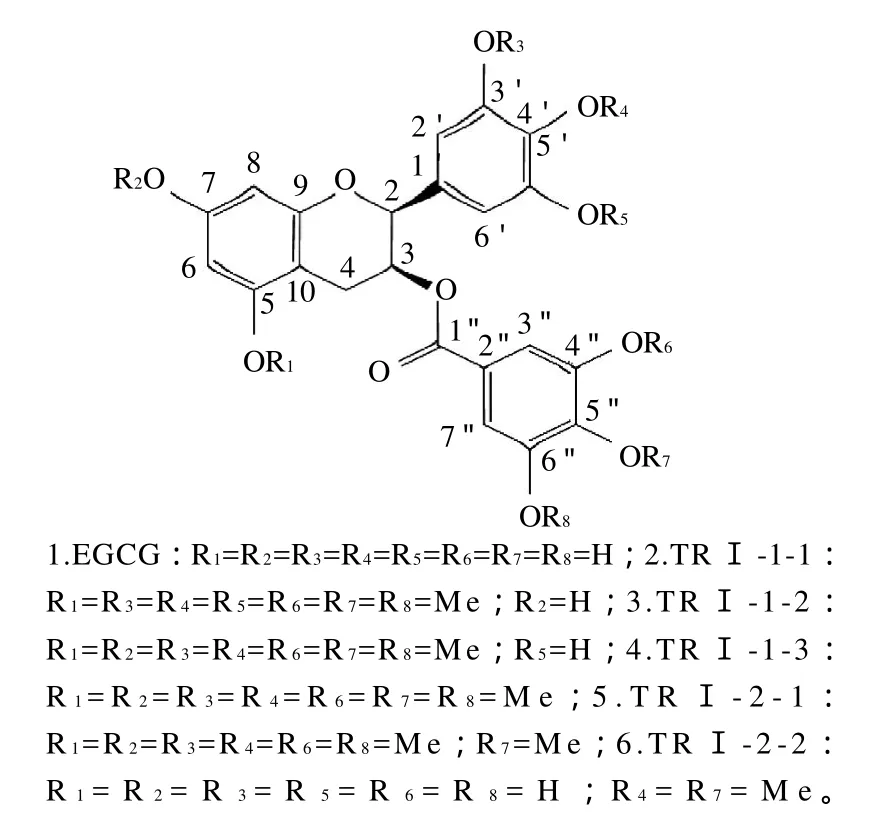
图1 EGCG及其甲基化产物化学结构式Fig.1 Chemical structures of EGCG derivatives
2.2 TRI-1和TRI-2化学成分的HPLC分析及单体制备
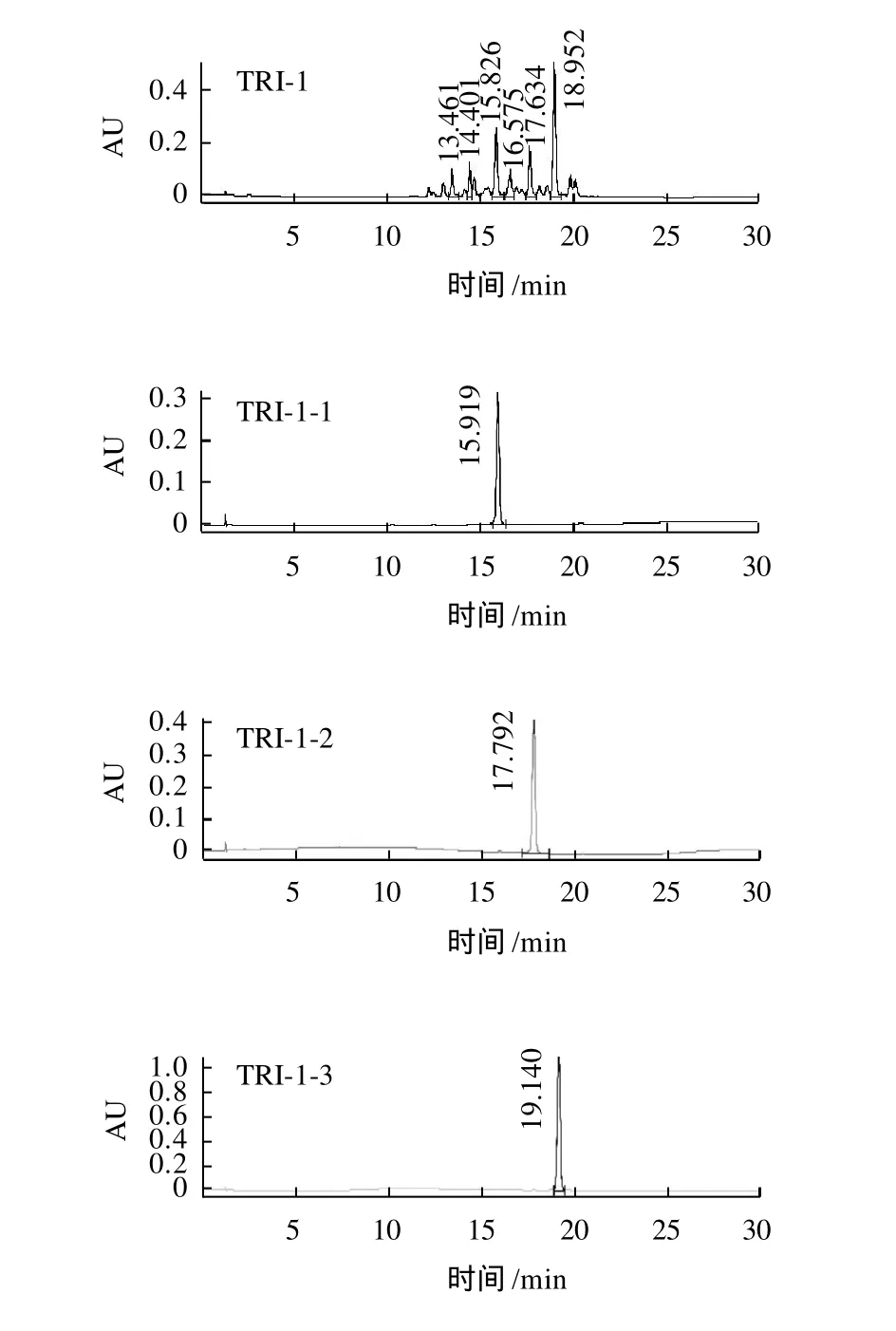
图2 样品TRI-1及其甲基化衍生物HPLC图谱Fig.2 HPLC chromatograms of reaction product TRI-1 (from reaction system No.1 in which the molar ratio between EGCG and methyl iodide was 1:80) and 3 constituents in it

图3 TRI-2及其甲基化衍生物HPLC图谱Fig.3 HPLC chromatograms of reaction product TRI-2 (from reaction system No.2 in which the molar ratio between EGCG and methyl iodide was 1:80) and 2 constituents in it
由图2、3可见,在该实验的分析条件下,化合物能得到有效的分离和制备。经分析计算,TRI-1-1、TRI-1-2、TRI-1-3、TRI-2-1和TRI-2-2的产率分别为0.36%、0.27%、0.49%、0.76%和0.42%。
2.3 结构鉴定

表1 EGCG及其甲基化衍生物碳谱信号归属Table 1 Assignment of13C NMR spectral signals of EGCG, 3 constituents in reaction product TRI-1 and 2 constituents in reaction product TRI-2
化合物 TRI-1-1,ESI-MS m/z:557.1[M+H]+、1111.7[2M-H]-;化合物TRI-1-2,ESI-MS m/z:557.2[M+H]+、1135.4[2M+Na]+、555.5[M-H]-;化合物TRI-1-3,ESIMS m/z:571.1[M+H]+、1162.8[2M+Na]+;化合物TRI-2-1,ESI-MS m/z:473.0[M+H]+、967.2[2M+Na]+、943.4[2M-H]-;化合物TRI-2-2,ESI-MS m/z:487.0[M+H]+、995.1[2M+Na]+、971.2[2M -H]-;13CNMR数据见表1,1H NMR数据见表2。
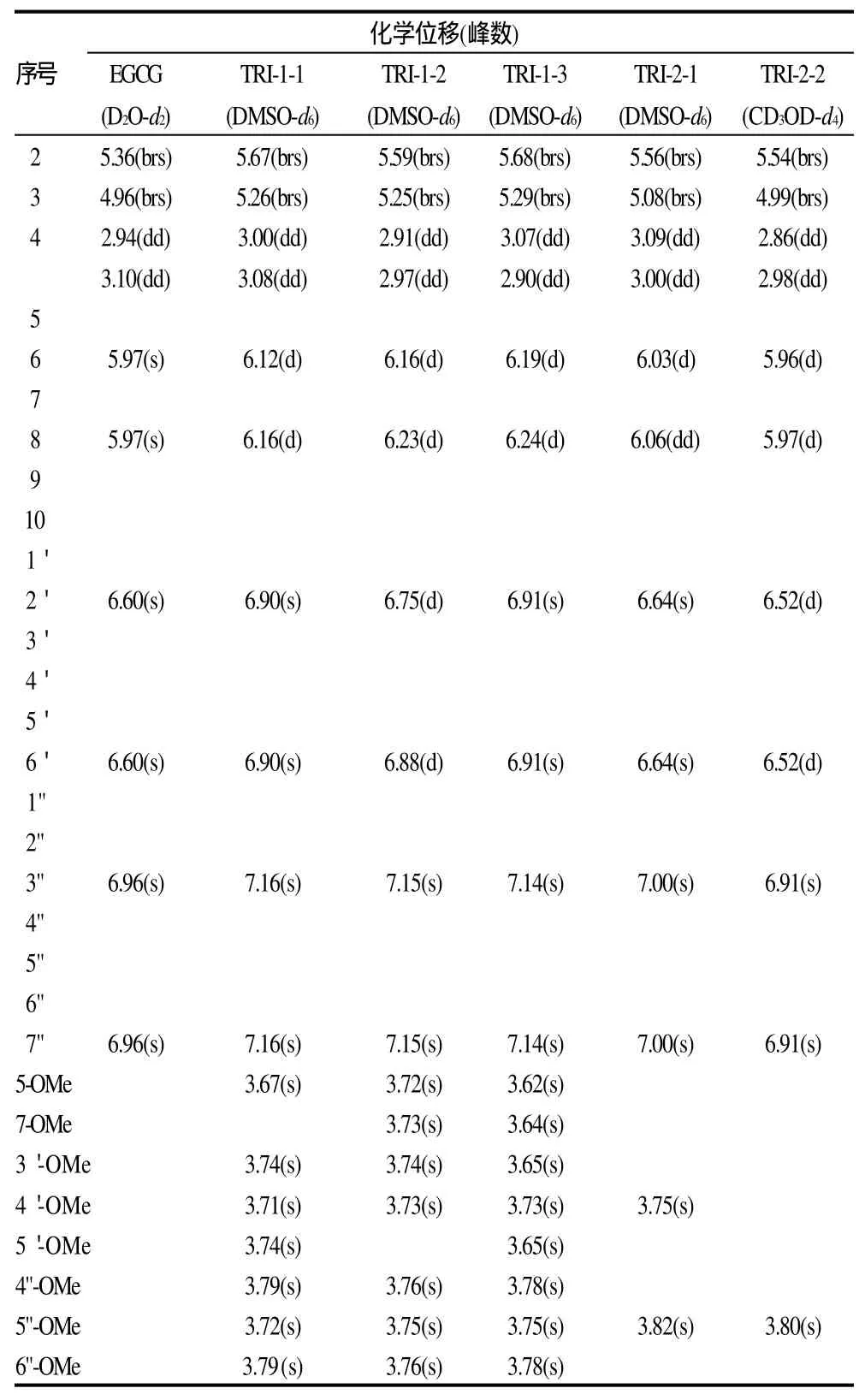
表2 EGCG及其甲基化衍生物氢谱的信号归属Table 2 Assignment of1H NMR spectral signals of EGCG, 3 constituents in reaction product TRI-1 and 2 constituents in reaction product TRI-2
3 讨 论
本实验建立了两个化学反应体系,采用化学合成的方法,进行了EGCG甲基化分子修饰的研究。结果表明,这两个体系都能有效完成EGCG的甲基化分子修饰;并采用现代色谱纯化技术,从反应产物中分离纯化出5个EGCG甲基化衍生物,进一步查明了其化学结构。本实验所设计的七甲基化和八甲基化EGCG化学合成方法目前尚未见报道,且发现了EGCG的4″位易被甲基化,这将十分有助于甲基化儿茶素的进一步开发利用。但该方法采用剧毒的碘甲烷为甲基化试剂,对后续的甲基儿茶素的纯化以及药理方面的利用提出了很高的要求。因此,绿色、高效的甲基化儿茶素的合成途径以及甲基化儿茶素的生物活性分析等将有待深入研究。
此外,本研究在化学反应体系的构建方面,也进行了初步的优化分析探索:1)在反应介质条件的选择方面,由于EGCG分子中具有大量的酚羟基,可游离出H+,故显酸性,若进行酚羟基上氢离子的甲基反应需在碱性条件下形成大量的酚氧负离子,但如果碱性太强(如NaOH)则反应过于剧烈,容易引起副反应,导致产率下降,故本实验选用碳酸钾做催化剂,在丙酮溶液中形成弱碱性条件进行反应;2)在反应温度的选择方面,实验发现甲基化反应的温度控制在60℃较合适,若温度较低,反应在弱碱性条件下氧化速率大大增加,生成大量的酚氧负离子,酚氧负离子容易进一步失去电子,生成邻醌,邻醌则可发生聚合生成红棕色的聚合物,使EGCG上的羟基无法进行甲基取代;3)在反应时间的选择方面,实验发现,在弱碱性条件下,酚羟基甲基化反应在4h左右即可完成,故从成本方面考虑反应时间控制在4h左右。
[1] SANO M, SUZUKI M, MIYASE T, et al. Novel anti-allergic catechin derivatives isolated from oolong tea[J]. J Agric Food Chem, 1999, 47(5): 1906-1910.
[2] LANDIS-PIWOWAR K R, HUO Congde, CHEN Di, et al. A novel prodrug of the green tea polyphenol (-)-Epigallocatechin-3-Gallate as a potential anticancer agent[J]. Cancer Research, 2007, 67(9): 4303-4310.
[3] MOON Y H, LEE J H, AHN J S, et al. Synthesis, structure analyses, and characterization of novel epigallocatechin gallate (EGCG) glycosides using the glucansucrase from Leuconostoc mesenteroides B-1299CB[J].J Agric Food Chem, 2006, 54(4): 1230-1237.
[4] 陈平, 孙东, 郑小明. EGCG棕榈酸酯的制备、结构及其抗氧化活性[J]. 浙江大学学报: 理学版, 2003, 30(4): 422-425.
[5] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中EGCG3"Me的研究与开发[J]. 食品工业科技, 2008, 29(12): 275-277.
[6] 孙业良, 吕海鹏, 林智, 等. 茶叶中EGCG3″Me的分析方法研究[J].茶叶科学, 2009, 29(5): 379-384.
[7] 周蓓, 王琳, 李伟, 等. 茶叶中甲基化儿茶素的分离、纯化和高效液相色谱法分析[J]. 分析化学, 2008, 36(4): 494-498.
[8] 吕海鹏, 谭俊峰, 林智. 茶树种质资源EGCG3"Me含量及其变化规律研究[J]. 茶叶科学, 2006, 26(4): 310-314.
[9] 罗正飞, 龚正礼, 汪毅, 等. 茶叶中甲基化EGCG的研究[J]. 西南大学学报: 自然科学版, 2008, 30(3): 56-59.
[10] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中的EGCG3″Me研究[J]. 食品与发酵工业, 2008, 34(10): 22-25.
[11] WANG Dongmei, LU Jiali, MIAO Aiqing, et al. HPLC-DAD-ESI-MS/MS analysis of polyphenols and purine alkaloids in leaves of 22 tea cultivars in China[J]. J Food Compos Anal, 2008, 21: 361-369.
[12] MENG Xiaofeng, SANG Shengmin, ZHU Nanqun, et al. Identification and characterization of methylated and ring-fission metabolites of tea catechins formed in humans, mice, and rats[J]. Chem Res Toxicol,2002, 15(8): 1042-1050.
[13] AIHARA Y, YOSHIDA A, FURUTA T, et al. Regioselective synthesis of methylated epigallocatechin gallate via nitrobenzenesulfonyl(Ns) protecting group[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(15): 4171-4174.
Methylation of (-)-Epigallocatechin-3-gallate (EGCG)
TS272
A
1002-6630(2010)15-0139-04
2010-03-26
浙江省自然科学基金项目(Y307498);现代农业产业技术体系建设专项(nycytx-26);
国家自然科学基金项目(30972404)
吕海鹏(1980—),男,助理研究员,硕士,主要从事茶叶化学和茶叶加工研究。E-mail:hplv@163.com
*通信作者:林智(1965—),男,研究员,博士,主要从事茶叶加工和新产品的开发。E-mail:linz@mail.tricaas.com
