玉竹中性多糖的分离纯化及单糖组成分析
2010-09-13李盛钰刘春明
王 强,李盛钰,杨 帆,刘春明,*
(1.长春师范学院中心实验室,吉林 长春 130032;2.吉林省农业科学院农产品加工研究中心,吉林 长春 130033)
玉竹中性多糖的分离纯化及单糖组成分析
王 强1,李盛钰2,杨 帆1,刘春明1,*
(1.长春师范学院中心实验室,吉林 长春 130032;2.吉林省农业科学院农产品加工研究中心,吉林 长春 130033)
采用水提醇沉方法提取玉竹(Polygonatum odoratum (Mill) Druce)粗多糖,通过DEAE-纤维素离子交换层析和Sepharose CL-6B分子筛层析分离纯化得到玉竹中性多糖。应用紫外光谱分析中性多糖的纯度,凝胶过滤法测定其分子质量,红外光谱和高效液相色谱对其结构和单糖组成进行初步分析。结果表明:玉竹多糖主要为中性多糖,同时含有少量酸性多糖;玉竹中性多糖平均分子质量为1.21×106D,主要由甘露糖和葡萄糖组成,其物质的量比为5:1,同时含有少量半乳糖。
玉竹;多糖;纯化;单糖组成
Abstract :Crude polysaccharides were obtained from Polygonatum odoratum (Mill) Druce by water extraction and ethanol precipitation, and were sequentially purified by ion exchange chromatography on DEAE-cellulose column and gel permeation chromatography on Sepharose CL-6B column and a neutral polysaccharide fraction was obtained. Its structure was determined using HPLC, FTIR and UV spectroscopy. The results showed that the polysaccharide fraction was mainly composed of mannose and glucose at a molar ratio of 5:1 and also contained a small amount of galactose and that its molecular weight was approximately 1.21 × 106D.
Key words:Polygonatum odoratum (Mill) Druce;polysaccharide;purification;monosaccharide composition
玉竹为百合科(Liliaceae)植物玉竹(Polygonatum odoratum (Mill) Druce)的干燥根茎,是药食两用中药之一,具有养阴润燥,生津止渴的功效[1]。从玉竹中已经分离鉴定了甾体皂苷、黄酮、生物碱、多糖、甾醇、鞣质、黏液质和强心苷等多类成分[2],其中多糖是玉竹中主要有效成分,现代药理实验研究证明其具有增强耐缺氧[3]、抗衰老[4-5]、抗氧化[6]、降血糖[7]、抗肿瘤和提高免疫力[8]等作用,因此,开发玉竹多糖具有重要意义。对玉竹多糖的提取工艺已有研究[9],但对玉竹多糖的分离纯化及单糖组成方面的研究尚未有报道。本实验从玉竹中分离纯化了一种中性多糖,并利用红外光谱、紫外光谱、液相色谱和凝胶过滤色谱等方法,对其理化性质及单糖组成进行分析。
1 材料与方法
1.1 材料与试剂
玉竹采于吉林省集安市,经鉴定为百合科(Liliaceae)黄精属(Polygonatum)植物玉竹(Polygonatum odoratum (Mill)Druce)的干燥根茎。
DEAE-纤维素 上海恒信公司;Sepharose CL-4B填料 瑞典Phamacia公司 ;标准单糖 加拿大Bio Basic公司;Dextran标准葡聚糖 美国Fluka公司;6000~8000D透析袋 上海绿谷有限公司;乙腈、甲醇(色谱纯) 美国Fisher公司;其余试剂均为国产分析纯。
1.2 仪器与设备
Agilent1100高效液相色谱仪 美国Agilent公司;NICOLET380红外分光光度计 美国Thermo公司;DU800紫外可见分光光度计 美国Beckman Coulter公司;ALPHA2-4 LSC真空冷冻干燥机 德国Christ公司;3K30台式冷冻离心机 德国Sigma公司。
1.3 玉竹粗多糖的提取
称取过20目筛的玉竹粗粉100g,加入600mL水,置于80℃水浴中提取3次,每次1h,过滤,合并滤液,减压浓缩,加入乙醇至含醇量达到80%,4℃放置过夜,4℃、8000r/min离心15min,沉淀加蒸馏水50mL溶解,4℃、8000r/min离心15min,上清液冻干。
1.4 玉竹中性多糖的分离纯化
称取玉竹粗多糖样品0.1g,加入10mL水使其溶解,上样到平衡后的DEAE-纤维素柱上。依次用蒸馏水、0.2mol/L NaCl和0.5mol/L NaCl溶液洗脱样品。流速1mL/min,部分收集器收集洗脱液,每管5mL,苯酚-硫酸法检测多糖含量,按照吸收峰收集各样品,去离子水透析,冻干。取水洗脱部分经Sepharose CL-6B凝胶柱进一步纯化。以0.9g/100mL NaCl溶液洗脱,流速为0.4mL/min,部分收集器收集洗脱液,每20min收集一管,苯酚-硫酸法检测多糖含量,按照吸收峰收集样品,去离子水透析,冻干,即得玉竹中性多糖。
1.5 玉竹中性多糖组成分析[10]
玉竹中性多糖的水解:称取玉竹中性多糖1mg,加入2mol/L的三氟乙酸溶液1mL,密封,于110℃水解4h,水解后样品冻干。
单糖衍生物制备:称取各标准单糖1mg与玉竹中性多糖水解后样品分别加入0.3mol/L的NaOH溶液1mL,配成1 mg/mL的NaOH溶液。分别量取100μL加入1.5mL离心管中,加入0.5mol/L的1-苯基-3-甲基-5-吡唑啉酮(PMP)甲醇溶液100μL,密闭。于70℃水浴30min,取出,冷却10min,加入0.3mol/L的HCl溶液100μL,混匀,再加入1mL氯仿,混匀,10000r/min离心5min,吸去氯仿层(下层),上层(水层)经过0.45μm滤膜过滤,加超纯水至1mL,供HPLC分析用。
HPLC分析条件:Agilent 1100系统。DAD检测器,检测波长:250nm,柱温:35℃,流速:1.0mL/min,Ecilipse XDB-C18色谱柱(4.6mm×150mm,5μm),流动相:82.2% PBS缓冲液(0.1mol/L,pH7.0)和17.8%乙腈(V/V)。进样量10μL。将各单糖衍生物混合样品注入HPLC中,进行分析。
1.6 玉竹中性多糖分子质量测定
采用Sepharose CL-4B凝胶柱(1.0cm×100cm)过滤层析,0.9g/100mLNaCl洗脱,流速0.1mL/min。部分收集器收集洗脱液,每管2mL,采用苯酚-硫酸法检测多糖含量。以不同Dextran标准葡聚糖(MW2000、750、500、70、40kD和25kD)最大吸光度时的洗脱体积为横坐标,各Dextran标准葡聚糖分子质量的对数值为纵坐标绘制标准曲线。玉竹中性多糖样品以同样条件上柱,根据标准曲线计算分子质量。
1.7 玉竹中性多糖紫外光谱和红外光谱测定
紫外光谱分析以1mg/mL的玉竹中性多糖溶液在200~800nm范围内扫描。红外光谱测定取2mg的中性多糖样品,以KBr压片,在4000~400cm-1区间扫描红外吸收。
2 结果与分析
2.1 玉竹中性多糖的分离纯化
玉竹经水提醇沉得到粗多糖为白色纤维状固体,不易溶于冷水,在热水中具有较好的溶解性,不溶于丙酮,乙醇等有机溶剂,粗多糖经DEAE-纤维素离子交换柱色谱,依次以蒸馏水、0.2mol/LNaCl和0.5mol/L NaCl洗脱,分离得到3个组分,其中蒸馏水洗脱部分的量最多,约占上样粗多糖量的80%(图 1)。说明玉竹多糖主要为中性多糖,同时含有少量酸性多糖。DEAE-纤维素(二乙氨乙基纤维素,Dicthylaminoethyl)在纤维素上结合了DEAE,带正电荷的阳离子纤维素-O-C6H14N+H,可与带负电荷的阴离子进行交换,在离子交换色谱中,交换剂对多糖和无机阴离子都具有交换吸附的能力,两者同时存在于一个色谱过程中,一般采用两种方法达到分离多糖的目的。一种是增加洗脱液的离子强度,一种是改变洗脱液的pH值。实验采用不同离子强度NaCl进行洗脱,分离效果好。取中性多糖部分经Sepharose CL-6B凝胶过滤层析纯化,得到玉竹中性多糖。由图2洗脱曲线可知,洗脱峰为单一对称峰,表明其组分为单一组分。
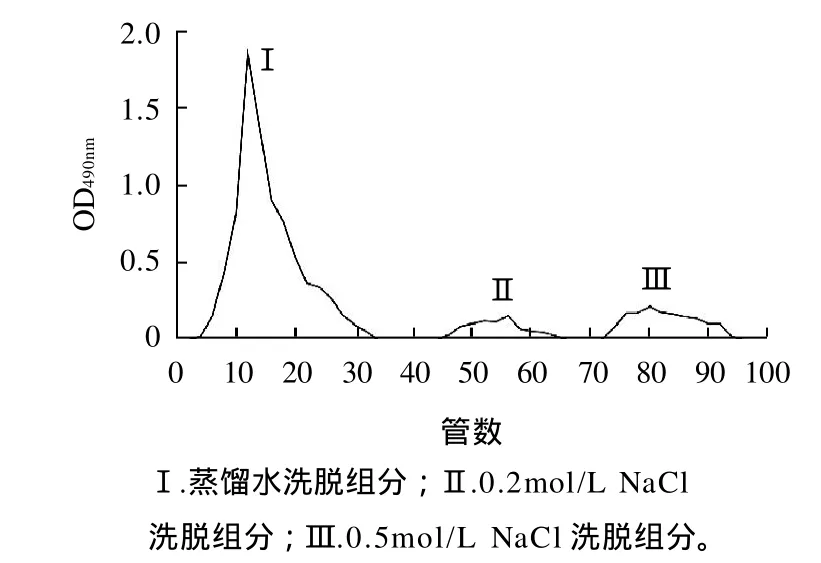
图1 玉竹粗多糖DEAE-纤维素离子交换柱层析Fig.1 DEAE-cellulose column chromatogram of crude polysaccharides from Polygonatum odoratum (Mill) Druce
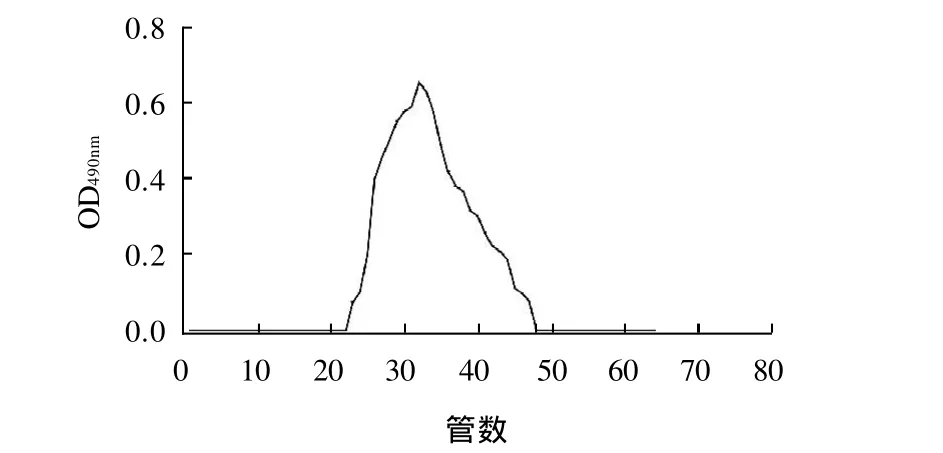
图2 玉竹中性多糖Sepharose CL-6B分子筛层析Fig.2 Sepharose CL-6B column chromatogram of the neutral fraction of crude polysaccharides from Polygonatum odoratum (Mill) Druce
2.2 玉竹中性多糖分子质量测定
标准分子质量葡聚糖凝胶过滤法绘制标准曲线为:y =-22.594x+209.1(R2=0.9966)。玉竹中性多糖根据洗脱体积,与标准曲线(图3)比较,求得其分子质量为1.21×106D。
2.3 玉竹中性多糖组成分析
玉竹中性多糖组成分析是多糖结构分析的一项重要内容。近年来发展迅速的柱前衍生化方法是使糖类物质带上紫外或荧光基团,用HPLC进行分离,在紫外或荧光下检测,这种方法具有分离效率高、分析时间短、进样量少、检测限低及多模式等特点。本实验先将玉竹中性多糖经三氟乙酸水解、PMP衍生化后通过高效液相测定其单糖组成。

图3 标准葡聚糖标准曲线图Fig.3 Standard curve of dextran
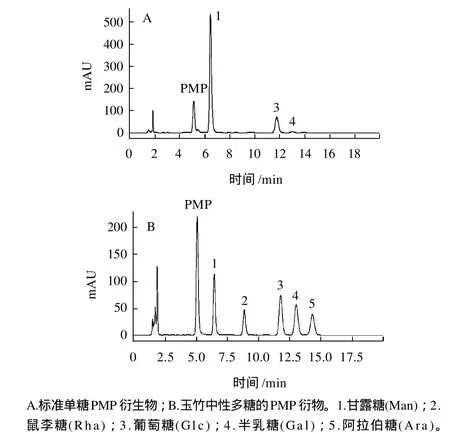
图4 标准单糖与玉竹中性多糖的PMP衍生物高效液相色谱图Fig.4 HPLC analysis of PMP derivatized standard monosaccharides and the purified neutral polysaccharide fraction from Polygonatum odoratum (Mill) Druce
由图4可知,玉竹中性多糖PMP衍生物存在3个色谱峰,由标准单糖对照(图4B)可知样品中主要含有甘露糖(Man)和葡萄糖(Glc),物质的量比为5:1,同时含有少量半乳糖(Gal)。
2.4 玉竹中性多糖紫外和红外光谱分析
图5玉竹中性多糖紫外光谱图中,在波长260nm和280nm处无蛋白、核酸吸收峰,表明多糖中无蛋白、多肽及核酸的存在。图6是玉竹中性多糖的红外光谱图,显示了明显的多糖特征吸收峰。在3441.50、2924.37、1633.86、1383.80、1250.16cm-1和1030.55cm-1等处均有多糖的特征吸收,3441.50cm-1处强且宽的吸收峰,主要由O—H伸缩振动引起的;2924.37cm-1是—CH2的C—H键的伸缩振动引起的,1633.86cm-1是C==O的伸缩振动引起的,1383.80cm-1是C—O伸缩振动引起的;1250.16、1030.55cm-1是吡喃糖环的特征吸收引起的,是其C—O—C的非对称振动峰。
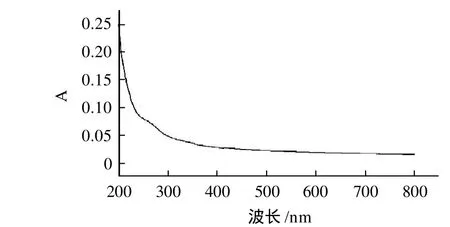
图5 玉竹中性多糖紫外光谱图Fig.5 UV absorption spectrum of the purified neutral polysaccharide fraction from Polygonatum odoratum (Mill) Druce

图6 玉竹中性多糖红外光谱图Fig.6 IR spectrum of the purified neutral polysaccharide fraction from Polygonatum odoratum (Mill) Druce
3 结 论
本研究采用水提醇沉法从玉竹中提取总多糖,通过DEAE-纤维素离子交换层析和Sepharose CL-6B分子筛层析分离纯化得到一种中性多糖,应用UV光谱分析了中性多糖的纯度,凝胶过滤法测定了其分子质量,IR光谱和HPLC色谱对其结构和单糖组成进行初步分析,表明其平均分子质量为1.21×106D,主要由甘露糖和葡萄糖组成,其物质的量比为5:1,同时含有少量半乳糖。
[1] 国家药典委员会. 中国药典(一部)[S]. 北京: 化学工业出版社, 2005: 57-58.
[2] 林厚文, 韩公羽, 廖时萱. 玉竹有效成分的研究[J]. 药学学报, 1994,29(3): 215-222.
[3] 孙立彦, 刘振亮, 孙金霞, 等. 玉竹多糖对小鼠常压耐缺氧作用的影响[J]. 山东农业大学学报: 自然科学版, 2008, 39(3): 335-338.
[4] 单颖, 姜东, 潘兴瑜, 等. 玉竹多糖对衰老模型鼠免疫功能的影响[J].中国老年学杂志, 2007, 27(1): 20-22.
[5] 单颖, 潘兴瑜, 姜东, 等. 玉竹多糖抗衰老的实验观察[J]. 中国临床康复, 2006, 10(3): 79-81.
[6] 徐大量, 林辉, 李盛青, 等. 玉竹水提液体内外抗氧化的实验研究[J].中药材, 2008, 31(5): 729-731.
[7] 季峰, 魏贤勇, 刘广龙, 等. 玉竹多糖降血糖作用的实验研究[J]. 江苏中医药, 2006, 27(9): 70-71.
[8] 许金波, 陈正玉. 玉竹多糖抗肿瘤作用及其对免疫功能影响的实验研究[J]. 深圳中西医结合杂志, 1996, 6(1): 13-15.
[9] 黄艳萍, 张玉祥, 刘浩, 等. 玉竹中多糖的超声提取工艺研究[J]. 中医药导报, 2006, 12(12): 70-71.
[10] YANG Xingbin, ZHAO Yan, WANG Qingwei , et al. Analysis of the monosaccharide componets in angelica polysaccharides by high performance liquid chromatography[J]. Analytical Sciences, 2005, 21(10):1177-1180.
Isolation, Purification and Monosaccharide Analysis of a Neutral Polysaccharide from Polygonatum odoratum (Mill) Druce
WANG Qiang1, LI Sheng-yu2,YANG Fan1,LIU Chun-ming1,*
(1. Central Laboratory of Changchun Normal University, Changchun 130032, China;2. Center of Agro-food Technology, Jilin Academy of Agricultural Sciences, Changchun 130033, China)
R284.2
A
1002-6630(2010)15-0100-03
2009-12-10
王强(1976-),男,讲师,硕士,主要从事天然产物研究与开发。E-mail:cczywq@163.com
*通信作者:刘春明(1964-),女,教授,博士,主要从事天然产物分析。E-mail:chunmingliu2000@yahoo.com.cn
