方波脉冲电穿孔法提高酵母菌细胞通透性的条件优化
2010-09-13冀照君迟玉杰
冀照君,孙 波*,迟玉杰,徐 宁
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
方波脉冲电穿孔法提高酵母菌细胞通透性的条件优化
冀照君,孙 波*,迟玉杰,徐 宁
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
为了采用电穿孔法提高酵母菌细胞的通透性,将通过离心得到的酵母菌制成1×108CFU/mL的菌悬液,采用不同的方波电脉冲条件对其进行处理。结果表明:在0.6mol/L的蔗糖等渗电脉冲介质中,当酵母菌细胞的处理条件为电场强度7kV/cm,脉冲宽度50μs,脉冲数14,间隔时间2s时,细胞的存活率平均为81.16%,电穿孔率平均为65.14%。这表明电穿孔法可以有效增强酵母菌细胞的通透性。
方波脉冲;电穿孔法;酵母菌;通透性
Abstract :Yeast (Saccharomyces cerevisiae CICC 1012) cells were statically cultured in YEPD medium at 30 ℃ for 24 h and then separated by centrifugation at 3000 r/min after the end of culture and suspended in an electric pulse medium (containing sucrose, Tris-HCl and MgCl2, at pH 7.5) at a cell concentration of 1×108CFU/mL before square-wave electric pulse treatment under different operating conditions. Electric field strength of 7 kV/cm, pulse duration of 50μs, pulse number of 14, time interval of 2 s, and sucrose concentration of 0.6 mol/L were found optimum. The percentage survival of yeast cells was 81.16% and the percentage of electroporated yeast cells was 65.14% under these optimum conditions. This study suggests that the permeability of yeast cells can be increased by square-wave electroporation.
Key words:square-wave electric pulse;electroporation;yeast;permeability
电穿孔是一种利用电脉冲克服细胞膜屏障的过程[1]。即在电场作用下,细胞壁组成和结构发生一定的变化,细胞膜脂双层上形成瞬时孔洞[2],细胞膜的通透性和膜电导瞬时增大,使正常情况下不能通过细胞膜的分子(如亲水分子、病毒颗粒、DNA、蛋白质以及染料颗粒等)得以进出细胞的一个生物物理过程[3-4]。电场造成细胞的电穿孔有两种形式:可逆电穿孔和不可逆电穿孔[5-6]。如果脉冲条件不超过某一临界限度,这种通透性是可逆的,否则细胞可以遭到不可逆的损伤或死亡[7-8]。由于该技术简单、快速、高效[9],目前己广泛应用于生物技术、基因工程、临床医学等许多领域[10]。
目前,关于电穿孔在细胞转化、增加细胞通透性等方面的应用研究越来越多。研究者们利用适当的电穿孔条件可以达到提高转化效率或者细胞通透特性等目的。Suga等[5]的研究结果表明,裂殖酵母的最佳转化电场强度为7.5~12.5kV/cm。Shirakashi等[11]采用流式细胞仪直接定量测定了细胞对大分子的富集量。肖华娟等[4]采用肝癌细胞HePG2作为靶细胞,发现随着电场强度或脉冲宽度的增加,细胞膜穿孔率相应增强;同时发现细胞膜电穿孔具有累积效应。汪和睦等[12]确定了椭圆酿酒酵母AS2-607(南阳6号“K”)质膜的电穿孔条件为RC脉冲电场,幅度5~10kV/cm,脉冲的时间常数小于30μm。但关于用方波脉冲对酵母菌细胞进行电穿孔以增加其通透特性的研究尚未见报道。
本实验拟采用不同的电脉冲条件对酵母菌进行处理,在保证酵母菌细胞存活率较高的情况下,尽量增加细胞的通透特性,以确定最适的电穿孔条件。以为进行更深入的研究(将药物成分渗透到细胞内[6],激活细胞膜的传输因子,提高酶的活性来加快酵母菌细胞的代谢速率等)提供技术支持。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae CICC 1012)由中国工业微生物菌种保藏管理中心提供。
蔗糖 北京金汇太亚化学试剂有限公司;Tris 上海化学试剂公司;MgCl2北京康普汇维科技有限公司;电脉冲介质[13](270mmol/L蔗糖、10mmol/L Tris-HCl、1mmol/L MgCl2,pH7.5)。
YEPD(yeast extract peptone dextrose)液体扩培培养基:酵母膏10g、蛋白胨20g、葡萄糖20g,水1000mL,pH值自然。
1.2 仪器与设备
ECM830型方波电穿孔仪、0.2cm样品杯 美国BTX公司;AA-650型原子吸收分光光度计 日本岛津公司;TDZ4台式自动平衡离心机 长沙平凡仪器仪表有限公司。
1.3 方法
1.3.1 菌体的收集
从斜面上挑取两环酵母菌接入100mL 4°Bix麦芽汁中,30℃静止培养24h,然后按照体积分数1%的接种量接入YEPD液体扩培培养基中,30℃静止培养24h。3000r/min离心10min,收集菌体[14]。菌体用生理盐水洗涤3次,然后用电脉冲介质洗涤2次。
1.3.2 酵母菌悬浮液的准备
将离心得到的菌体悬浮于电脉冲介质中,使得酵母菌浓度为1×108CFU/mL[6],置于冰浴中5min[15]。
1.3.3 酵母菌电脉冲处理
取0.4mL悬浮液于0.2cm的样品杯中[15],然后将样品杯放于样品池,调节电场强度、脉冲宽度、脉冲数和间隔时间,对酵母菌进行电脉冲处理。
1.3.4 酵母菌细胞的扫描电镜观察
将电穿孔前后的酵母菌细胞进行戊二醛固定,然后用不同体积分数的梯度乙醇(30%、50%、70%、90%)各处理15min进行脱水,最后用无水乙醇进行脱水两次,于二氧化碳临界点下冷冻干燥,镀金,扫描电子显微镜下进行观察。
1.3.5 酵母菌存活率的测定
迅速取电脉冲处理后的菌悬液0.1mL于0.9mL生理盐水中,冰浴5~10min,然后将其置于10~11℃保持40min[8],进行稀释,涂布计数。分别计算电脉冲处理前后酵母菌的总数。

1.3.6 菌悬液钾离子含量测定及酵母菌电穿孔率计算
电脉冲处理后,细胞立即移入冷冻的安剖管中,冰浴5~10min,然后将其置于10~11℃保持40min,使得细胞内和细胞外的离子浓度平衡。菌悬液的钾离子浓度采用原子吸收分光光度计进行测定,并作未进行电脉冲处理的空白实验。钾离子测定参数[16]见表1。

表1 钾离子测定参数Table 1 Atomic absorption spectrometric parameters for K+determination
电穿孔率由式(2)计算:
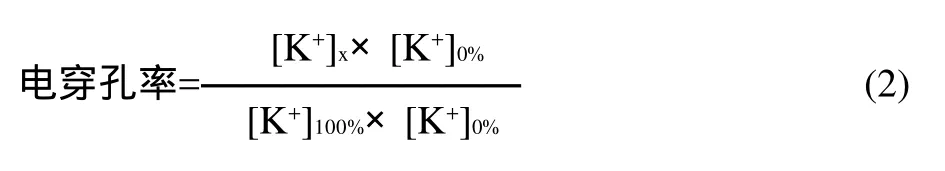
式中:[K+]x为电脉冲后菌悬液的钾离子含量;[K+]0%未进行电脉冲处理菌悬液的钾离子含量;[K+]100%细胞全部电穿孔后菌悬液的钾离子含量[8]。为了得到[K+]100%,将电脉冲处理后的菌悬液4000r/min离心15min,测定离心后的钾离子含量,当离心后的钾离子含量增加到最大并且不再变化时,所对应离心前的最小钾离子含量即为[K+]100%。
2 结果与分析
2.1 电脉冲介质中蔗糖浓度的确定
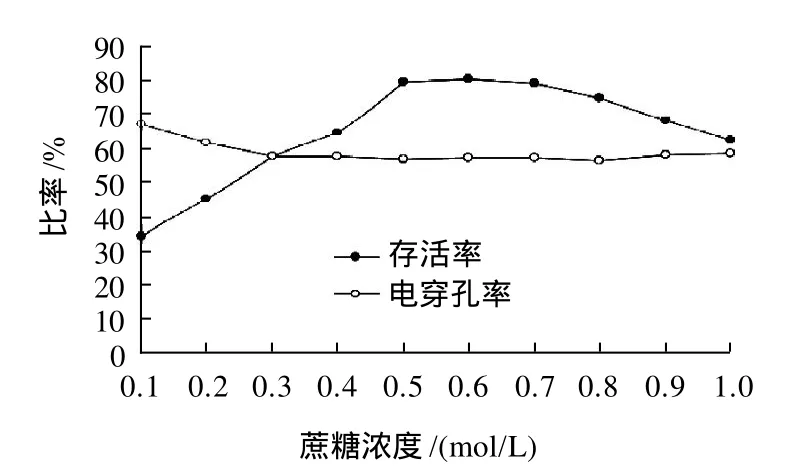
图1 电脉冲介质浓度对酵母菌细胞存活率和电穿孔率的影响Fig.1 Effects of sucrose concentration on the percentage survival of yeast cells and the percentage of electroporated yeast cells
在酵母菌细胞电脉冲过程中,电脉冲介质的渗透压是一个非常重要的因素[5]。因此,首先确定出电脉冲介质的渗透压。在实验过程中,选择电脉冲介质浓度为0.1~1.0mol/L,在电场强度为7kV/cm,脉冲宽度为50μs,脉冲数为12,间隔时间为2s的条件下,对酵母菌细胞进行电脉冲作用,分别测定细胞的存活率和电穿孔率,结果见图1。蔗糖浓度对电穿孔率影响较小,而对存活率的影响较大,当蔗糖浓度小于0.5mol/L时,存活率较低,这是因为低渗溶液中,细胞溶胀作用阻止了膜的正常恢复,引起膜不可逆的破坏。相反,高渗溶液(蔗糖浓度大于0.7mol/L以上)中细胞的存活率也下降,这是因为细胞内部水分的流动而导致细胞收缩,这样也增加了细胞膜的破坏。相比之下,等渗条件(蔗糖浓度为0.5~0.7mol/L)下,膜的恢复不会受到阻碍,细胞的存活率最高(79.4%~80.3%),这是因为细胞内外等渗平衡[5]。该浓度与张华山等[17]和赵悦茗等[18]研究酵母菌原生质体稳定剂的渗透压结果一致。因此,下面确定脉冲条件的实验中所配制电脉冲介质选择蔗糖浓度为0.6mol/L的等渗溶液((0.6±0.1)mol/L蔗糖、10mmol/L Tris-HCl、1mmol/L MgCl2、pH7.5,超纯水配制)。
2.2 电场强度和脉冲宽度对酵母菌细胞电穿孔通透性的影响
为了获得酵母菌电穿孔的最佳电场强度和脉冲宽度,分别将电场强度范围设定为1~12kV/cm,脉冲宽度分别为10、30、50、70、90μs,脉冲数为12,间隔时间为2s,对酵母菌进行电脉冲处理,测定电穿孔后酵母菌的存活率和电穿孔率,结果如图2、3所示。

图2 电场强度对酵母菌细胞电穿孔率的影响Fig.2 Effect of electric field strength on the percentage of electroporated yeast cells
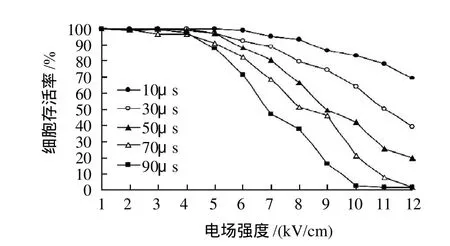
图3 电场强度对酵母菌细胞存活率的影响Fig.3 Effect of electric field strength on the percentage survival of yeast cells
由图2、3可知,总体趋势是随着电场强度的增加,酵母菌细胞的电穿孔率逐渐增大,存活率却逐渐下降。当电场强度小于4kV/cm时,即使增加脉冲宽度,酵母菌细胞的电穿孔率也仅仅达到13.9%,存活率始终接近于100%。当电场强度大于4kV/cm以后,电穿孔率开始迅速增加,存活率开始缓慢下降,这种变化规律与Weaver等[19]的研究结果一致。
由于采用的脉冲宽度不同,所以电穿孔率和存活率的变化速率不同。脉冲宽度为10μs时,虽然细胞的存活率较高,但电穿孔率较低,最大也只能达到50.3%(此时的存活率只有69.8%);相反,如果调节脉冲宽度为70μs或90μs时,细胞的电穿孔率上升较快,而存活率迅速下降。综合以上实验结果,在保证细胞存活率较高的同时,尽量增大电穿孔率,因此,选择电场强度为7kV/cm,脉冲宽度为50μs,此时,酵母菌细胞的存活率为80.43%,电穿孔率为57.49%。
2.3 脉冲数对酵母菌细胞电穿孔通透性的影响
在电场强度为7kV/cm,脉冲宽度为50μs的条件下,将脉冲数分别调节为2、4、6、8、10、12、14、16、18和20个,间隔时间为2s,对酵母菌进行电脉冲处理,分别测定酵母菌细胞的存活率和电穿孔率,结果如图4所示。
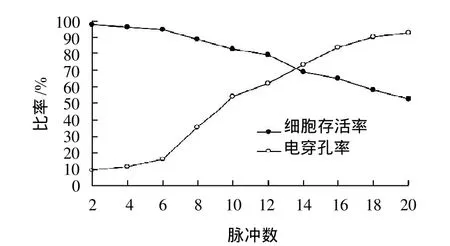
图4 脉冲数对酵母菌细胞存活率和电穿孔率的影响Fig.4 Effect of pulse number on the percentage survival of yeast cells and the percentage of electroporated yeast cells
由图4可以看出,脉冲数对酵母菌的存活率影响较小,但对酵母菌的电穿孔率影响显著。随着脉冲数的增加,酵母菌细胞的存活率从96.4%下降到47.3%,电穿孔率从10.1%增大到98.8%。因此,选择脉冲数为12~14时,酵母菌细胞的存活率较高。
2.4 正交试验
为了进一步研究电脉冲条件的各因素对酵母菌细胞通透性的影响,在以上单因素试验的基础上,以电场强度、脉冲宽度、脉冲数为因素,每个因素选取3个水平进行试验,分别测定酵母菌细胞的存活率和电穿孔率,结果如表2所示。各因素对细胞存活率和电穿孔率的影响顺序均为:即电场强度>脉冲宽度>脉冲数。细胞的存活率和电穿孔率呈负相关性,但由于试验目的是为了保证细胞存活率较高的同时,尽量增大其电穿孔率,因此,综合考虑正交试验结果,选择最适条件为:A2B2C3,即电场强度为7kV/cm,脉冲宽度为50μs,脉冲数为14。
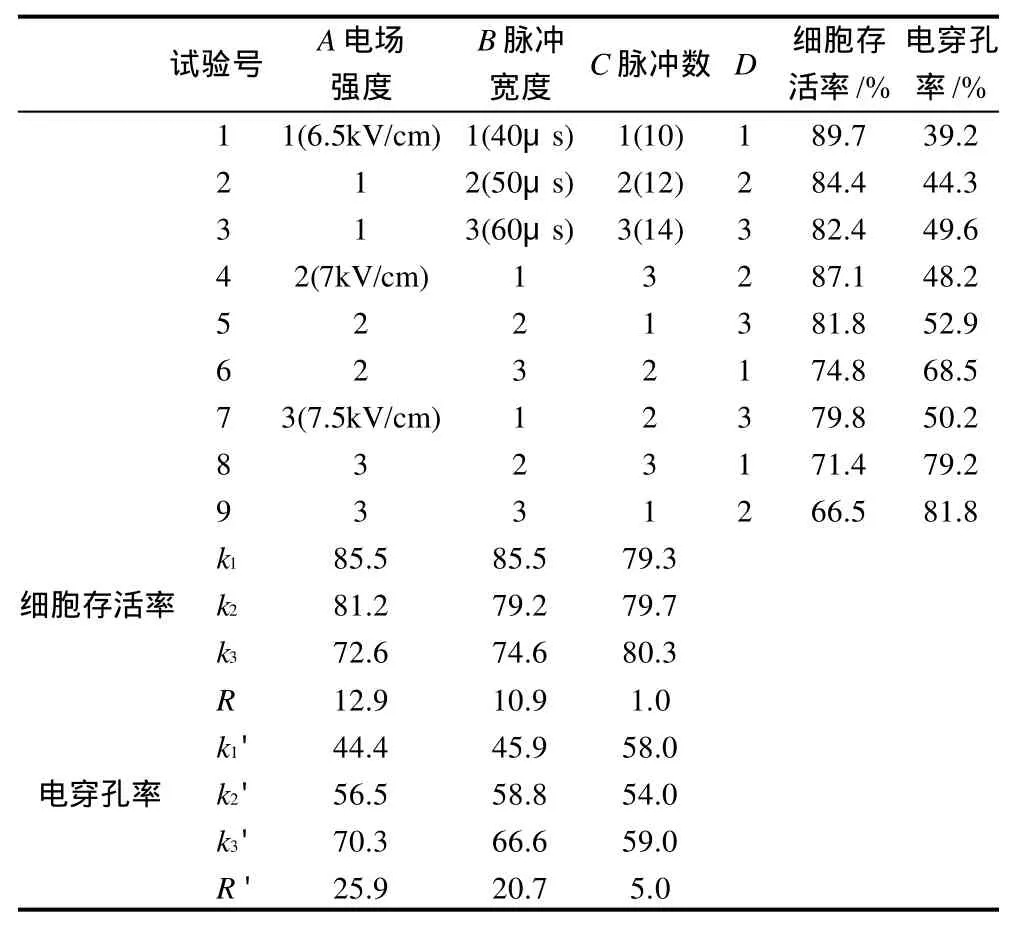
表2 正交试验确定最适电脉冲条件Table 2 Arrangement and experimental results of the orthogonal array design for optimizing square-wave electric pulse treatment conditions
2.5 验证实验
设置电场强度为7kV/cm,脉冲宽度为50μs,脉冲数为14,间隔时间为2s,在此条件下对酵母菌细胞进行电脉冲处理,酵母菌细胞的存活率平均为81.16%,电穿孔率平均为65.14%。这与Suga等[5]和Weaver等[19]的研究结果相近。
2.6 酵母菌细胞的电镜观察
为了直观的描述方波脉冲对酵母菌细胞的电穿孔现象,采用扫描电子显微镜对其进行观察,结果见图5。
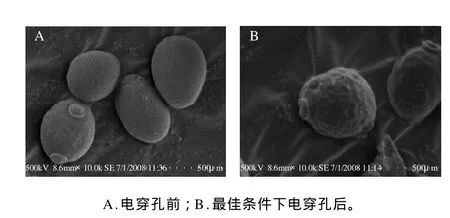
图5 酵母菌细胞电穿孔前后的扫描电镜照片Fig.5 Scanning electron micrographs of yeast cells before and after electroporation
由图5可以看出,电穿孔前的酵母菌细胞较完整,表面光滑且无杂物,而电穿孔后的酵母菌细胞表面粗糙,并且表面附有许多碎片,这可能是由于细胞通透性增加后,还没来得及固定,可逆孔洞就开始复原,形成了非常粗糙的表面,这可以证明细胞的可逆电穿孔洞维持的时间极短,在几秒内就会复原。
3 讨 论
酵母菌在发酵工业中的应用日趋广泛,其中酿酒酵母是较好的研究对象[20]。本研究最终确定了增强酵母菌细胞通透性的最佳电穿孔条件,结果表明电穿孔法可以有效改变酵母菌的通透性。
在实验过程中发现电场强度和脉冲宽度对酵母菌细胞存活率和电穿孔率的影响都较明显,这是因为施加的电场强度决定了细胞两侧电压的大小,该电压使细胞结构瞬间变化,脉冲宽度的长短决定了细胞是否出现微孔,并使之增大[21]。
当脉冲宽度一定,细胞膜两侧电压达到临界跨膜电压时,细胞才会发生电穿孔现象,如果电场强度较低,只有一些体积较大的细胞两侧积累的电荷才可以使细胞形成孔洞,大部分细胞还未能形成孔洞;如果电场强度太大,细胞两侧的电压远远超过了临界电压,细胞上就会形成不可恢复的较大孔径,细胞内容物容易溶出,细胞死亡[22]。然而当脉冲宽度较低时,细胞形成的孔洞会很快恢复,细胞内离子还没有来得及释放,因此测得的钾离子含量较小,即电穿孔率较小[23];相反的,当脉冲宽度较大时,细胞形成了较大的不可逆孔洞,致使细胞的存活率下降。因此,选择合适的电场强度和脉冲宽度对于酵母菌细胞微孔的形成非常重要。
脉冲数较低时,受到电场作用的细胞数较少,或形成非常微小的孔洞,并且该微孔恢复非常迅速,这些微孔对一些离子还具有选择性[24],如果要通过膜孔导入大分子或者DNA,则需要更大的孔径[25];当脉冲数增加后,细胞受到电脉冲作用的次数增加,导致孔洞形成的数量在增加,加速了离子的流动[25];更多的脉冲数不仅增加了孔洞数,而且会使得已经形成孔洞的细胞继续受到电脉冲作用,细胞结构来不及复原,并且多次作用后,细胞孔径增大,容易形成不可逆的孔洞[22]。
电致孔洞的复原机制至今仍处于理论模型阶段[26]。一般细胞电穿孔的可逆性和复原时间是由维持孔洞边缘的能量来确定,如果维持孔洞边缘的势能比恢复双分子层的势能高,则孔洞就不稳定,膜将很快复原,否则孔洞将继续扩大。实际细胞膜上孔洞的复原非常复杂,不单只与类脂分子的极性头部的亲水作用和碳氢链的范德华引力有关,还与胶体渗透作用、溶液离子作用和膜蛋白的影响等有关[21],因此,电致孔洞的复原机制还有待进一步深入研究。
[1] PHEZ E, FAURIE C, GOLZIO M, et al. New insights in the visualization of membrane permeabilization and DNA/membrane interaction of cells submitted to electric pulses[J]. Biochimica et Biophysica Acta(BBA), 2005, 1724(3): 248-254.
[2] KRAMAR P, MIKLAVCIC D, LEBAR A M, et al. Determination of the lipid bilayer breakdown voltage by means of linear rising signal[J].Bioelectrochemistry, 2007, 70(1): 23-27.
[3] 王士彬, 孙才新, 姚陈果, 等. 电穿孔技术的研究及应用进展[J]. 国外医学: 生物医学工程分册, 2005, 28(6): 370-373.
[4] 肖华娟, 严萍, 牟群. 强脉冲电场致细胞膜电穿孔的实验研究[J]. 中国科学院研究生院学报, 2005, 22(4): 462-466.
[5] SUGA M, GOTO A, HATAKEYAMA T. Control by osmolarity and electric field strength of electro-induced gene transfer and protein release in fission yeast cells[J]. Journal of Electrostatics, 2006, 64(12): 796-801.
[6] 谭言飞. 脉冲电磁场对细胞电穿孔的研究[D]. 成都: 四川大学, 2001.
[7] 陈乃用. 电穿孔法在细菌质粒转化中的应用[J]. 微生物学通报, 1991,18(2): 97-103.
[8] SAULIS G, SATKAUSKAS S, PRANEVICIUTE R. Determination of cell electroporation from the release of intracellular potassium ions[J].Analytical Biochemistry, 2007, 360(2): 273-281.
[9] MORITA T, HABE H, FUKUOKA T, et al. Convenient transformation of anamorphic basidiomycetous yeasts belonging to genus pseudozyma induced by electroporation[J]. Journal of Bioscience and Bioengineering,2007, 104(6): 517-520.
[10] 郭庆功, 马雪莲, 张弘. 低强度瞬态电磁场脉冲作用于不同动物细胞形成电穿孔的实验比较[J]. 四川大学学报, 2002, 39(3): 580-582.
[11] SHIRAKASHI R, SUKHORUKOV V L, TANASAWA I. Measurement of the permeability and resealing time constant of the electroporated mammalian cell membranes[J]. International Journal of Heat and Mass Transfer, 2004, 47(21): 4517-4524.
[12] 汪和睦, 汪洲. 细胞电穿孔与电融合的机理及应用[J]. 生物化学与生物物理进展, 1994, 21(4): 322-326.
[13] 秦玉静, 金建玲, 鲍晓明, 等. 影响酿酒酵母电击转化率的条件[J].山东大学学报, 1999, 34(2): 236-240.
[14] RODRIGUEZ M C, ALEGRE M T, MESAS J M. Optimization of technical conditions for the transformation of Pediococcus acidilactici P60 by electroporation[J]. Plasmid, 2007, 58(1): 44-50.
[15] BORETSKY Y R, PYNYAHA Y V, BORETSKY V Y, et al. Development of a transformation system for gene knock-out in the flavinogenic yeast Pichia guilliermondii[J]. Journal of Microbiological Methods,2007, 70(1): 13-19.
[16] 董顺玲. 原子吸收火焰法测定合力康粉剂中钾钠钙镁锌铁的含量[J].中国药科大学学报, 2003, 34(6): 541-543.
[17] 张华山, 余响华, 李亚芳. 酿酒酵母与糖化酵母原生质体的形成与再生[J]. 武汉理工大学学报, 2006, 28(7): 27-29.
[18] 赵悦茗, 杜跃超, 罗晨. 安琪超级酿酒酵母原生质体制备与再生条件研究[J]. 酿酒科技, 2008(1): 17-20.
[19] WEAVER J C, HARRISON G I, BLISS J G, et al. Electroporation:high frequency of occurrence of a transient high-permeability state in erythrocytes and intact yeast[J]. FEBS Letters, 1998, 229(1): 30-34.
[20] GUERRA O G, RUBIO I G S, FILHO C G S, et al. A novel system of genetic transformation allows multiple integrations of a desired gene in Saccharomyces cerevisiae chromosomes[J]. Journal of Microbiological Methods, 2006, 67(3): 437-445.
[21] HE Huiqi, CHANG D C, LEE Y K. Nonlinear current response of micro electroporation and resealing dynamics for human cancer cells[J].Bioelectrochemistry, 2008, 72(2): 161-168.
[22] 汪和睦, 谢廷栋. 细胞电穿孔电融合电刺激原理技术及应用[M]. 天津: 天津科学技术出版社, 2000: 52-61.
[23] PAVLIN M, LEBEN V, MIKLAVCIC D. Electroporation in dense cell suspension:Theoretical and experimental analysis of ion diffusion and cell permeabilization[J]. Biochimica et Biophysica Acta, 2007, 1770(1):12-23.
[24] PAKHOMOV A G, SHEVIN R, WHITE J A, et al. Membrane permeabilization and cell damage by ultrashort electric field shocks[J].Archives of Biochemistry and Biophysics, 2007, 465(1): 109-118.
[25] 王江, 於卫春, 费向阳. 外电场作用下压控电穿孔模型的研究[J]. 中国生物医学工程学报, 2006, 25(1): 69-73.
[26] PLIQUETT U, JOSHI R P, SRIDHARA V, et al. High electrical field effects on cell membranes[J]. Bioelectrochemistry, 2007, 70(2): 275-282.
Optimization of Square-wave Electroporation for Increasing the Permeability of Yeast Cells
JI Zhao-jun,SUN Bo*,CHI Yu-jie,XU Ning
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Q93.31
A
1002-6630(2010)15-0050-05
2009-11-23
黑龙江省“十一五”科技攻关计划项目(GA06B402-86-6)
冀照君(1982—),男,助教,硕士,研究方向为食品微生物与发酵。E-mail:jzj808@163.com
*通信作者:孙波(1964—),男,副教授,硕士,研究方向为食品微生物与发酵。E-mail:bosun1962@163.com
