热处理及葡萄糖酸-δ-内酯对大豆分离蛋白凝胶特性的影响
2010-09-13于国萍韩宗元
于国萍,安 静,韩宗元
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
热处理及葡萄糖酸-δ-内酯对大豆分离蛋白凝胶特性的影响
于国萍,安 静,韩宗元
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
探讨热处理以及葡萄糖酸-δ-内酯诱导的酸化作用对大豆分离蛋白凝胶特性的影响。结果表明:热处理显著提高大豆分离蛋白凝胶的凝胶强度、表面疏水性、保水性。最佳工艺条件为:90℃加热处理40min。大豆分离蛋白经葡萄糖酸-δ-内酯诱导酸化后,形成热处理凝胶的凝胶特性发生了显著的变化。
热处理;葡萄糖酸-δ-内酯;诱导;大豆分离蛋白;凝胶
Abstract :Soybean protein isolate (SPI) was heated for different periods of time at different temperatures in order to investigate the effects of length of heating time and heating temperature on the gel strength, surface hydrophobicity, water-holding capacity of SPI. Length of heating time of 40 min and heating temperature of 90 ℃ were found optimum. Along with this, glucono-δlactone-induced acidification on SPI was investigated, and the optimum induction time was found to be 6 h. Also, the effect of acidification induced by different concentrations of glucono-δ-lactone followed by heating treatment under optimized conditions on the gel strength, surface hydrophobicity, water-holding capacity of SPI was explored, and the results obtained showed that glucono-δ-lactone-induced acidification resulted in significant changes in these three characteristics of heated SPI.
Key words:heat treatment;glucono-δ-lactone;induce;soy protein isolate;gel
大豆蛋白不仅是一种优质植物蛋白源,同时在食品中具有许多功能性质,如起泡性、乳化性、溶解性、凝胶性等。凝胶特性作为大豆蛋白产品的一个重要功能特性,直接影响着产品如豆制品和灌肠制品的品质[1]。目前,我国开发的大豆分离蛋白产品主要是肉制品添加蛋白,即凝胶型分离蛋白[2]。
大豆分离蛋白(SPI)凝胶的形成过程和网络结构受盐浓度、pH值及温度等因素的影响。蛋白质网络结构的形成是由于蛋白质-蛋白质和蛋白质-水之间的相互作用平衡以及相邻多肽链之间吸引力和排斥力共同作用的结果[3]。在热诱导大豆蛋白凝胶形成的过程中,涉及的分子作用力可能是氢键、疏水性相互作用,而维持凝胶结构时可能的作用力是二硫键和氢键[4]。
葡萄糖酸-δ-内酯(glucono-δ-lactone,简称GDL)是由葡萄糖氧化形成的葡萄糖酸环化而成,在水溶液中会缓慢水解成葡萄糖酸,并以葡萄糖酸及其δ内酯和γ内酯的平衡状态存在。葡萄糖酸-δ-内酯作为凝固剂被广泛应用于大豆制品的加工过程中[5]。Koyama等[6]研究表明GDL诱导大豆分离蛋白(SPI)的凝胶作用是由于GDL中质子降低了蛋白质分子中负电荷基团间静电斥力的结果。
本实验以大豆分离蛋白为原料,研究温度、加热时间等热处理条件以及GDL诱导酸化对大豆蛋白凝胶特性的影响,了解其变化规律,寻找其可能的变化机理,为改进我国大豆蛋白的功能性和应用价值提供参考。
1 材料与方法
1.1 材料、试剂与仪器
大豆分离蛋白 哈高科大豆食品有限责任公司。
1-苯胺基萘-8-硝基苯甲酸盐(ANS) 美国Sigma公司;葡萄糖酸-δ-内酯 江西新黄海医药食品化工有限公司;其余试剂均为国产分析纯。
TA-XT plus物性测定仪 英国Stable Micro System公司;HITACHI 650-60荧光分光光度计 日本岛津公司;pH计 梅特勒-托利多仪器(上海)有限公司;HJ-3恒温磁力搅拌器 江苏金坛市中大仪器厂;离心机 北京医药离心机厂。
1.2 方法
1.2.1 大豆分离蛋白备用液的制备[7]
以一定量的大豆分离蛋白分散在100mL水中,室温下,用磁力搅拌器搅拌2h。置于4℃冰箱过夜,备用。大豆分离蛋白最终质量浓度为13g/100mL。
1.2.2 热处理对大豆分离蛋白凝胶性的影响
1.2.2.1 加热温度对大豆分离蛋白凝胶性的影响
将50mL大豆分离蛋白备用液加入100mL烧杯中,用保鲜膜封口,在60、70、80、90、100℃条件下,水浴40min。然后,用冰水浴将凝胶迅速冷却至室温。最后,将样品置于4℃冰箱过夜[8],用于凝胶性质的测定。
1.2.2.2 加热时间对大豆分离蛋白凝胶性的影响
将50mL的大豆分离蛋白备用液加入100mL烧杯中,用保鲜膜封口,在90℃条件下,水浴10、20、30、40、50min。然后,用冰水浴将凝胶迅速冷却至室温。最后,将样品置于4℃冰箱过夜,用于凝胶性质的测定。
1.2.3 葡萄糖酸-δ-内酯(GDL)诱导对大豆分离蛋白凝胶性的影响
1.2.3.1 GDL诱导大豆分离蛋白的酸化程度的判定[7]
取大豆分离蛋白备用液6份,加入葡萄糖酸-δ-内酯(GDL),使其终质量浓度分别为0.8、1.6、2.4、3.2、4.0、4.8g/100mL。由于GDL具有酸化作用,因此在不同的时间间隔内对样品pH值进行测定,确定酸化时间。
1.2.3.2 GDL-诱导对大豆分离蛋白凝胶性的影响
取大豆分离蛋白备用液7份,加入葡萄糖酸-δ-内酯(GDL),使其终浓度分别0、0.8、1.6、2.4、3.2、4.0、4.8g/100mL。室温下,用磁力搅拌器缓慢的搅拌至酸化时间(6h)。然后将GDL-诱导的大豆分离蛋白在90℃加热40min,然后,用冰水浴将凝胶迅速冷却至室温。最后,将样品置于4℃冰箱过夜,制成GDL-诱导的大豆分离蛋白凝胶(以GDL添加量为0时的凝胶,为对照)。用于凝胶性质的测定。
1.2.4 大豆分离蛋白凝胶的质构分析
依据Gu等[7]蛋白凝胶的检测方法,略有改动。样品测定前在室温下陈化1h即可测定。凝胶大小约为50mm×25mm。采用P/0.5柱形探头, 设定前进速度:10mm/s,冲压速度:10mm/s;后撤速度:10mm/s,冲压深度:10mm;一次测定过程中探头下压两次。每个样品重复3次测定过程,取平均值,得凝胶质构参数。
1.2.5 大豆分离蛋白凝胶的表面疏水性指数测定[8-9]
取一块加热后的大豆分离蛋白凝胶,加入到0.01mol/L,pH7.0的磷酸缓冲液中,在室温下,用磁力搅拌器缓慢的搅拌2h。然后,将处理过的样品在9000r/min条件下离心15min。取上清液备用。采用ANS(1-苯胺基-8-萘磺酸)荧光探针法,对大豆分离蛋白凝胶的表面疏水性指数进行测定,具体方法见文献[9]。
1.2.6 大豆分离蛋白凝胶的保水性测定[7]
依据Gu等[7]蛋白凝胶保水性的检测方法,略有改动。大豆蛋白凝胶在9000r/min条件下离心20min。保水性(WHC)公式如下:

式中:mt为凝胶样品中所含水分的总质量/g;mr为离心后凝胶溢出水分的质量/g。
1.2.7 统计分析
每次实验重复3次。所用数据均为3次的平均值,误差项为标准差;数据标注字母不同者为差异显著(P<0.05)。数据均使用SPSS 13.0软件进行统计分析。
2 结果与分析
2.1 热处理对大豆分离蛋白凝胶性的影响
2.1.1 热处理对大豆分离凝胶强度的影响
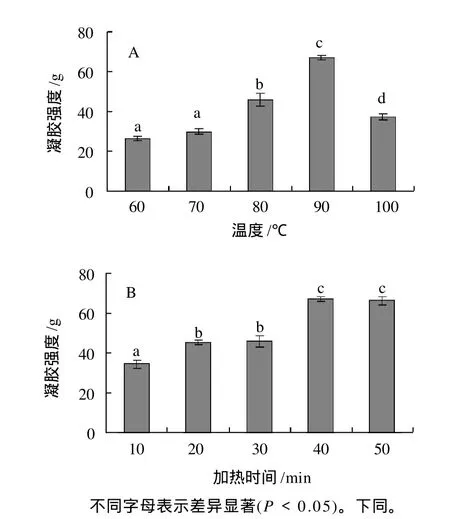
图1 温度(A)和加热时间(B)对大豆分离蛋白凝胶强度的影响Fig.1 Effect of temperature(A) and heating time(B) on strength of SPI gel
由图1可知,温度在60~90℃范围内,随温度的升高,凝胶强度显著升高;直到90℃,凝胶强度达到最大;当温度继续升高,凝胶强度显著下降。加热时间在10~40min范围内,随加热时间的增加,凝胶强度显著增加;直到40min,凝胶强度达到最大;当加热时间继续增加,凝胶强度变化不显著。
Li等[10]研究发现,经热处理的蛋白溶液主要由三部分组成,即聚集体、中间体及未聚集部分。从凝胶形成的过程考虑,热诱导大豆蛋白凝胶的形成与聚集体百分含量及粒径大小有关。随着溶液质量浓度的不断升高,聚集体特性不断增强,其粒径亦不断增大。具有较大体积和开放性结构的聚集体为交联提供更多的相互作用位点,使得凝胶强度增加。
2.1.2 热处理对大豆分离凝胶表面疏水性的影响
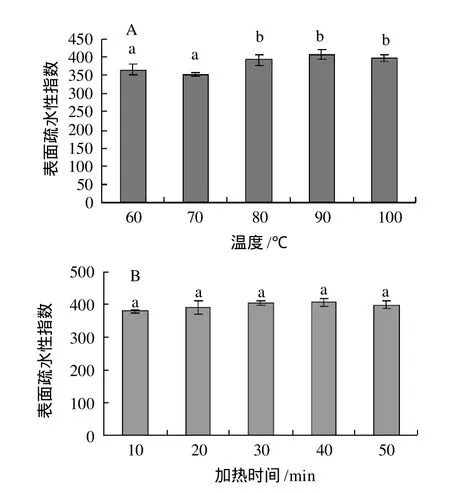
图2 温度(A)和加热时间(B)对大豆分离蛋白凝胶表面疏水性的影响Fig.2 Effect of temperature(A) and heating time(B) on surface hydrophobicity of SPI gel
由图2可知,温度在60~70℃范围内,随温度的升高,凝胶表面疏水性指数变化不显著;直到80℃,凝胶表面疏水性指数显著增加,并达到最大;当温度继续升高,凝胶表面疏水性指数变化不显著。加热时间在10~50min范围内,随加热时间的增加,凝胶表面疏水性指数变化不显著。
大豆蛋白在热处理过程中的变化是复杂的,因为它们在中性条件下含有可溶性的寡聚体[8]。寡聚蛋白的热变性过程可分为两个阶段:1)寡聚体结构的破坏,2)实际存在的单体变性,开始聚集。球蛋白的变性包括蛋白质二级结构和三级结构的破坏,多肽链的展开以及疏水部位的暴露[11]。表面疏水性的增加是由于聚集体解离引起的疏水区域的增多[12]。Campbell等[8]也报道了大豆蛋白聚集体的存在,在中性条件下,尽管这些低聚体变性了,但是这些低聚体仍然是可溶的。这些报导都解释了疏水性增加这一事实。
2.1.3 热处理对大豆分离凝胶保水性的影响
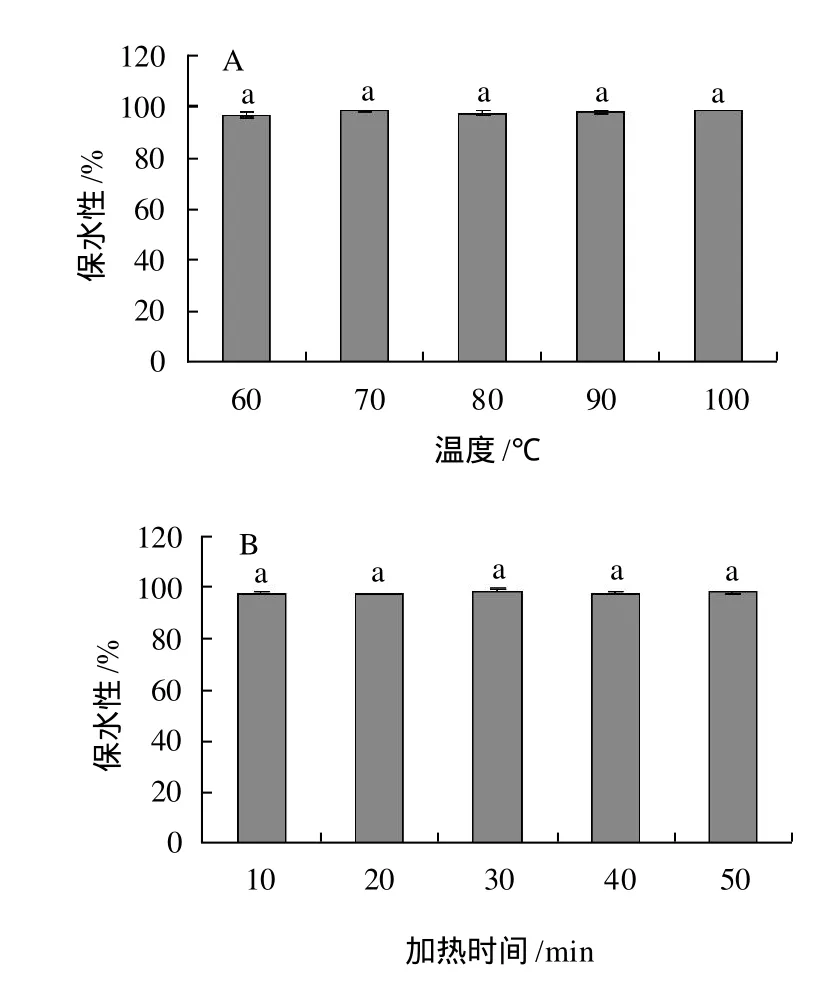
图3 温度(A)和加热时间(B)对大豆分离蛋白凝胶保水性的影响Fig. 3 Effect of temperature(A) and heating time(B) on water-holding capacity of SPI gel
由图3可知,未经热处理的大豆分离蛋白的保水性是(65.88±1.08)%,温度在60~100℃范围内,随温度的升高,凝胶保水性在96.78%~98.74%的范围内,变化不显著。加热时间在10~50min范围内,随加热时间的增加,凝胶保水性变化不显著。但是,同未经加热处理的大豆分离蛋白相比,热处理显著增加了大豆分离蛋白凝胶的保水性。
大豆分离蛋白加热后形成的凝胶,具有很好的保水性。可能是因为:由于热处理,引起蛋白溶解度降低和二硫键增加,导致凝胶网络结构的加强和凝胶“锁水能力”的增强[8]。保水性的增加也归因于SPI变性程度的增加[12]。另外,凝胶中持水的数量也和凝胶内部的孔径大小有关[8]。
2.2 葡萄糖酸-δ-内酯(GDL)诱导对大豆分离蛋白凝胶性的影响
2.2.1 GDL诱导大豆分离蛋白的酸化程度的判定
未添加GDL时,大豆分离蛋白pH值为7.30。由图4可知,随着GDL添加量的增加,GDL诱导大豆分离蛋白的pH值降低,随作用时间的增加,样品的pH值也不断下降,在6h后,6个样品的pH值分别稳定在5.72、5.10、4.70、4.33、4.08、3.88,24h后,pH值仅继续降低了0.2。由此表明:SPI体系的pH值在6h已基本稳定,因此选择GDL的诱导时间是6h。
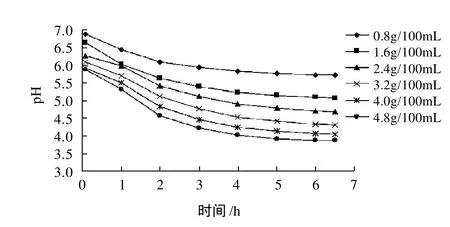
图4 GDL诱导大豆分离蛋白酸化程度的判定Fig.4 Identification of acidification degree for GDL-induced SPI
2.2.2 GDL-诱导对大豆分离蛋白凝胶强度的影响
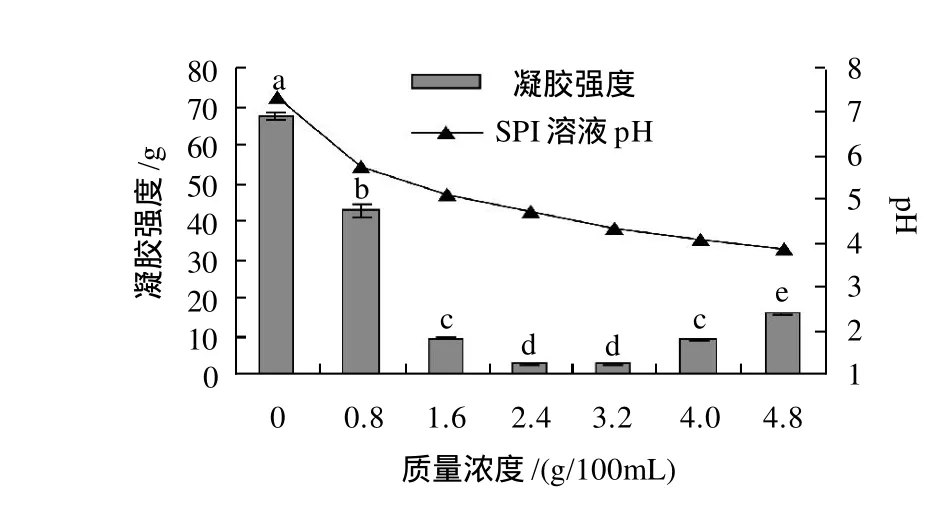
图5 GDL-诱导对大豆分离蛋白凝胶强度的影响Fig.5 Effect of GDL induction on strength of SPI gel
由图5可知,GDL-诱导的大豆分离蛋白凝胶,与对照凝胶(pH7.30)相比,凝胶强度显著下降。其中当GDL添加量为2.4g/100mL(pH4.70)和3.2g/100mL(pH4.33),即在蛋白等电点附近时,凝胶强度最低。
GDL诱导大豆分离蛋白的凝胶作用是由于GDL中质子降低了蛋白质分子中负电荷基团之间的静电斥力的结果[6]。在蛋白等电点(pH4~5)时,静电斥力达到最小值,此时静电荷为零。疏水相互作用引起的变性蛋白的聚集会由于没有了静电斥力的稳定作用而增强[8]。蛋白溶解度在等电点是最低的,张红娟等[13]研究表明:11S 球蛋白在pH4.4~6.4 等电点范围也无法形成凝胶,而是蛋白质颗粒的聚集,上层析出大量的水。当pH值高于5和低于4时,溶解度都会增加[14],GDL诱导的大豆分离蛋白凝胶强度加大。
2.2.3 GDL-诱导对大豆分离蛋白凝胶表面疏水性的影响
由图6可知,GDL添加量在0~2.4g/100mL的范围内,随GDL添加量的增加,GDL-诱导凝胶的表面疏水性指数显著下降;其中GDL添加量为1.6g/100mL(pH5.10)时,GDL-诱导凝胶的表面疏水性指数达到最低;之后,随GDL添加量的继续增加,GDL-诱导凝胶的表面疏水性指数显著增加。直到GDL添加量为4.8g/100mL(pH3.88)时,GDL-诱导凝胶的表面疏水性指数高于对照凝胶(pH7.30)。
在酸性pH3.8~4.5条件下,对天然的大豆分离蛋白加热,会导致大多数蛋白质变得不溶解[8,14],蛋白溶解度在等电点时最低。在GDL添加量为1.6g/100mL和2.4g/100mL时,pH值分别为5.10和4.70,接近大豆分离蛋白等电点,溶解性较低,故凝胶的表面疏水性指数相对较低。

图6 GDL-诱导对大豆分离蛋白凝胶表面疏水性的影响Fig.6 Effect of GDL induction on surface hydrophobicity of SPI gel
2.2.4 GDL-诱导对大豆分离蛋白凝胶保水性的影响

图7 GDL-诱导对大豆分离蛋白凝胶保水性的影响Fig.7 Effect of GDL induction on water-holding capacity of SPI gel
由图7可知,GDL-诱导的大豆分离蛋白凝胶,与对照凝胶(pH7.30)比,保水性显著下降。随GDL添加量的增加,GDL-诱导的大豆分离蛋白凝胶的保水性变化不显著。与对照相比,GDL诱导的SPI热凝胶的保水性下降。这种现象证明了Penkema的报道:与中性pH值下形成的凝胶比,酸性pH值下形成的凝胶结构更粗糙,导致其渗透性增强,保水性下降[15]。
据报道:对于SPI溶液,不溶性蛋白成分、—SH、保水性之间存在关联性[8,12]。GDL诱导的SPI热凝胶也存在同样的关联性[8]。
Campbell等[8]研究表明:在中性条件下加热SPI会导致大的聚合体形成,而这些聚合体在被GDL酸化时,与天然存在的蛋白共沉淀,因此,形成了更大的聚合体。 在低pH值条件下,凝胶网络结构由不溶性蛋白质构成,其中还涉及到疏水相互作用和二硫键的形成。
3 结 论
热处理能够显著提高大豆分离蛋白的凝胶特性,其凝胶强度、表明疏水性、保水性均有所提高。最佳条件为:90℃加热处理40min。
由于葡萄糖酸-δ-内酯诱导的酸化作用,大豆分离蛋白体系的pH值不断降低。当GDL诱导的时间是6h时,pH值基本恒定,SPI体系稳定。因此选择的GDL诱导的时间是6h。
大豆分离蛋白经质量浓度为0~4.8g/100mL的葡萄糖酸-δ-内酯诱导酸化后,形成的热处理凝胶的凝胶特性发生了显著的变化。凝胶强度均有所下降;疏水性呈现出趋势性变化;保水性由97.83%下降到43.68%。
[1] 郑雅丹, 张建友, 丁玉庭, 等. 大豆蛋白凝胶特性研究进展[J]. 中国酿造, 2008, 191(14): 11-15.
[2] 江连洲. 大豆加工利用现状及发展趋势[J]. 食品与机械, 2000, 75(1):7-10.
[3] BRAGA A L M, AZEVEDO A, MARQUES M J, et al. Interactions between soy protein isolate and xanthan in heat-induced gels: The effect of salt addition[J]. Food Hydrocolloids, 2006, 20: 1178-1189.
[4] UTSUMI S, KINSELLA J E.Forces involved in soy protein gelation:Effects of various reagents on the formation, hardness and solubility of heat-induced gels made from 7S, 11S and soy isolate[J]. Journal of Food Science, 1985, 50: 1278-1282.
[5] 饶华英. 葡萄糖酸内酯及其盐类的生产和应用[J]. 湖北化工, 1988(3): 47-48.
[6] KOYAMA K, SANO Y, DOI E. Rheological characteristics and gelation mechanism of tofu (soybean curd)[J]. Journal of Agricultural and Food Chemistry, 1995, 43: 1808-1812.
[7] GU X, CAMPBELL L J, EUSTON S R. Influence of sugars on the characteristics of glucono-δ-lactone-induced soy protein isolate gels[J].Food Hydrocolloids, 2009, 23: 314-326.
[8] CAMPBELL L J, GU X, DEWER S J, et al. Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate[J]. Food Hydrocolloids, 2009, 23: 344-351.
[9] HETTIARACHCHY N S, KALAPATHY U, MYERS D J. Alkalmodified soy proteins with improved adhesive and hydrophobic properties[J]. Journal of Agricultural and Food Chemistry, 1995, 72(12): 1461-1464.
[10] LI Xianghong, LI Yun, HUA Yufei , et al. Effect of concentration, ionic strength and freeze-drying on the heat-induced aggregation of soy proteins[J]. Food Chemistry, 2007, 104(4): 1410-1417.
[11] MINE Y, NOUTOMI T, HAGA N. Thermally induced changes in egg white proteins[J]. Journal of Agricultural and Food Chemistry, 1990,38: 2122-2125.
[12] SORGENTINID A, WAGNERJ R, ANON M C. Effects of thermal treatment of soy protein isolate on the characteristics and structurefunction relationship of soluble and insoluble fractions[J]. Journal of Agricultural and Food Chemistry, 1995, 43: 2471-2479.
[13] 张红娟, 陈振昌, 周瑞宝. pH 值对11S 球蛋白结构与凝胶性的影响[J]. 食品科技, 2003(5): 26-31.
[14] RENKEMA J M S, VLIET T V. Heat-induced gel formation by soy proteins at neutral pH[J]. Journal of Agricultural and Food Chemistry,2002, 50: 1569-1573.
[15] RENKEMA J M S, VLIET T V. Relations between rheological properties and network structure of soy protein gels[J]. Food Hydrocolloids,2004, 18: 39-47.
Effects of Heating Treatment and Glucono-δ-lactone-induced Acidification on the Gel Properties of Soybean Protein Isolate
YU Guo-ping,AN Jing,HAN Zong-yuan
(College of Food Science, Northeast Agricultural University, Harbin 150030, China)
Q816
A
1002-6630(2010)15-0021-05
2009-12-02
国家“863”计划项目(2006AA10Z322);哈尔滨市科技创新人才研究专项基金项目(2006RFQXN014)
于国萍(1963—),女,教授,博士,研究方向为食品化学。E-mail:yuguopingneau@hotmail.com
