不同因素对pIIIa/N2期非小细胞肺癌患者预后的影响
2010-09-13张真榕刘德若郭永庆石彬宋之乙田燕雏
张真榕 刘德若 郭永庆 石彬 宋之乙 田燕雏
肺癌是世界上发病率最高的恶性肿瘤之一,80%为非小细胞肺癌(non-small cell lung cancer, NSCLC)。国外研究[1,2]显示,NSCLC中约30%的N2期患者5年生存率为10%-15%。淋巴结有无转移是判断肿瘤复发和预后的重要因素之一。Detterbeck[3]认为可以把pIIIa/N2期患者分成具有不同预后的亚组。目前很多医院对pIIIa/N2期病例采用包括新辅助治疗在内的综合治疗模式,然而2009年美国国家抗癌联盟[4](National Care Comprehensive Network,NCCN)对于pIIIa/N2期肺癌的治疗并未给出结论,并且对于不同亚组的治疗方式也无进一步阐述。本研究通过对133例N2期NSCLC患者的总结,对不同亚组的N2患者的预后进行分析。
1 材料与方法
1.1 临床资料 1998年1月-2004年5月就诊于中日友好医院胸外科的NSCLC患者共685例,其中pIIIa/N2期211例,本组实验对象为符合入组标准的133例pIIIa/N2患者,其中,男性64例,女性69例;平均年龄57.61岁(37岁-78岁);其中101例行肺叶/复合肺叶切除,6例行袖状肺叶切除,26例行全肺切除(表1)。
1.2 方法 入组标准:病理诊断为pIIIa/N2期NSCLC;术前诊断cN0-2,术前未行新辅助治疗;术中完成R0切除及系统性淋巴结清扫术;术后3周-6周内行辅助治疗。排除标准:不符合上述入组标准的肺癌患者;失访或非疾病相关性死亡(图1)。
术前常规行胸部CT、上腹部CT、腹部B超、锁骨上B超、气管镜、头颅MRI、骨扫描进行分期,对于术前依靠以上方法无法准确判断临床分期的患者应用PETCT;术前未进行纵隔镜分期;手术采用常规剖胸手术,手术方式:肺叶切除、复合肺叶切除、袖状肺叶切除、全肺切除,同时行系统性淋巴结清扫术。术中完成R0切除,淋巴结清扫范围:如行右肺手术,常规清扫1R、2R、3、4R、7、8R、9R、10R-13R组淋巴结,如行左肺手术,常规清扫1L、2L、3、4L、5L、6L、7、8L、9L、10L-13L组淋巴结,1st与2nd组淋巴结共同送检,12th与13th组淋巴结随所切除肺叶共同送检;术中病理回报淋巴结阳性,如能实现R0切除,行根治手术;如无法完整切除,放弃手术或完成手术,但被剔除出组。
术后3周-6周内行以铂类为基础的化疗或序贯式放化疗;133例入组患者中58例行化疗4周期-6周期,其中紫杉醇+顺铂/卡铂方案33例;健择+顺铂/卡铂方案16例;长春瑞滨+顺铂/卡铂方案9例。75例行序贯式化放疗,其中紫杉醇+顺铂/卡铂方案联合放疗49例;健择+顺铂/卡铂方案联合放疗14例;长春瑞滨+顺铂/卡铂方案联合放疗12例,所有化疗方案均为21天一个周期;放疗剂量为50 Gy-60 Gy。
1.3 随访 术后前2年每3个月复查一次胸部CT,每半年复查一次头颅MRI、骨扫描;第2年-第5年每半年复查一次胸部CT、头颅MRI、骨扫描。部分患者随访过程中根据病情变化行纤维支气管镜及其它检查。观察起始点为患者诊断为肺癌之日,随访终点为疾病相关性死亡或2009年5月1日,随访最短时间为5年。随访主要终点:疾病相关性5年生存率;随访次要终点:无瘤生存率。R0切除:肉眼与镜下切缘均为阴性;cN0-1:胸部CT纵隔内淋巴结最大径不超过1 cm;或PET/CT示SUV≤2.5;cN2:胸部CT纵隔内淋巴结最短径超过1 cm;或者PET/SUV示SUV>2.5。肺癌分期采用AJCC 1997年版[5]进行分期。
1.4 统计方法 应用SPSS 16.0软件进行统计分析;连续变量用Mean±SD显示;分离变量用比率显示;分离变量组间比较应用独立样本t检验进行统计;生存率应用Kaplan-Meier法进行统计;多因素分析应用Cox回归模型进行统计;以P<0.05为差异具有统计学意义。观察指标包括:年龄、性别、术式、T分期、cN分期、病理类型、跳跃性转移、N2淋巴结转移站数、辅助治疗与5年生存率、无瘤生存期(progression-free survival, PFS)的关系。
2 结果
共133例pIIIa/N2患者入组,总体5年生存率为32.33%。单站N2淋巴结转移与多站N2淋巴结转移亚组的5年生存率分别为39.62%和27.50%(图2);cN0-1与cN2亚组的5年生存率分别为37.78%和20.93%(图3);跳跃性与非跳跃性转移亚组的5年生存率分别为36.59%和30.43%(图4)。单变异分析显示淋巴结转移站数、cN分期以及跳跃性转移与N2期NSCLC预后呈正相关,多变异分析显示淋巴结转移站数(P=0.013, OR=0.490, 95%CI:0.427-0.781)、cN分期(P=0.009, OR=0.607, 95%CI:0.372-0.992)与N2期NSCLC的预后呈正相关(表2)。
总体5年无瘤生存率为23.31%,单变异分析显示cN分期(P=0.025)、淋巴结转移站数、pT分期、辅助治疗与无瘤生存期呈正相关;多变异分析显示淋巴结转移站数(P=0.003, OR=0.413, 95%CI: 0.342-0.723)、cN分期(P=0.040, OR=0.314, 95%CI: 0.112-0.671)、辅助治疗(P=0.014, OR=0.826, 95%CI: 0.573-1.291)与N2期NSCLC的预后呈正相关(表3)。淋巴结转移分布见图5。
3 讨论
外科治疗是治疗NSCLC最有效的手段[6]。2009年NCCN[4]指出:以外科治疗为主的综合治疗模式已成为I期、II期NSCLC患者的标准治疗模式,然而对pIIIa/N2期患者的治疗方法仍然存在争议。
从结果中我们可以看到,淋巴结转移站数、cN分期与5年生存率、无瘤生存期具有相关性;而辅助治疗仅与无瘤生存期具有相关性;其它如年龄、性别、术式、术侧、组织学等因素与二者无相关性。
国外常规采用纵隔镜、PET/CT对cN2期肿瘤进行诊断,但Cerfolio进行的一项前瞻性研究[7]发现纵隔镜、超声内镜针吸活检(EUS guided fine needle aspiration, EUS-FNA)对于PET及CT诊断为N0患者的阳性率仅为2.9%和3.7%。Meyers等[8]研究发现对于CT和PET诊断为I期NSCLC患者来说,隐匿性N2发生率为5.6%,因此对于cN0-1患者没有必要进行纵隔镜检查。本组术前未常规应用纵隔镜及PET/CT对肺癌进行分期,中日友好医院胸外科对于术前CT显示纵隔内淋巴结融合成团、与周围组织器官关系密切、考虑无法手术切除的病例(48例)首选新辅助化疗1个-2个周期,然后进行再评价,对于由cN2降为cN0-1的病例(15例)采用手术治疗;对于未降期者(33例)继续行化疗或放化疗,但结果未包含在本实验中。

表 1 入组133例患者的临床资料Tab 1 Clinical characteristics of 133 enrolled patients

图 1 入组筛选过程Fig 1 Enrolled process. NSCLC: non-small cell lung cancer; CT: chemotherapy; NST: non surgical treatment; SAT: standard adjuvant therapy; NSAT: non standard adjuvant therapy.

图 2 单站与多站转移亚组的生存曲线Fig 2 Survival curves of single station metastasis group and multistation metastasis group. Single:single station metastasis group;multi: multi-station metastasis group.

图 3 cN0-1与cN2亚组的生存曲线Fig 3 Survival curves of cN0-1 group and cN2 group
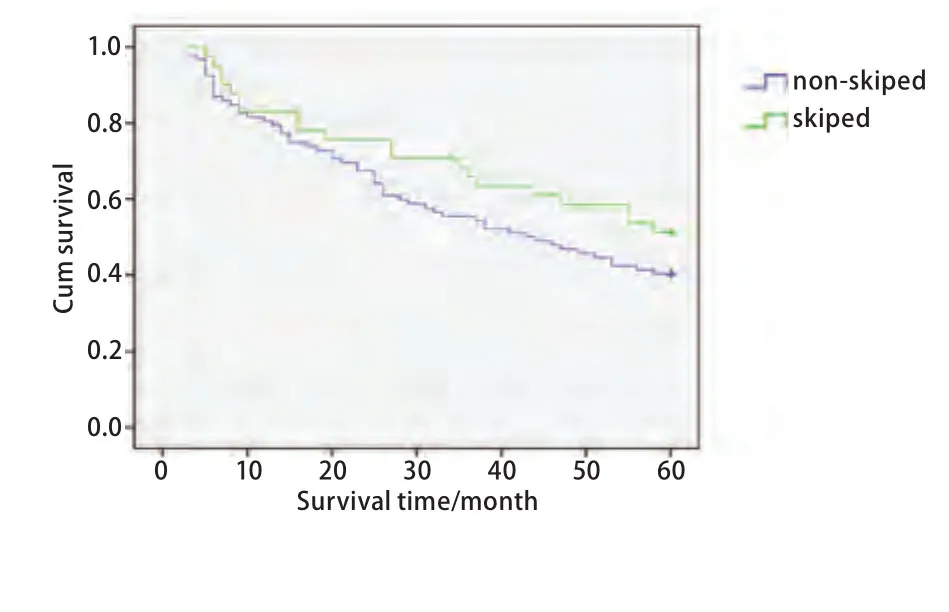
图 4 跳跃性与非跳跃性转移亚组的生存曲线Fig 4 Survival curves of skip metastasis group and non-skip metastasis group. Skip: skip metastasis group;Non-skip: non-skip metastasis group.
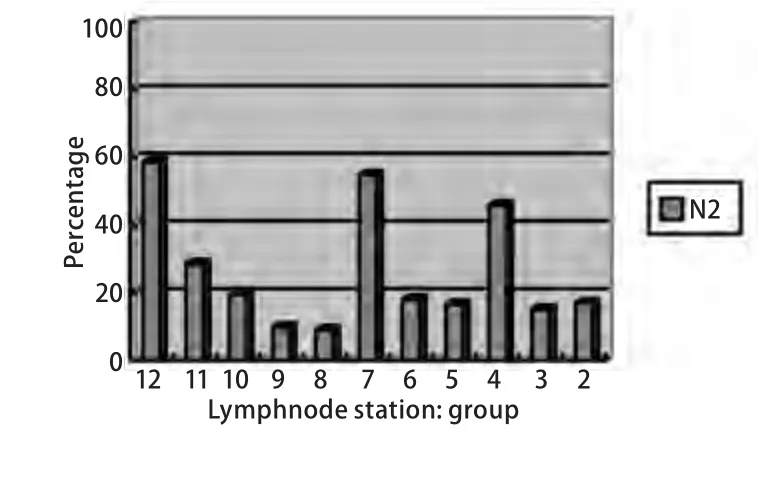
图 5 淋巴结转移分布图Fig 5 Distribution of N2 lymph nodes
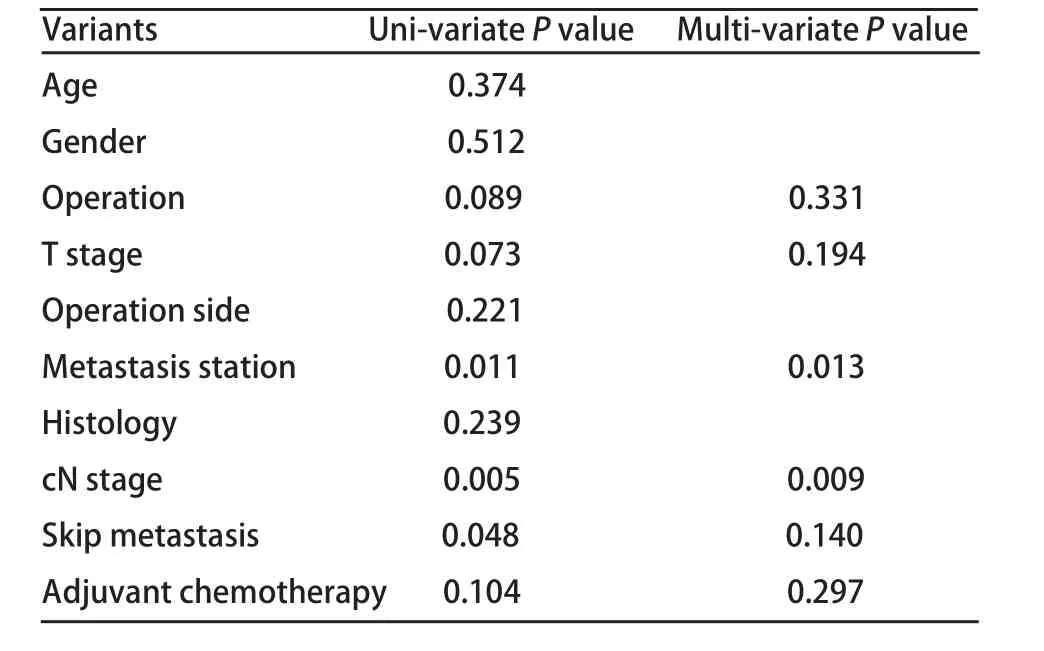
表 2 生存率相关的预后因子Tab 2 Prognostic factors related to survival
多个因素可影响N2期患者的预后,Ponn[9]的研究显示单站淋巴结转移、跳跃性转移、镜下或者薄膜内转移等与N2期患者的预后呈正相关;Detterbeck[3]的研究显示R0切除、跳跃性转移、单站N2转移、新辅助治疗的有效性、cN0-1等因素与N2期NSCLC的预后呈正相关,而性别、组织学类型、肿瘤位置、既往有无其它肿瘤史与预后无明显关系。
淋巴结转移复杂程度与肺癌恶性程度呈正比,与预后密切相关[10]。Cerfolio[11]的研究显示:单站N2及多站N2期NSCLC的5年生存率分别为40%和25%;Cox回归分析显示多站淋巴结转移与N2期NSCLC预后呈负相关;在本试验中单站与多站N2亚组的5年生存率分别为39.62%和27.50%(图2);多变异分析示单站N2淋巴结转移与预后呈正相关。单站与多站N2亚组的无瘤生存期分别为30.12%和18.75%(P=0.003),多变异分析示淋巴结转移站数与无瘤生存期呈正相关。多站N2亚组仅有15例患者术后5年未复发,说明多站N2转移恶性程度较高,术后复发倾向较高。
Saito[12]的研究显示:cN分期与pIIIa/N2期非小细胞肺癌预后有相关性,该研究发现了214例pN2病例,cN0、cN1、cN2、cN3亚组的5年生存率分别为30%、34%、14%和0%(P=0.04)。本实验结果显示cN0-1与cN2亚组的5年生存率分别为37.78%和20.93%(图3)。多变异分析显示cN0-1与pIIIa/N2期患者的预后呈正相关。我们认为这与cN0-1亚组中单站N2淋巴结转移比率较高、全肺切除比率较低有关。实验结果同时显示cN0-1与cN2亚组的无瘤生存期分别为25.56%和18.60%,cN0-1与无瘤生存期呈正相关。

表 3 无瘤生存期相关的预后因子Tab 3 Prognositc factors related to progression-free survival
理解N2期的生物学特性对制定治疗方案有重要意义[13]。通常认为肺癌淋巴结转移遵循线性模式,Riquet[14]总结了731例pN2期NSCLC病例,结果显示29.2%N2期患者发生跳跃性转移;跳跃性转移组的5年生存率为34.4%,多变异分析提示跳跃性转移与5年生存率呈正相关(P<0.05)。Cerfolio[11]对142例患者进行总结后并未发现跳跃性转移与N2期患者的预后成正相关。在本实验中,跳跃性与非跳跃性转移亚组的5年生存率分别为36.59%和30.43%,但多变异分析显示跳跃性转移并非pN2患者的独立预后因子。
全肺切除术后并发症发生率较高,对患者术后生活质量影响较大,有研究[14]显示全肺切除是N2期肺癌预后的独立危险因素。袖状切除在一定情况下可以替代全肺切除,不但可实现肿瘤的根治术,同时可实现保护肺功能、改善术后生活质量的目的[15]。本实验组行全肺切除26例(右全肺4例,左全肺22例),袖状切除6例,肺叶/复合肺叶切除101例,围手术期并发症发生率为13.53%,其中心律失常8例,肺部感染4例,肺漏气5例,肺动脉栓塞1例。肺叶/复合肺叶切除、全肺切除、袖状切除亚组的5年生存率分别为33.66%、26.32%和33.33%,多因素分析并未显示术式是预后的独立危险因素。全肺切除组术后并发症发生率与其它两组相比稍低(11.54%vs 14.02%),但差异无统计学意义(P=0.61);我们认为全肺切除组5年内生存率较其余两组低的原因可能为:肿瘤T分期相对较晚(T3期19例);术后化疗相对较晚:22例全肺切除患者术后第5-6周进行化疗。因此我们认为对于IIIa/N2期病例而言,全肺切除是安全可靠的,如条件允许,亦可以选择袖状切除术。
有研究显示肿瘤的pT分期与预后呈密切相关,Riquet[14]的研究显示随着肺癌体积增大,N2患者的5年生存率逐渐下降。本实验虽然患者的生存率随着肺癌体积增大而下降(38.46%、34.18%和29.27%),但多因素分析并未提示肿瘤T分期与患者生存率相关(P=0.194),这与其它几项研究[14,16]结果相同。
辅助化疗可以为大部分NSCLC带来生存获益,2007年ACCP指出:N2期肺癌术后应常规应用以铂类为基础的化疗[6]。一项回顾性研究[17]结果显示新的放疗技术可以降低并发症发生率,并给患者带来生存获益。本组对不同术后辅助治疗亚组进行比较,术后行化疗58例,放化疗75例,化疗与放化疗亚组相比,虽然5年生存率较低(29.31% vs 34.67%),但差异无统计学意义(P=0.104)。术后放化疗组11例发生放射性肺炎,其中7例需进行吸氧及药物治疗。化疗和放化疗亚组的无瘤生存期分别为18.97%和26.67%,多变异分析显示术后放化疗与无瘤生存期呈正相关(P=0.014)。因此我们认为虽然术后放疗对无瘤生存期有益,但放疗并发症发生率较高,且无法提高5年生存率,因此建议术后早期不必常规放疗,对于多站N2转移、肿瘤分化程度低、非R0切除的高危病例可选择放疗。
本研究中入组N2期NSCLC患者5年生存率较高的原因为:术前准确判断cN2病例的可切除性,无法完整切除者被剔除;大部分病例为cN0-1期;术前新辅助治疗者被剔除出组;肺叶/复合肺叶切除比率高,全肺切除比例较低,部分病例行袖状切除术代替全肺切除术;所有入组病例均为R0切除,并完成系统性淋巴结清扫术;术后早期放化疗。本实验不足之处:本研究为回顾性分析;切除淋巴结数目、阳性淋巴结数目未统计;术前未常规应用PET和纵隔镜进行分期;入组病例数较少。
总之,在严格入组标准条件下,仍然可以对选择性N2患者进行以外科治疗为主、联合辅助治疗的综合治疗,并获得较满意的长期生存率。
