指状许水蚤和太平洋真宽水蚤对UV-B辐射增强的敏感性比较
2010-09-13谭海丽孙广莲唐学玺
谭海丽,孙广莲,于 娟,唐学玺**
(1.中国海洋大学生态学实验室,山东青岛266003;2.山东省医学科学院基础医学研究所,山东济南250062)
指状许水蚤和太平洋真宽水蚤对UV-B辐射增强的敏感性比较
谭海丽1,孙广莲2,于 娟1,唐学玺1**
(1.中国海洋大学生态学实验室,山东青岛266003;2.山东省医学科学院基础医学研究所,山东济南250062)
采用实验生态学的方法,以半数致死浓度LD50为依据,比较研究指状许水蚤(Schmackeria inopinusBurckhardt, 1913)和太平洋真宽水蚤(Eurytemora pacif icaSato,1913)对UV-B辐射增强的敏感性差异。结果表明,3个发育阶段对UV-B辐射增强的敏感性由高到低依次排序为无节幼体>桡足幼体>成体。而雄体成体比雌性成体敏感。2种海洋桡足类比较,太平洋真宽水蚤和指状许水蚤对UV-B辐射增强的敏感性同样存有差异。在整个发育过程的各个时期,太平洋真宽水蚤的敏感性都明显高于指状许水蚤。纵观整个发育过程,太平洋真宽水蚤对UV-B辐射增强最敏感的时期是无节幼体NⅥ和桡足幼体CⅠ,而指状许水蚤对UV-B辐射增强最敏感性时期为无节幼体的NⅣ和NⅤ。
UV-B辐射增强;敏感性;指状许水蚤;太平洋真宽水蚤
臭氧层的减薄是当今最引人注目的全球变化现象之一。根据联合国世界气象组织的报告,1995年南极臭氧洞比以往任何时候都大,而且臭氧层的侵蚀和破坏仍在日渐加重,我国青藏高原上空也出现季节性的臭氧低值中心。臭氧层的减薄使得到达地面的紫外线,尤其是对生物具严重损伤作用的紫外线B波段(UV-B)的辐射增强,从而对全球产生明显的生态学和生物学效应[1-2]。研究表明:北海海水表面紫外线辐射率的10%能够穿透6 m深的水层,而在北冰洋的清澈水域,其表面10%的辐射率可到达30 m的水层[3]。在南极水域30 m甚至60~70 m深的水层,紫外线辐射增强都能够引起明显的生态学效应[4-5],而且底栖海洋生物对紫外线辐射的抗性远远大于浮游生物[6],导致海洋生物,尤其是海洋浮游生物受紫外线辐射伤害的潜在危险性不断增加。全球UV-B辐射的增强对海洋生态系统中的浮游生物将产生直接的影响,进而引起浮游生物从生态系统、群落、种群、个体、细胞以及分子各个层次水平上发生变化。目前国内对于UV-B辐射的研究多集中于小麦[7]、水稻[8]等农作物和藻类[9-11]上。本文选用2种海洋桡足类:指状许水蚤(Schmackeria inopinusBurckhardt, 1913)和太平洋真宽水蚤(Eurytemora pacif icaSato, 1913),比较研究其对UV-B辐射增强的敏感性,以期为揭示UV-B辐射增强对海洋富有动物乃至海洋生态系统的影响提供依据。
1 材料与方法
1.1 实验用海水
指状许水蚤实验用海水盐度为20,为煮沸后的0.45μm膜滤海水与去离子水配比而成。太平洋真宽水蚤实验用海水盐度为35,为煮沸后的0.45μm膜滤海水。
1.2 饵料单胞藻的培养
金藻8701(Isochrysis galbanaParke,8701)。取自中国海洋大学水产学院藻种室,在f/2培养液、盐度30、温度20℃、光暗周期比12L:12D条件下培养至对数生长期待用。
1.3 实验动物采集与培养
指状许水蚤(S.inopinus)采自胶南虾池,太平洋真宽水蚤(E.pacif ica)采自乳山虾池。用200目自制浮游动物网采集,暂养于10 L塑料桶中,于4 h内返回实验室后,转移到玻璃缸中。用大口吸管从中挑取活泼的指状许水蚤和太平洋真宽水蚤成体进行纯化,纯化后的指状许水蚤和太平洋真宽水蚤在5 L盛实验用海水的圆形玻璃缸中,温度为22℃的条件下饲养,饵料为金藻8701,浓度为10×104mL。指状许水蚤饲养盐度为20,太平洋真宽水蚤饲养盐度为35,不同盐度以确保指状许水蚤和太平洋真宽水蚤均能在最适条件下生长。将指状许水蚤和太平洋真宽水蚤在实验室内培养数月,待其种群数量增大后,取其子代成体作为实验动物。
1.4 UV-B辐射处理方法
8根UV-B灯管,UV-B灯外用乙酸纤维素薄膜包被,以除去<280 nm的短波照射,整个装置在实验前需连续照射72 h,以减少薄膜的滤过作用的不稳定性。UV-B灯垂直下方有1个低速(16 r/min)转动的平台,培养皿与平台同心距放置,以保证受光均匀而且模拟海水波动,防止水蚤沉底,保证浮游状态。由于UV-B穿透力很弱,实验中,量取5 mL藻液倒于直径为6 cm的培养皿中,置于距离UV-B灯20 cm的正下方处。实验将辐射强度(70μW/cm2)恒定,通过调整辐射时间控制辐射剂量。UV-B辐射一定时间后,放于黑暗中24 h,24 h后在解剖镜下观察水蚤的死亡情况。
1.5 敏感性实验方法
挑取一批带卵囊的指状许水蚤雌体(约200只)在烧杯中培养,次日用细口吸管吸取同一天(尽量相同或相近时段)刚孵化出的NⅡ期幼体至盛约80 mL实验用海水中,在实验要求条件下饲养。当天即挑取NⅡ期幼体放入盛有海水的培养皿中进行照射,每个培养皿中装入10只,UV-B辐射剂量根据幼体的敏感性不同设为7个辐射梯度,每个UV-B辐射剂量设4个平行样。照射完后加入金藻,以保证金藻浓度为10×104mL。并放入黑暗中,于24 h后在解剖镜下观察死亡情况。以用解剖针轻轻触动后,3 s内不活动即视为死亡。以后每天用吸管随机取出幼体在解剖镜下观察和鉴定,如果不能确定,则用目镜测微尺测量其体长(本文体长是从额角前端到尾叉末端),以确定动物的发育情况。依照NⅡ期幼体的测定方法依次测定NⅢ、NⅣ、NⅤ、NⅥ期无节幼体和CⅠ、CⅡ、CⅢ、CⅣ、CⅤ期桡足幼体及成体对UV-B辐射增强的敏感性。每隔2 d换水并吸取烧杯底部的残渣。
吸取大量太平洋真宽水蚤的卵放入100 mL的烧杯中,加入40 mL浓度为10×104mL的金藻饵料,用细口吸管吸取同一天(尽量相同或相近时段)刚孵化出的NⅡ期幼体至盛约80 mL实验用海水中,在实验要求条件下饲养。其它与指状许水蚤相同。
1.6 LD50的测定
根据周永欣和章宗涉[12]毒性实验方法,在预实验的基础上,设定不同的UV-B辐射剂量,以使所设最高UV-B辐射剂量使桡足类受到50%以上的死亡,用直线内插法求出LD50。
1.7 数据处理
实验数据采用数理统计法,将处理组与对照组差异进行显著性的t检验。
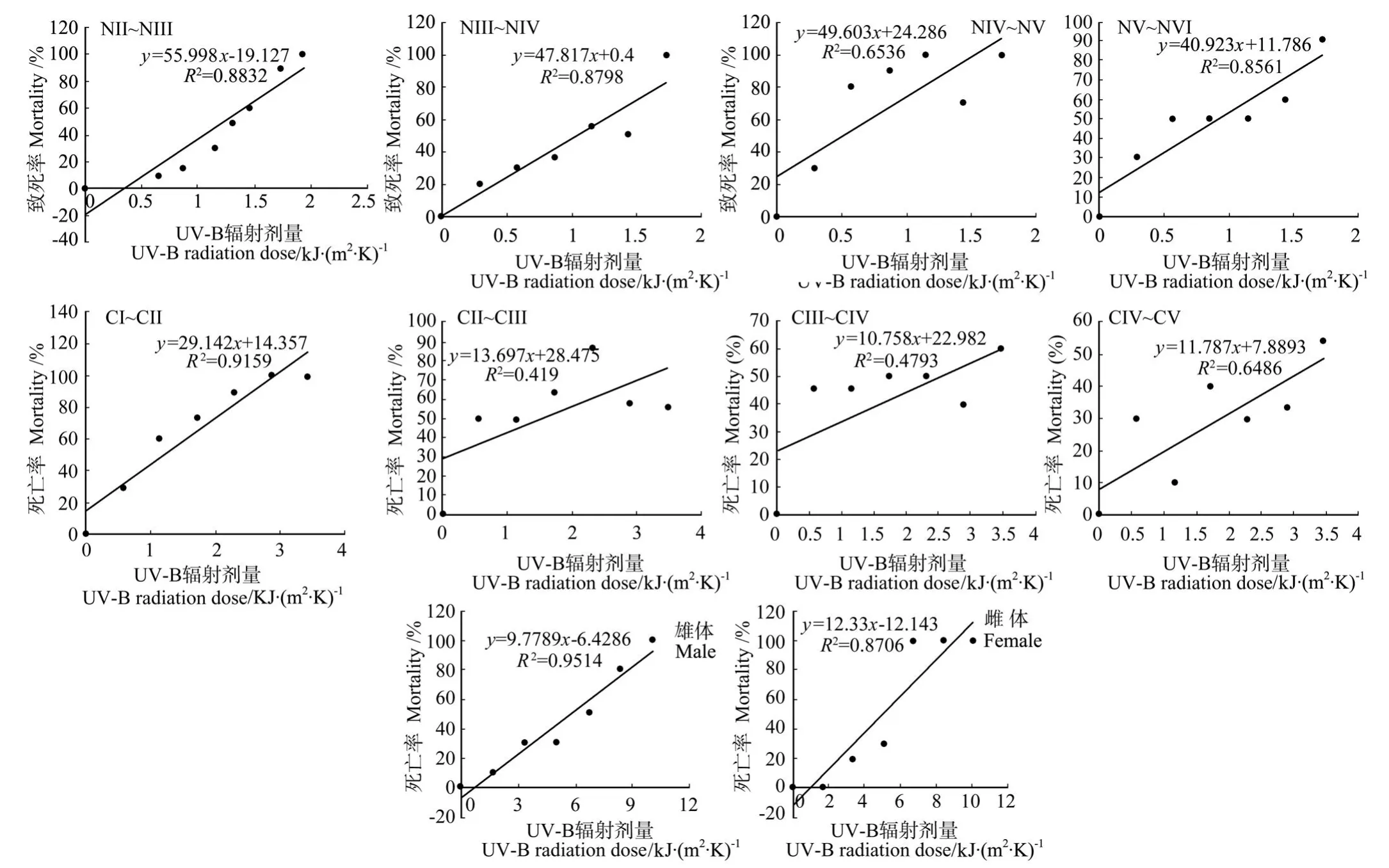
图1 UV-B辐射对指状许水蚤的无节幼体、桡足幼体、成体致死率的影响Fig.1 Effects of UV-B radiation on the mortality of nauplii,copepodite and adult ofS.inopinus
2 结果
2.1 指状许水蚤对UV-B辐射增强的敏感性
由图1可以看出,增强的UV-B辐射对指状许水蚤的无节幼体、桡足幼体、成体有致死作用,并且随着UVB辐射剂量的增大,致死率逐渐升高。但指状许水蚤的不同发育阶段(无节幼体、桡足幼体、成体)对UV-B辐射的敏感性不同,通过直线内插法,由UV-B辐射剂量和致死率的回归方程可求得UV-B辐射对指状许水蚤的无节幼体、桡足幼体、成体的24 h和48 h半数致死剂量如表1所示。由表1可知:第一,指状许水蚤的无节幼体的24 h·LD50小于桡足幼体的24 h·LD50,而桡足幼体的24 h·LD50又小于成体24 h·LD50,因此总体上来说,指状许水蚤的无节幼体对UV-B辐射增强的敏感性大于桡足幼体,而桡足幼体又大于成体,3个发育阶段对UV-B辐射增强的敏感性由大到小依次排序为无节幼体>桡足幼体>成体。第二,在无节幼体的发育阶段,NⅣ~NⅤ和NⅤ~NⅥ阶段的24 h·LD50较小,因此它们对UVB辐射增强较敏感,按敏感性由大到小的顺序依次排为NⅣ~NⅤ>NⅤ~NⅥ>NⅢ~NⅣ>NⅡ~NⅢ;在桡足幼体的发育阶段,24 h·LD50则随着龄期的增加呈现出逐渐增大趋势,敏感性大小依次排定为CⅠ~CⅡ>CⅡ~CⅢ>CⅢ~CⅣ>CⅣ~CⅤ,CⅠ~CⅡ发育阶段最敏感;第三,成体中雌体比雄体的24 h·LD50大,雌体在最大剂量10.08 K J/m2时,24 h未出现半数致死,而其48 h·LD50为5.04 K J/m2,所以成熟雄体比成熟雌体敏感;第四,纵观整个发育过程,无节幼体NⅣ和NⅤ时期对UV-B辐射增强最敏感,而雌性成体的抗性最大。
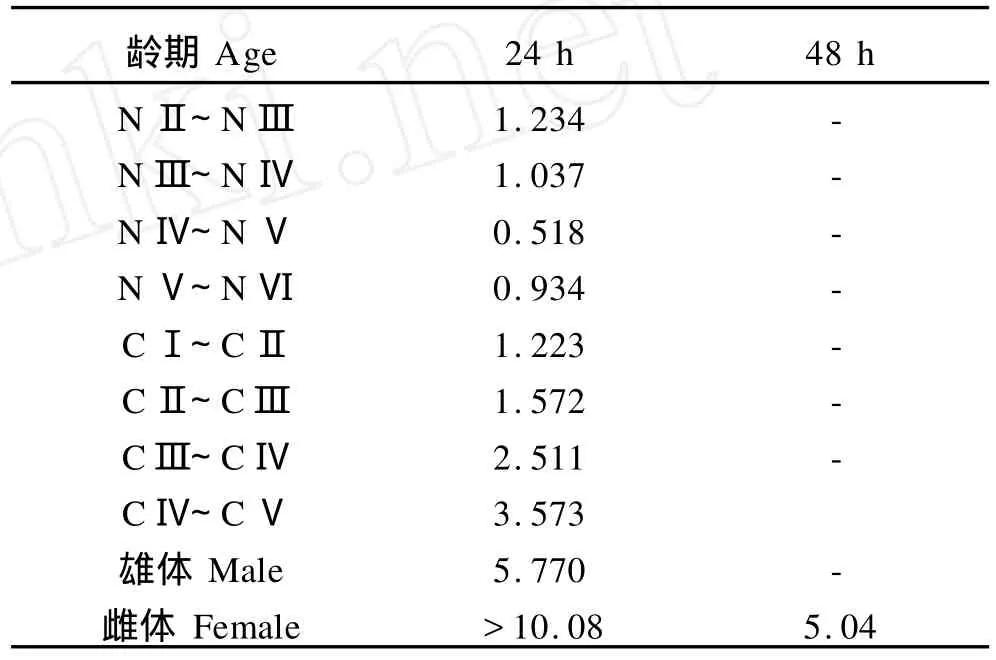
表1 指状许水蚤的无节幼体、桡足幼体、成体的24h·LD50和48h·LD50Table 1 24 h·LD50and 48 h·LD50of nauplii,copepodite and adults ofS.inopinus/kJ·(m2·K)-1
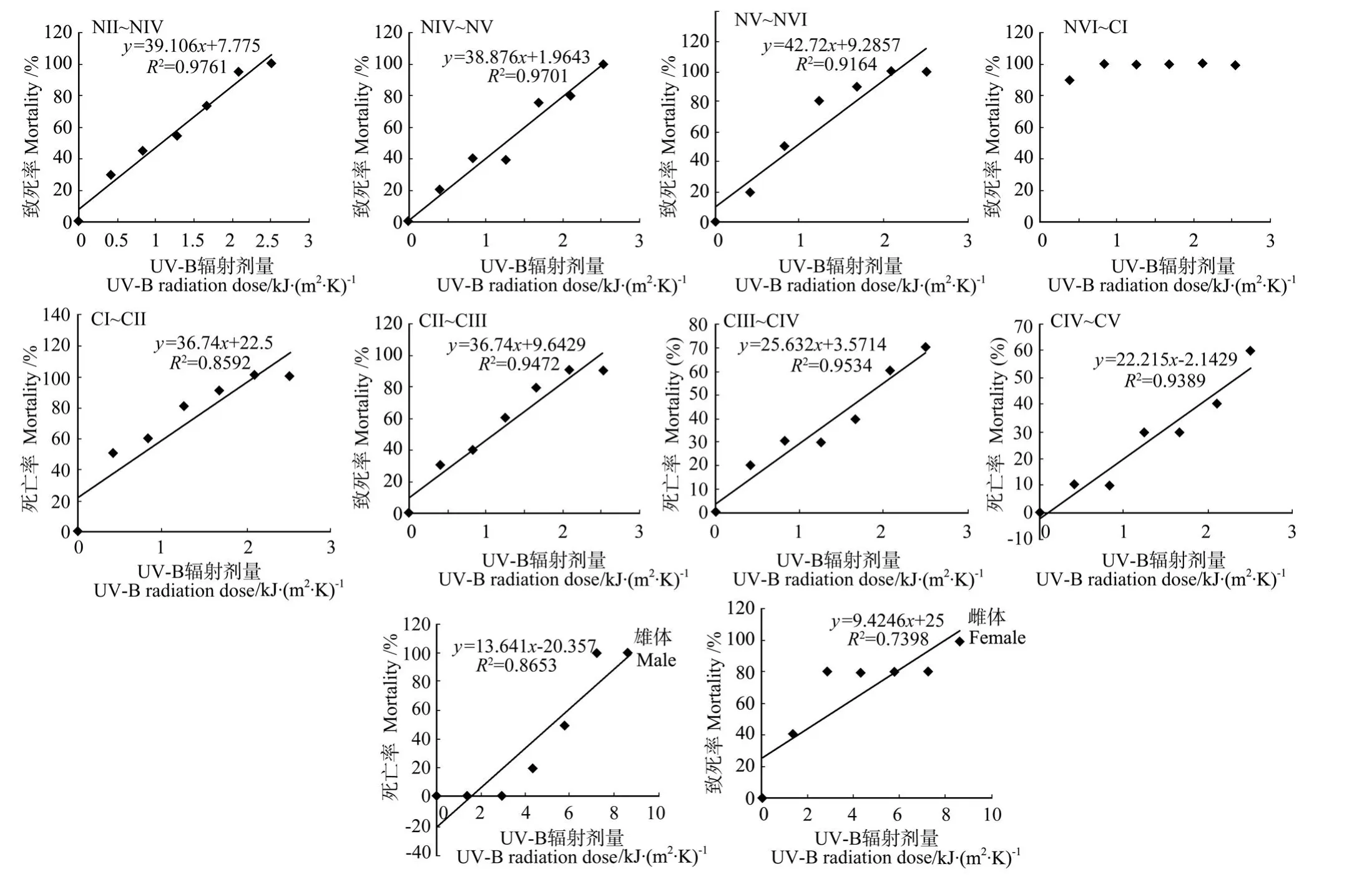
图2 UV-B辐射对太平洋真宽水蚤的无节幼体、桡足幼体、成体致死率的影响Fig.2 Effects of UV-B radiation on the mortality of nauplii,copepodite and adult ofE.pacif ica

表2 太平洋真宽水蚤的无节幼体、桡足幼体、成体的24 h·LD50Table 2 24 h·LD50of nauplii,copepodite and adults ofE.pacif ica/kJ·(m2·K)-1
2.2 太平洋真宽水蚤对UV-B辐射的敏感性
由表2和图2可知,太平洋真宽水蚤的各个发育过程对UV-B辐射增强的敏感性变化类似于指状许水蚤。(1)太平洋真宽水蚤的无节幼体的24 h·LD50总体上小于桡足幼体的24 h·LD50,而桡足幼体的24 h· LD50又小于成体24 h·LD50,因此总体上来说,太平洋真宽水蚤3个发育阶段对UV-B辐射增强的敏感性由大到小依次排序为无节幼体>桡足幼体>成体;
(2)在无节幼体的发育阶段,NⅤ~NⅥ阶段的24 h· LD50较小,表现出对UV-B辐射增强的较高敏感性,按敏感性由大到小的顺序依次为NⅤ~NⅥ>NⅢ~NⅣ>NⅣ~NⅤ;在桡足幼体的发育阶段,24 h·LD50则随着龄期的增加呈现出逐渐增大趋势,敏感性由大到小依次为CⅠ~CⅡ>CⅡ~CⅢ>CⅢ~CⅣ>CⅣ~CⅤ,CⅠ~CⅡ发育阶段最敏感;
(3)成体中雌体比雄体的24 h·LD50大,所以成熟雄体比成熟雌体敏感;
(4)纵观整个发育过程,从无节幼体到桡足幼体的过渡发育阶段(NⅥ~CⅠ)的24 h·LD50最小,所以无节幼体NⅥ和桡足幼体CⅠ时期对UV-B辐射增强最敏感,而雌性成体的抗性最大。
2.3 指状许水蚤和太平洋真宽水蚤对UV-B辐射敏感性的比较
比较表1和2不难发现,太平洋真宽水蚤和指状许水蚤对UV-B辐射增强的敏感性存有差异。首先,在整个发育过程中,无论是无节幼体和桡足幼体阶段,还是成体阶段,太平洋真宽水蚤都比指状许水蚤的敏感性高。其次,太平洋真宽水蚤对UV-B辐射增强最敏感的时期是无节幼体NⅥ和桡足幼体CⅠ,发生在从无节幼体到桡足幼体的过渡阶段,而指状许水蚤对UV-B辐射增强最敏感性时期为无节幼体的NⅣ和NⅤ。
3 讨论
桡足类在从受精卵到成体的发育过程中须经过以下3个敏感时期:
(1)从受精卵发育至无节幼体;
(2)从无节幼体Ⅲ期变态为Ⅳ期(开始摄食);
(3)从无节幼体Ⅵ期变态为桡足幼体Ⅰ期。这3个发育时期对环境变化较为敏感,且由于环境的变化较易引起死亡。如果能够正确掌握这些敏感期,那么,对桡足类的人工培养将有很大帮助。
UV-B辐射增强对海洋桡足类无节幼体、桡足类幼体、成体的致死作用及海洋桡足类无节幼体、桡足类幼体、成体对UV-B辐射的敏感性比较研究已有陆续报道。Karanas[13]研究了克氏纺锤水蚤(Acartia clausii)的无节幼体、桡足类幼体和成体对UV-B辐射的敏感性差异,指出NⅤ-NⅥ期由于是由无节幼体向桡足幼体转型的最后一个形态过渡期,所以对UV-B辐射最敏感,而Vega and Pizarro[14]认为,在整个生活史中,Ⅳ期的桡足幼体对UV-B辐射增强最为敏感。本研究同样证实,与桡足类成体比较,无节幼体、桡足幼体对UV-B辐射增强更敏感。而且在太平洋真宽水蚤的各个发育阶段中,NⅥ~CⅠ阶段处于由无节幼体向桡足幼体转型期,也是对UV-B辐射增强最敏感的发育时期,这与Karanas[13]的研究结果完全一致。指状许水蚤对UV-B辐射增强最敏感性时期为无节幼体的NⅣ~NⅤ,这与Vega and Pizarro[14]相类似。
本研究的结果还表明,无节幼体对UV-B辐射增强比桡足类幼体更敏感,推测其原因可能是无节幼体的体长比桡足类幼体的体长短,体重也相应的小,所以对UV-B辐射的抗性低。其次,由于无节幼体只具有附肢,还不具备游泳足,而桡足类幼体已经开始有游泳足,比无节幼体的活动能力强,活动范围相对大,致使桡足类幼体可以通过游动避开UV-B辐射,以减少UV-B辐射的伤害。另外,无节幼体和桡足类幼体对UV-B辐射增强比成体又更加敏感,这可能是因为无节幼体和桡足类幼体的体长和体重都明显小于成体,所以对UV-B辐射增强抗性相应降低,同时与无节幼体和桡足类幼体相比,成体的游泳足已经发育齐备,活动范围较大,对UV-B辐射具有更强的躲避行为。Wiebke J. Boeing等人的研究就指出UV-B辐射对桡足类和其他浮游动物的影响随着水深的增加而减弱[15]。
指状许水蚤与太平洋真宽水蚤对UV-B辐射增强的敏感性存在明显的差异,说明海洋桡足类对UV-B辐射增强的敏感性具种的差异性[16-18]。指状许水蚤是伪镖水蚤科(Family Pseudodiaptomidae),许水蚤属(GenusSchmackeria),该种采用将卵囊悬挂于生殖孔上的抱卵方式,对环境适应能力比较强,适温范围和适盐范围比较广,对逆境的抗性比较强,所以对UV-B辐射增强的抗性也比较强;太平洋真宽水蚤是哲水蚤目(Order Calanoida),宽水蚤科(Family Temoridae),真宽水蚤属(GenusEurytemoraGiesbrecht,1881),该种将卵直接排于水中,易受环境因子的影响,同时在实验室培养过程中发现,培养温度和盐度的突然变化,也会造成部分太平洋真宽水蚤的死亡,表明其对逆境的抗性比较弱,对UV-B辐射较为敏感。
[1] Teramura A H,Murali N S.Intraspeciflc difference is growth and yield of soybean exposed to UV-B radiation under greenhouse and field conditions[J].Environ Experi Bot,1986,26(1):89.
[2] Hardy J,Gucinski H.Stratospheric ozone depletion:implications for marine ecosystems[J].Oceanography,1989,36(3):18-21.
[3] Ryan K G.UV radiation and photosynthetic production in Antarctic sea ice microalgae[J].Photochem Photobiol,1993,40:235-240.
[4] Bouchcr N P,Prezelin B B.Spectral modeling of UV inhibition of in Situ Antarctic primary production using a field-derived biological weighting function[J].Photochem Photobiol,1996,63:407-418
[5] Smith R C,Prezelin B B,Baker K S,et al.Ozone depletion: Uhraviolet radiation and phytoplankton biology in Antarctic water [J].Science,1992,225:952-959.
[6] Roux R.Effects of reduced UV radiation on a microbenthic community during a microcosm experiment[J].Marine Ecology Progress Series,2002,225:29-43.
[7] 张富存,何雨红,郑有飞,等.UV-B辐射增加对小麦的影响[J].南京气象学院学报,2003,26(4):545-551.
[8] 李山,王艳,王小菁,等.UV-B诱导的水稻DNA损伤和修复研究[J].光子学报,2000,29(7):595-598.
[9] 于娟,唐学玺,田继远.UV-B辐射对3种海洋微藻的种问竞争性平衡的影响[J].中国海洋大学学报:自然科学版,2005,35(1): 108-112.
[10] 蔡恒江,唐学玺,张培玉.UV-B辐射和久效磷对三角褐指藻DNA共同伤害效应[J].中国海洋大学学报:自然科学版, 2004,34(6):993-996.
[11] 徐达,唐学玺,张培玉.UV-B辐射对2种海洋微藻的生理效应[J].青岛海洋大学学报,2003,33(2):240-244.
[12] 周永欣,章宗涉.水生生物毒性实验方法[M],北京:农业出版社,1987:85-90.
[13] Karanas J J,Dyke H V,Worrest R C.Midultraviolet(UV-B) sensitivity ofAcartia clausiiGiesbrecht(Copepoda)[J].Limnol Oceanogr,1979,24(6):1104-1116.
[14] Vega M P,Pizarro R.Lethal effect induced by ultraviolet-B in a planktonic copepod:role of the post-irradiation time on mortality measurements[J].Journal of Freshwater Ecology,2000,15(1):1-5.
[15] Wiebke J Boeing,Dina M Leech,Craig E,et al.Damaging UV radiation and invertebrate predation:conflicting selective pressures for zooplankton vertical distribution in the water column of low DoClake[J].Oecolngia,2004,138:603-612.
[16] Horacio E Z,Margarita Feldman,Craig E W.UV-B-induced damage and photoreactivation in three species ofBoeckella(Copepoda,Calanoida)[J].J Plankton Res,1997,19(3):357-367.
[17] Speekmann C L,Bollens S M,Avent S R.The effect of ultraviolet radiation on the vertical distribution and mortality of estuarine zooplankton[J].Journal of Plankton Research,2000,22(12): 2325-2350.
[18] Wuebben D L,Vareschi E,Hawes I,et al.Differential UVB-sensitivities of five New Zealand freshwater zooplankton species [J].N ZJ Mar Freshwat Res,2001,35(3):635-645.
Abstract: The sensitivities of two species of marine copepods(Schmackeria inopinusBurckhardt,1913 andEurytemora pacif icaSato,1913)to UV-B radiation enhancement were studied under controlled experimental conditions.(1)The comparative results among the different developmental stages showed that:nauplii and copepodites were more sensitive than their adults,and the order of the sensitivity to UVB radiation enhancement was:nauplii>copepodites>adult.Moreover,the male adults were more sensitive than the females one.(2)The comparative results between different species of copepods showed that: theE.pacif icawas more sensitive thanS.inopinusto UV-B radiation enhancement in almost every developmental stage,and naupliusⅥand copepoditeⅠofE.pacif icaand naupliusⅣandⅤofS.inopinuswere the most sensitive stages to UV-B radiation enhancement.
Key words: UV-B radiation enhancement;sensitivity;Schmackeria inopinusBurckhardt;Eurytemora pacif icaSato
责任编辑 于 卫
The Comparative Studies on Sensitivity of Schmackeria inopinus Burckhardt and Eurytemora pacifica Sato to UV-B Radiation Enhancement
TAN Hai-Li1,SUN Guang-Lian2,YU Juan1,TANG Xue-Xi1
(1.Laboratory of Ecology,College of Marine Life Sciences,Ocean University of China,Qingdao 266003,China;2.Insititute of Basic Medical Science,Shandong Academy of Medical Science,Jinan 250062,China)
X171.5
A
1672-5174(2010)09Ⅱ-117-05
国家自然科学基金项目(30270258);教育部新世纪优秀人才支持计划项目(NCET-05-0597)资助
2008-01-23;
2008-03-11
谭海丽(1982-),女,硕士生。
E-mail:tangxx@ouc.edu.cn
