营养盐浓度变动对菊花江蓠和细基江蓠繁枝变型生长、生化组成及生理的影响研究
2010-09-13蒋雯雯田相利董双林王青林
蒋雯雯,田相利,董双林,王青林,李 英
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
营养盐浓度变动对菊花江蓠和细基江蓠繁枝变型生长、生化组成及生理的影响研究
蒋雯雯,田相利**,董双林,王青林,李 英
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
在实验室条件下,对比研究了营养盐浓度变化对菊花江蓠(Gracilaria lichenoides)和细基江蓠繁枝变型(G.tenuistipitatavar.liui)的生长、生化组成和生理的影响。结果表明,不同的营养盐浓度变动对2种江蓠的生长、藻体藻红素、叶绿素a、总碳、总氮含量、硝酸还原酶以及过氧化氢酶活性影响有所不同。菊花江蓠生长在中等浓度(45μmol/L)的营养盐条件下最佳,而细基江蓠繁枝变型的生长反应则依前期环境中营养盐水平不同而有所差异。总体上看,当营养盐浓度由3μmol/L变动为45和150μmol/L时,2种江蓠藻体藻红素、叶绿素a、总碳和总氮含量以及硝酸还原酶的活性均有所提高;而当营养盐浓度由45和150μmol/L变动为3μmol/L时,2种江蓠藻体的上述指标则有所下降。营养盐浓度45和150μmol/L的相互变动对2种江蓠硝酸还原酶的活性影响不大。随着无机氮浓度的逐渐增加,过氧化氢酶的活性呈现显著下降的趋势。当营养盐浓度由3μmol/L向150μmol/L变动时,2种江蓠过氧化氢酶活性显著下降;而营养盐浓度由150μmol/L向3μmol/L变动时,过氧化氢酶活性则有所增强。综合比较表明,细基江蓠繁枝变型更容易受环境中营养盐浓度变动的影响,对环境中营养盐浓度变动的适应能力可能要低于菊花江蓠。
菊花江蓠;细基江蓠繁枝变型;营养盐变动;生长;生理;生化组成
近年来,随着我国水产养殖业的迅猛发展,由于养殖对象排泄物的腐化分解以及残饵积累导致的养殖水域污染日趋严重。针对此种现状,许多学者通过实验一致认为,解决养殖水体富营养化较有效的途径就是在养殖水域混养大型海藻[1-2]。大型海藻在与养殖动物进行混养时,既可以吸收水体中的N、P,缓解由于养殖对象排泄物分解以及饵料残余而给水体带来的污染,也可以释放出O2,提高水体的溶解氧水平,促进养殖对象的生长。此外,由于大型海藻对微藻还具有一定的抑制作用,因此对于养殖水体内微藻的含量也能起到一定的调控作用[3]。在众多的海藻群体中,江蓠以其适应广、生长快、营养储存库大等特点受到很多学者的关注,被广泛混养于鱼、虾、贝类等不同种类的养殖系统中[4-6]。
目前国内外关于环境因子对江蓠生长及营养盐吸收的影响已有较多研究。如刘静雯等在对细基江蓠繁枝变型(Gracilaria tenuistipitatavar.liui)的研究中发现,光照和温度均对其生长有显著影响,其最适生长温度在25℃左右[7]。吴超元等研究发现,细基江蓠繁枝变型生长的适宜盐度在21左右;无机氮营养盐的浓度在4μmol/L左右,即可维持较快的生长率[8]。对于不同环境因子对江蓠N、P吸收速率的影响,许多学者也做了较深入的研究[9-10]。然而,在自然海域中,海水的温度、盐度、光照强度、p H值以及营养盐浓度等环境因子都是呈现动态变化的[11],而这种动态变化的环境因子对江蓠的生长及营养盐吸收的影响,至今还鲜有报道。
我国处在太平洋西岸,有丰富的江蓠资源,已鉴定清楚的约30多种[12-13]。其中,菊花江蓠(G.lichenoides)和细基江蓠繁枝变型是我国经济价值较高、栽培比较广泛的2种海藻,二者均隶属于红藻门(Rhodophyta)、真红藻纲(Florideae)、杉藻目(Gigartinales)、江蓠科(Gracilaraceae)、江蓠属(Gracilariae)。本研究在实验室条件下,以菊花江蓠和细基江蓠繁枝变型为实验材料,通过设置不同营养盐浓度变动方式,探讨了不同形式营养盐浓度的变化对2种江蓠的生长、生理和生化组成的影响,以期通过研究,为2种江蓠栽培的营养环境调控及其资源利用提供有益的参数,并为不同水质特点的养殖水域植物修复中江蓠种类的选择提供参考。
1 材料与方法
1.1 实验材料
实验用菊花江蓠和细基江蓠繁枝变型均取自厦门市不同海水养殖池塘,选择健康藻体,除去表面附着物,最后用大量消毒海水冲洗后,放在室内水族箱扩大培养,海水经煮沸消毒后依照f/2培养液配方添加除氮、磷以外的微量营养元素。实验海水总无机氮和磷浓度分别为1.3和0.2μmol/L。每隔2 d更换海水1次,每天定时搅水8次;在实验开始前1周,选取藻体同一部位,把藻体分成0.1~0.5 g大小后暂养备用。
2种江蓠的培养条件为温度(25±1)℃、光照强度120μmol/m-2·s、光周期14L∶10D、p H=8.0。盐度设置则根据二者的盐度适应特性,分别设置为其生长最适盐度,即菊花江蓠为盐度30,细基江蓠繁枝变型为盐度20[8,14],其中盐度20以海水用蒸馏水进行稀释的方法获得。
1.2 实验设计
实验分别设置了6个营养盐浓度变动组和3个营养盐浓度恒定的对照组。其中,6个营养盐变动组分别为无机氮浓度从3μmol/L变动到45和150μmol/L、45μmol/L变动到3和150μmol/L以及150μmol/L变动到3和45μmol/L,相应的对照组无机氮浓度分别为3、45和150μmol/L(NO-3-N∶NH+4-N=1∶1),氮磷比均为15∶1,各组氮、磷以外的其它营养盐成分采用f/2配方补充。其它实验条件同扩大培养条件。每组设5个重复,采用250 mL烧杯(200 mL培养液),每次实验均选取同一部位的藻体做实验材料,每个烧杯中加入相同部位的江蓠(0.5±0.01)g,每天更换培养液并定时摇动培养瓶8次。
1.3 实验操作和指标测定
实验开始后,先将菊花江蓠和细基江蓠繁枝变型分为低氮(总无机氮浓度为3μmol/L)、中氮(总无机氮浓度为45μmol/L)和高氮(总无机氮浓度为150 μmol/L)3组,并分别在总无机氮浓度为3、45和150 μmol/L的条件下培养10 d,10 d后测定各处理组江蓠的特定生长率SGR,并从中选取(0.5±0.01)g进行营养盐变动实验,剩余的江蓠用于测定藻红素、叶绿素含量,藻体中总碳、总氮所占比例,硝酸还原酶和过氧化氢酶的活性。进行营养盐变动后的江蓠再培养10 d,实验结束后再次测定其特定生长率、叶绿素、藻红素含量,藻体中总碳、总氮所占比例,以及硝酸还原酶和过氧化氢酶的活性。
1.4 测定方法
1.4.1 藻体湿质量特定生长率 以下式计算江蓠的特定生长率:
SGR=(lnWt-lnWo)/t×100%
式中,Wo为初始藻的鲜质量(g),Wt为实验结束时藻的鲜质量(g),t为实验持续的天数。
1.4.2 藻红素含量 藻体样品用消毒海水快速冲洗,吸干水分,取0.1 g藻体(鲜质量),加0.1 mol· L-1的磷酸缓冲液(p H=6.5),用玻璃研磨棒在冰浴上匀浆,定容至6 mL。粗提液用台式离心机4℃、4 000 r/min离心20 min,上清液以磷酸缓冲液为对照,在分光光度计上测定565 nm的光密度,沉淀用于叶绿素a的分析。藻红素含量(PE)用下列公式[15]计算:
PE=12.4A565×Ve/(I×W×1 000)
式中,PE为藻红素的浓度(mg/g),12.4是藻红素吸收系数的倒数(mg/L),A565是样品在565 nm处的光密度值,Ve是萃取液的体积(6 mL),I是比色皿的光径(cm),W是样品的鲜质量(g)。
1.4.3 叶绿素a含量 参照Moran等[16]方法,在上述沉淀物中加入N,N-二甲基甲酰胺(DMF)并定容至6 mL,于4℃萃取24 h,然后用台式离心机4℃、4 000 r/min离心10 min,以DMF为对照在分光光度计上分别测定625,647,664和750 nm处的光密度值,其中750 nm处的光密度值是用于校正其他物质的吸收值。叶绿素a含量(Chla)用下列公式进行计算:
Chla=(12.65A664-2.99A647-0.04A625)×Ve/(I ×W×1 000)
式中,Chla为叶绿素a的浓度(mg/g),A664、A647、A625分别是样品在625、647和664 nm处的光密度值, Ve是萃取液的体积(6 mL),I是比色皿的光径(cm), W是样品的鲜质量(g)。
1.4.4 总碳和总氮含量 藻体样品用消毒海水快速冲洗,吸干水分,然后置于65℃烘箱中进行烘干,用Vario EL III型元素分析仪测定藻体中总碳和总氮的含量。
1.4.5 藻体硝酸还原酶和过氧化氢酶的活力 硝酸还原酶的活力采用离体法进行测定,具体方法参见张志良等[17]。过氧化氢酶的活力使用南京建成试剂公司过氧化氢酶检测试剂盒进行检测。
1.5 数据处理与分析
所得数据用统计软件SPSS13.0进行分析,不同处理组间使用单因素方差分析和Duncan多重比较进行分析,以P<0.05作为差异显著性水平。
2 结果
2.1 不同营养盐变动培养条件下2种江蓠的生长情况
各处理江蓠的特定生长率情况如图1所示。细基江蓠繁枝变型在由扩大培养转入N浓度3,45和150 μmol/L后的前10 d,显示了较高的生长率,显著高于后10 d的生长速率(P<0.05);菊花江蓠前10 d的生长与后10 d相比,则在N浓度为45和150μmol/L时显示了较好的生长(P<0.05)。两者相比,细基江蓠繁枝变型前期的特定生长率略大于菊花江蓠。
在营养盐浓度进行变动之后,细基江蓠繁枝变型的特定生长率显著下降(P<0.05)。在6个营养盐变动处理中,N浓度由3~45μmol/L变动组和150~3 μmol/L变动组的特定生长率显著高于其他处理组(P <0.05)。菊花江蓠的特定生长率虽也有所下降,但其3~45μmol/L变动组与前10d的实验相比,其特定生长率有显著地上升(P<0.05);45μmol/L恒定处理组和150~45μmol/L变动组的特定生长率也显著高于其他处理组(P<0.05)。其中,菊花江蓠的特定生长率要高于细基江蓠繁枝变型。

图1 营养盐浓度变动对2种江蓠特定生长率的影响Fig.1 Effects of nutrient concentration changes on SGR of two species ofGracilariae
2.2 不同营养盐变动培养条件下2种江蓠的藻红素含量
各处理江蓠的藻红素含量如图2所示。在前10 d的实验中,细基江蓠繁枝变型藻红素的含量随营养盐浓度的增大而增大,其中3和45μmol/L处理组的差异不显著(P>0.05);菊花江蓠藻红素的含量也随营养盐浓度的增大而增大,其中3μmol/L与150μmol/L处理组的差异显著(P<0.05);细基江蓠繁枝变型藻红素的含量略高于菊花江蓠。
在营养盐浓度进行变动后,细基江蓠繁枝变型的3~45μmol/L变动组、45μmol/L恒定组和150μmol/ L恒定组这3个处理组的藻红素含量显著高于其对应处理组(P<0.05),其中45μmol/L恒定组与45~150 μmol/L变动组之间藻红素含量差异不显著(P> 0.05)。菊花江蓠的3~150μmol/L变动组、45~150 μmol/L变动组和150μmol/L恒定组这3个处理组的藻红素含量显著高于其对应处理组(P<0.05),其中150~45μmol/L变动组和150μmol/L恒定组之间藻红素含量差异不显著(P>0.05)。

图2 营养盐浓度变动对2种江蓠藻红素含量的影响Fig.2 Effects of nutrient concentration changes on the content of PE of two species ofGracilariae
2.3 不同营养盐变动培养条件下2种江蓠的叶绿素a含量
各处理江蓠的叶绿素a含量如图3所示,在前10 d的实验中,营养盐浓度为45μmol/L时,细基江蓠繁枝变型叶绿素的含量最高,与其他2个处理差异显著(P <0.05);菊花江蓠的叶绿素含量与细基江蓠繁枝变型的变化一致,也是在营养盐浓度为45μmol/L时含量最高,并与其他2个处理差异显著(P<0.05),但其各处理组的叶绿素含量低于细基江蓠繁枝变型。
在营养盐浓度进行变动后,细基江蓠繁枝变型的3~150μmol/L变动组、45~150μmol/L变动组和150~45μmol/L变动组这3个处理组的叶绿素含量显著高于其对应处理组(P<0.05)。菊花江蓠的3~45 μmol/L变动组和45~150μmol/L变动组这2个处理组的叶绿素含量显著高于其对应处理组,而150~3 μmol/L变动组、150~45μmol/L变动组和150μmol/ L恒定组这3个处理组之间叶绿素的含量无显著差异(P>0.05)。在营养盐浓度进行变动之后,细基江蓠繁枝变型的叶绿素含量仍大于菊花江蓠。
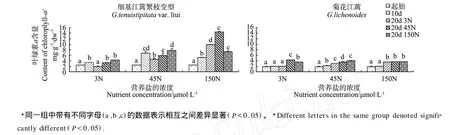
图3 营养盐浓度变动对2种江蓠叶绿素a含量的影响Fig.3 Effects of nutrient concentration changes on the content of chlorophyll-aof two species ofGracilariae
2.4 不同营养盐变动培养条件下2种江蓠的总碳含量
各处理江蓠藻体的总碳含量如图5所示。在前10 d的实验中,细基江蓠繁枝变型中总碳的含量以45 μmol/L处理组最高,并与其他2个处理组有显著差异(P<0.05);而菊花江蓠则以150μmol/L处理组的总碳含量最高,并与其他2个处理组有显著差异(P< 0.05)。
在营养盐浓度进行变动后,细基江蓠繁枝变型的45μmol/L恒定处理组和150~45μmol/L变动组这2个处理组的总碳含量显著高于其对应处理组(P< 0.05),而3~45μmol/L变动组和3~150μmol/L变动组这2个处理组间总碳的含量无显著差异(P> 0.05)。菊花江蓠的3~150μmol/L变动组、45~150 μmol/L变动组和150~3μmol/L变动组这3个处理组间总碳的含量显著高于其对应处理组(P<0.05),并且在营养盐浓度进行变动之后,菊花江蓠的总碳含量略大于细基江蓠繁枝变型。

图4 营养盐浓度变动对2种江蓠总碳含量的影响Fig.4 Effects of nutrient concentration changes on total carbon of two species ofGracilariae
2.5 不同营养盐变动培养条件下2种江蓠的总氮含量
各处理江蓠的总氮含量如图5所示。在前10 d的实验中,细基江蓠繁枝变型总氮的含量随营养盐浓度的升高而增大,各处理组间有显著差异(P<0.05);而菊花江蓠则以45μmol/L处理组总氮的含量最高并与其他处理组有显著差异(P<0.05)。
在营养盐浓度进行变动后,细基江蓠繁枝变型的3~150μmol/L变动组、45~150μmol/L变动组和150 μmol/L恒定处理组总氮含量最高并与其他对应组有显著差异(P<0.05)。菊花江蓠的3~150μmol/L变动组处理组与其对应组有显著差异(P<0.05),而45 μmol/L恒定组与45~150μmol/L变动组、150μmol/ L恒定组与150~45μmol/L变动组之间其总氮含量均无显著差异(P>0.05)。

图5 营养盐浓度变动对2种江蓠总氮含量的影响Fig.5 Effects of nutrient concentration changes on total nitrogen of two species ofGracilariae
2.6 不同营养盐变动培养条件下2种江蓠的硝酸还原酶活性
各处理江蓠的硝酸还原酶活性的变动情况如图6所示。在前10 d的实验中,细基江蓠繁枝变型硝酸还原酶的活性随营养盐浓度的升高而增强,各处理组之间有显著差异(P<0.05);菊花江蓠以45μmol/L处理组硝酸还原酶活性最强并与其他处理组有显著差异(P <0.05)。
在营养盐浓度进行变动后,细基江蓠繁枝变型各处理组硝酸还原酶活性较前10 d实验均有显著减弱(P<0.05),3~150μmol/L变动组、45μmol/L恒定组和150~3μmol/L变动组处理组硝酸还原酶活性略高于其对应组,但3~45μmol/L变动组与3~150 μmol/L变动组之间无显著差异(P>0.05),45μmol/ L恒定组与45~150μmol/L变动组之间无显著差异(P>0.05),150μmol/L恒定组、150~3μmol/L变动组与150~45μmol/L变动组之间均无显著差异(P> 0.05)。菊花江蓠各处理组硝酸还原酶活性较前10 d实验也均有显著减弱(P<0.05),其中45μmol/L恒定组与45~150μmol/L变动组、150μmol/L恒定组与150~45μmol/L变动组之间其硝酸还原酶活性无显著差异(P>0.05)。

图6 营养盐浓度变动对2种江蓠硝酸还原酶活性的影响Fig.6 Effects of nutrient concentration changes on NR activities of two species ofGracilariae
2.7 不同营养盐变动培养条件下2种江蓠的过氧化氢酶活性
各处理江蓠的过氧化氢酶活性的变动情况如图8所示。在前10 d的实验中,细基江蓠繁枝变型过氧化氢酶的活性随营养盐浓度的增大而逐渐降低,各处理组之间差异(P<0.05);菊花江蓠过氧化氢酶活性的变化趋势与细基江蓠繁枝变型的变化趋势一致,随营养盐浓度的增大而逐渐降低,各处理组之间差异(P< 0.05)。
在营养盐浓度进行变动后,细基江蓠繁枝变型的3 μmol/L恒定组过氧化氢酶活性显著高于其对应组(P <0.05),45~3μmol/L变动组过氧化氢酶活性虽较高但与45μmol/L恒定组间无显著差异(P>0.05),同样过氧化氢酶具有较高活性的150~45μmol/L变动组处理组和150~3μmol/L变动组间也无显著差异(P> 0.05)。菊花江蓠3~45μmol/L变动组、45~3μmol/L变动组和150μmol/L恒定组过氧化氢酶活性较高一些,其中3~45μmol/L变动组与3~150μmol/L变动组间有显著差异(P<0.05),45~3μmol/L变动组与45~150 μmol/L变动组间有显著差异(P<0.05),150μmol/L恒定组150~3μmol/L变动组与150~45μmol/L变动组间无显著性差异(P>0.05)。

图7 营养盐浓度变动对2种江蓠过氧化氢酶活性的影响Fig.7 Effects of nutrient concentration changes on CAT activities of two species ofGracilariae
3 讨论
3.1 营养盐浓度变动对2种江蓠生长的影响
在自然条件下,海水的温度、盐度、p H及营养盐浓度均是动态变化的[11]。现有研究发现,海水温度和盐度的波动对藻类的生长具有重要的影响[18-19]。本研究结果表明,营养盐不同程度的变动显著影响江蓠的生长,并且不同种类的江蓠对营养盐变动的生长上的反应也有所不同。在从扩大培养的低营养盐浓度(总无机氮1.3μmol/L)介质转入相对高的营养盐介质(总无机氮3~150μmol/L)初期(前10 d),细基江蓠繁枝变型生长显著加快,但随着时间的延长以及营养盐浓度的进一步变动,其生长速度则显著下降。相比之下,菊花江蓠生长率尽管也有不同程度下降,但下降幅度则要远小于细基江蓠繁枝变型。总体上看,中等浓度(总无机氮45μmol/L)的营养盐条件最有利于江蓠的生长,过高的营养盐水平(总无机氮150μmol/L)则对江蓠的生长具有抑制作用。这与黄鹤忠等人的研究结果相似[20]。但前期的环境中营养盐水平显著影响江蓠对后期营养盐变动的生长反应。可以看出,不论营养盐浓度如何变化,菊花江蓠生长均在中等浓度的营养盐条件下最好。而细基江蓠繁枝变型的生长反应则有所差异。经过低营养盐水平前期培养的江蓠,在中等浓度的营养盐下生长最好,而经过高营养盐水平前期培养的江蓠,则在低浓度的营养盐下生长最快。但经过中营养盐水平前期培养的江蓠,其后期的生长几乎不再受营养盐变动的影响。这些结果表明,细基江蓠繁枝变型的生长更容易受环境中营养盐浓度的影响,其生长对营养盐变动的适应能力可能要低于菊花江蓠。
3.2 营养盐浓度变动对2种江蓠的生化组成的影响
关于水体营养盐的浓度及配比对藻类的生理生化组成的影响目前已有很多研究[20-21],Kursar等指出,光合辅助色素——藻红蛋白对外界的营养变化最为敏感,藻红蛋白的含量与水体中可利用氮源的浓度间有密切的关系[22],而藻体内叶绿素a含量与环境中的N浓度关系则不是很密切[23]。本研究则发现,2种江蓠藻红素含量与营养盐变化总体上相关密切。当营养盐浓度由3向45、150μmol/L变动时,2种江蓠的藻红素的含量都会有所增加;而将江蓠由营养盐为45和150 μmol/L变动为3μmol/L时,则导致江蓠体内藻红素减少。但受前期培养历史及种类差异的影响,2种江蓠叶绿素a的含量对营养盐变动的响应则有所不同。细基江蓠繁枝变型经3和45μmol/L无机氮浓度培养以及菊花江蓠经45μmol/L无机氮浓度培养后,其体内叶绿素a与外界营养盐变动关系非常密切,这一点与徐永健等的研究有所不同[23]。可以看出,江蓠色素含量与环境中可利用的氮源浓度有密切关系,当环境中可利用氮源浓度较高时,江蓠体内色素会较高,当环境中氮源浓度较低时,色素则会作为一种功能性储存氮被用来合成其他蛋白质,导致藻体内色素含量降低。
测定藻体内总碳和总氮的含量,可以揭示藻体的氮营养状态。Lohman等认为测定藻体内总有机碳和有机氮的含量是确定其处于何种营养盐状态的最准确的方法[24]。总体上看,江蓠在营养盐浓度为3μmol/L条件下进行培养时,江蓠基本处于营养盐限制的条件下,使得藻体内总碳和总氮的含量都不是很高。当将在营养盐浓度为3μmol/L条件下培养的江蓠转移到营养盐浓度分别为45和150μmol/L中进行培养时,曾受到营养盐胁迫的江蓠对营养盐会有1个补偿性吸收,从而引起藻体内各组分含量会随之有所增加。而在营养盐浓度为45和150μmol/L条件下进行培养的江蓠,由于营养盐充足,所以使其各组分含量都在1个较高的水平,当将其转移到3μmol/L中进行培养时,较低的营养盐浓度对江蓠造成营养盐胁迫,江蓠需要通过分解藻体内储存的氮来维持其正常生长,因此就导致藻体内总氮和总碳的含量有所减少。不过,相比较而言,藻体内总氮的含量是比总碳更能反映江蓠的营养状态的指标。2种江蓠比较,细基江蓠繁枝变型藻体内总氮含量对外界营养盐变化响应更为敏感,总碳含量则随营养盐变动变化不大。
3.3 营养盐浓度变动对2种江蓠硝酸还原酶和过氧化氢酶活性的影响
硝酸还原酶是藻类氮代谢的关键酶,在藻类将海水中的硝酸盐还原成它可以吸收利用的铵盐的反应中,硝酸还原酶是整个过程的限速酶[25],硝酸还原酶的活性对于海藻的氮代谢具有重要意义[26]。研究表明,硝酸还原酶是1种底物诱导酶,底物硝酸根(NO-3)的存在可以诱导硝酸还原酶的产生,从而进一步使其活性得到提高[27]。而徐智广等人的研究表明,将坛紫菜进行氮饥饿到氮加富处理时,坛紫菜的硝酸还原酶活性是先增大,后逐渐降低至稳定水平[28]。在本研究中,当将2种江蓠由营养盐浓度为3μmol/L条件变动为45和150μmol/L时,2种江蓠硝酸还原酶的活性随之有所提高,而将2种江蓠由营养盐浓度为45和150 μmol/L变动为3μmol/L时,2种江蓠硝酸还原酶的活性随之则有所下降,这一结果与徐智广等人的研究结果相似[28]。不过,营养盐浓度45和150μmol/L的相互变动对2种江蓠硝酸还原酶的活性影响不大。这一结果表明,营养盐中适当水平的硝酸根浓度对2种江蓠体内硝酸还原酶诱导具有促进作用,从而使其活性得到显著提高,而过高的硝酸根浓度则对硝酸还原酶的活性具有明显的抑制作用。另外,从本研究结果看,2种江蓠体内硝酸还原酶的活性的变动与江蓠的生长总体上表现出一定的相关性,即在低的营养盐水平下(3μmol/L),2种江蓠的生长速率较低,硝酸还原酶的活性也处于较低水平,而过高的营养盐水平(45 μmol/L)对江蓠的生长与硝酸还原酶的活性也均表现出一定的抑制作用。
过氧化氢酶是植物细胞内保护酶系统中重要的酶[29-30],它是酶蛋白与4个高铁血红素辅基相结合的色素蛋白,用以催化有机体组织中生物氧化所产生的过氧化氢,解除其对有机体组织的毒害,因此对于植物体具有重要的生理意义。在本研究发现,随着营养盐浓度的逐渐增加,过氧化氢酶的活性呈现显著下降的趋势,这一结果与孙菊燕的研究结果相似[31]。同时,当营养盐浓度由3μmol/L向150μmol/L变动时,2种江蓠过氧化氢酶的活性显著下降;而营养盐浓度由150 μmol/L向3μmol/L变动时,2种江蓠过氧化氢酶的活性则随之增强。本研究结果说明,过高的营养盐浓度对过氧化氢酶活性具有一定的抑制作用,可能对2种江蓠的正常生理过程产生了一定负面影响。
4 结论
水体环境中营养盐水平及其变动显著影响2种的生长。其中,菊花江蓠生长相对稳定,且在中等浓度(45μmol/L)的营养盐条件下生长最佳,而细基江蓠繁枝变型的生长反应则受前期环境中营养盐水平影响而有所不同。对比2种江蓠生长、生化组成以及相关酶活性随营养盐水平的变动情况可以看出,细基江蓠繁枝变型更容易受环境中营养盐浓度变动的影响,对环境中营养盐浓度变动的适应能力可能要低于菊花江蓠。因此,在将江蓠应用于水产养殖环境修复中时,除了要考虑其各自的温度和盐度适应范围外,不同环境中营养盐水平的差异也是需要考虑的重要因素之一。
[1] Ahno,Petrell R J,Harrison P J.Ammonium and nitrate uptake byL aminaria saccharinaandNereocystis leutkeanaoriginating from a salmon sea cage farm[J].Appl Phycol,1998,10:333-340.
[2] 董双林,李德尚,潘克厚.论海水养殖的养殖容量[J].青岛海洋大学学报,1998,28(2):245-250.
[3] 许妍,董双林,金秋.几种大型海藻对赤潮异弯藻生长抑制效应的初步研究[J].中国海洋大学学报:自然科学版,2005,35(3): 475-477.
[4] 徐永健,陆开宏,韦玮.大型海藻江蓠对养殖池塘水质污染修复的研究[J].中国生态农业学报,2007,15(5):156-159.
[5] 徐姗楠,温珊珊,吴望星,等.真江蓠(Gracilaria verrucosa)对网箱养殖海区的生态修复及生态养殖匹配模式[J].生态学报, 2008,28(4):1466-1475.
[6] Jones A B,Dennison W C,Preston N P.Integrated treatment of shrimp effluent by sedimentation,oyster filt ration and macroalgal absorption:a laboratory scale study[J].Aquaculture,2001, 193:155-178.
[7] 刘静雯,董双林.光照和温度对细基江蓠繁枝变型的生长及生化组成影响[J].青岛海洋大学学报,2001,31(3):332-338.
[8] 吴超元,李纫芷,林光恒,等.细基江蓠繁枝变型生长适宜环境条件的研究[J].海洋与湖沼,1994,25(1):60-66.
[9] 钱鲁闽,徐永健,焦念志.营养盐因子对龙须菜和菊花江蓠N、P吸收速率的影响[J].台湾海峡,2005,24(4):546-552.
[10] 徐永健,王永胜,韦玮.多因子交互作用对菊花江蓠氮、磷吸收速率的影响[J].水产科学,2006,25(5):222-226.
[11] 姜宏波,田相利,董双林,等.鼠尾藻生长、藻体成分及其生境的初步研究[J].海洋湖沼通报,2009:59-66.
[12] 张峻甫,夏邦美.华南的两种江蓠[G].//经济海藻分类.2卷.美国:美加州大学出版社,1998,5(3):281-282.
[13] 曾呈奎,王素娟,刘思俭,等.海藻栽培学[M].上海:科技出版社,1985,225-250.
[14] 陈锤,林振碧,李淑瑜,等.江蓠生长环境因子适应度的研究[J].福建水产,1999,20(3):48-55.
[15] 达维斯C J.海洋植物学[M].厦门大学植物生态学研究室译.厦门:厦门大学出版社,1989:258.
[16] Moran R.Formulae for determination of Chlorphyllous pigments extracted with N,N-dimethylformamide[J].Plant physiol, 1982,69:1376-1381.
[17] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2003:268-269.
[18] 郭赣林,董双林,董云伟.温度及其波动对孔石莼生长及光合作用的影响[J].中国海洋大学学报:自然科学版,2006,36(6): 941-945.
[19] 王巧晗,董双林,田相利,等.盐度日节律性连续变化对孔石莼生长和生化组成的影响[J].中国海洋大学学报:自然科学版, 2007,37(6):911-915.
[20] 黄鹤忠,孙菊燕,王永玲,等.无机氮浓度及其配比对细基江蓠繁枝变型生长及生化组成的影响[J].海洋科学.2006,30(9):23-27.
[21] Jiang Yu,Yu-Feng Yang.Physiological and biochemical response of seaweed Gracilaria lemaneiformis to concentration changes of N and P[J].Journal of Experimental Marine Biology and Ecology, 2008,367:142-148.
[22] Kursar T A,Alberte R S.Photosynthetic unit organization in a red alga:relationships between light-harvesting pigments and reaction centres[J].Plant Physiol,1983,72:409-414.
[23] 徐永健,钱鲁闽,王永胜.氮素营养对龙须菜生长及色素组成的影响[J].台湾海峡,2006,25(2):222-228.
[24] Lohman K,Priscu J C.Physiological indicators of nutrient deficiency inCladophora(Chorophyta)in the Clark Fork of the Columbia River,Montana[J].Phycol,1992,28:443-448.
[25] Lopes P F,Oliveira M C,Colepicolo P.Diurnal fluctuation of nitrate reductase activity in the marine red algaGracilaria tenuistipitata(Rhodophyta)[J].Phycologia,1997,33:225-231.
[26] Zou D H.Effects of elevated atmospheric CO2on growth,photosynthes is and nitrogen metabolism in the economic brown seaweed,Hizikia fusiforme(Sargassaceae,Phaephyta)[J].Aquaculture,2005,250:726-735.
[27] Crawford N M,Arst N H J.The molecular genetics of nitrate assimilation in fungi and plants[J].Annu Rev Genet,1993,27: 115-146.
[28] 徐智广,邹定辉,张鑫,等.光照和不同形态氮营养盐供应对坛紫菜硝酸还原酶活性的影响[J].水产学报,2007,31(1):90-96.
[29] J Fridovich.The biology of oxygen radical[J].Science,1975, 20(1):875-880.
[30] Song F M,Ge X C,Zheng Z H.Changes in activities of superoxide dismutase and catalase in cotton seedling after infection with Fusarium oxysporum f.sp.vasinf ectumand their relations to the resistance[J].Journal of Zhejiang University(Agric.&Life Sci.),1999,25(4):373-377.
[31] 孙菊燕.营养盐因子对江蓠生理、生长及生化组成的影响[J].苏州大学学报,2006,30:14-24.
Abstract: Effects of nutrient concentration changes on growth,biochemical compositions and physiology ofGracilarialichenoides andG.tenuistipitatavar.liui were compared under the conditions of laboratory.The results showed that different forms of nutrient concentration changes have different impacts on growth,content of PE,chlorophyll-a,total carbon,total nitrogen,NR activities and CA T activities of the two species ofGracilariae.Gracilaria lichenoidesexpressed the best growth in the middle concentration of nutrient.G.tenuistipitatavar.liui expressed different growth which depends on the concentration of nutrient in the preliminary environment.Generally,the content of PE,chlorophyll-a,total carbon,total nitrogen and NR activities of the two species ofGracilariaewould be increased when the nutrient concentration changed from 3μmol/L to 45μmol/L and 150μmol/L.However,when the nutrient concentration changed from 45μmol/L and 150μmol/L to 3μmol/L those data mentioned above would decline.It had no effects to the NR activities of the two species ofGracilariaewhen the nutrient concentration mutually changes from 45μmol/L to 150μmol/L.The activities of CAT would decline dramatically as the concentration of inorganic nitrogen increases.When the nutrient concentration changed from 3μmol/L to 150 μmol/L,the CAT activities of the two species ofGracilariaedeclined dramatically.Oppositely,when the nutrient concentration changed from 150μmol/L to 3μmol/L,it's activities would increased somewhat. Comprehensive comparison showed thatG.tenuistipitatavar.liui was much susceptible to be influenced by the nutrient concentration changes in the environment,and it’s adaptability of nutrient concentration changes may be lower thanG.lichenoides.
Key words: nutrient concentration changes;growth;physiology;biochemical compositions;Gracilaria lichenoides;G.tenuistipitatavar.liui
责任编辑 于 卫
Effects of Nutrient Concentration Changes on Growth,Biochemical Compositions and Physiology of Gracilaria lichenoides and G.tenuistipitata var.liui
J IANG Wen-Wen,TIAN Xiagn-Li,DONG Shuang-Lin,WANG Qing-Lin,LI Ying
(Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao 266003,China)
S917.3
A
1672-5174(2010)09Ⅱ-083-08
国家高技术研究发展计划课题(2006AA10Z409);国家十一五科技支撑计划课题(2006BAD09A01);新世纪优秀人才支持计划(NCET-08-0503)资助
2010-03-03;
2010-04-15
蒋雯雯(1985-),女,硕士生。E-mail:wen850211@yahoo.com.cn
Tel:0532-82032117;E-mail:xianglitian@ouc.edu.cn
