真空包装烟熏火腿切片主要腐败菌的分离及分子快速鉴定
2010-09-12胡萍徐幸莲周光宏李虹敏谢伟徐舶
胡萍,徐幸莲,周光宏,李虹敏,谢伟,徐舶
(1.贵州大学生命科学学院,贵州贵阳550025;2.南京农业大学农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095;3.北华大学,吉林吉林132011)
真空包装烟熏火腿切片主要腐败菌的分离及分子快速鉴定
胡萍1,2,徐幸莲2,周光宏2,李虹敏2,谢伟2,徐舶3
(1.贵州大学生命科学学院,贵州贵阳550025;2.南京农业大学农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095;3.北华大学,吉林吉林132011)
利用微生物分离纯化与16S rDNA分子鉴定方法相结合,对真空包装烟熏火腿切片贮藏过程中主要腐败微生物菌相进行分离鉴定。产品在4℃贮藏,于不同时间取样,对其中微生物菌落进行分离和纯化、形态观察和部分生理生化鉴定,对最终得到的细菌纯培养物直接提取DNA,进行16S rDNA V3可变区扩增,PCR产物经测序后于NCBI与已知序列进行相似性比对。结果表明:从PCA和MRS培养基上共挑选出107株纯菌株。经形态学和生理生化鉴定,最后得到17株具有典型特征的纯菌株,经16S rDNA分子鉴定归纳为:Leuconostoc mesenteroides spp.、Lactobacillus sakei subsp.Sakei、Lactobacillus curvatus subsp.Melibiosus、Weissella viridescens、Dietzia sp.和 Plantibacter aurantiacus.等6个属/种的细菌。
火腿切片;腐败菌;分离;鉴定
Abstract:In this research,traditional microbiological method combination of molecular technology based on 16S rDNA were used to isolate and identify the predominate spoilage bacteria on vacuum packed sliced smoked cooked ham during storage period.The products were sampled at different time during storaged at 4℃,the microbial flor were isolated and classified by morphological and biochemical tests,than the final pure culture of bacteria DNA were directly exteracted and subjected to PCR to amplify the V3 region of the 16S rDNA,follow by sequencing which were aligned to 16S rDNA gene fragments available from NCBI to find the closest known relatives to this partial 16S rDNA sequences.The results showed that:there were 107 pure strains isolated from PCA and MRS medium which were classified as 17 strains with typical characteristics by morphologyical and biochemical identification.The predominate bacteria was summarized as six genus/species microorganisms.There are Leuconostoc mesenteroides spp.,Lactobacillus sakei subsp.Sakei,Lactobacillus curvatus subsp.Melibiosus,Weissella viridescens,Dietzia sp.and Plantibacter aurantiacus.
Key words:sliced cooked ham;spoilage bacteria;isolation;identification
烟熏火腿(smoked cooked ham),是典型的西式低温肉制品。通常采用切片后真空包装,2℃~8℃冷藏,保持了肉品原有的营养,具有良好的感官,鲜嫩的口感和较高的出品率[1]。但是,低温肉制品常存在产品出水、出油、褪色快、货架期短等问题。肉制品货架期的长短依赖于所污染微生物的数量和类型,特别是初始菌群和贮存过程中最终生长的菌群[2]。由于低温肉制品的热处理温度为72℃左右,大多数微生物被杀死,在贮藏期间,某些特定的微生物适应新的环境因素而存活下来,最终导致腐败。研究发现,肉和肉制品初始菌落数量一般为102cfu/g~103cfu/g,但包含丰富的种群多样性。了解肉制品中污染微生物的多样性,确定主导腐败微生物,最终揭示特定腐败菌(specific spoilage organisms,SSO)及其致腐机理利于控制微生物的生长繁殖以及采用正确的保鲜措施确保产品的安全性[3]。然而,运用传统微生物研究方法确切地了解肉制品的腐败微生物还存在很多困难,因为微生物种和属之间的显性特征往往会因为环境差异而出现交叉表象[4],传统的分离鉴定方法存在费时费力,而结果准确性又受诸多因素影响的缺点。因此,本研究利用微生物分离纯化与16S rDNA分子鉴定方法相结合,对真空包装烟熏火腿切片贮藏过程中主要腐败微生物菌相进行分离与快速鉴定。能够克服以往的难题,很好地揭示低温肉制品中主导腐败微生物菌相,目前相关的研究报导很少。本研究的结果可以为揭示低温肉制品中的特定腐败菌及其致腐机理打下良好的基础,也为开发食品微生物的快速鉴定方法提供一定的理论参考。
1 材料与方法
1.1 材料
1.1.1 样品制备
烟熏猪肉火腿切片在江苏某食品公司生产,除未添加保鲜剂外,其余原辅料与该公司同类产品一致。主要有:猪肉、氯化钠、聚磷酸钠、谷氨酸钠、白砂糖、植物蛋白、淀粉、香料、亚硝酸盐以及水。真空包装材料为PAPE。
生产工艺流程:原材料混合,4℃条件真空滚揉16h,灌装入人工肠衣中,水煮至中心温度达72℃,烟熏4 h,温度为65℃~72℃,然后用流动冷却水迅速降温0.5 h,置于4℃冷库中冷却过夜,第2天于低温无菌分装车间切片,厚度为0.5 cm,真空包装。
1.1.2 取样及处理
共取样品100袋(100 g/袋)置于4℃闭光贮藏,于0、3、7、15、25、35 d 取样(2 个重复),用于进行微生物的分离培养。
1.1.3 培养基及试剂
1)主要培养基
PCA(PlateCountAgar)平板计数琼脂、NB(Nutrition Broth)营养肉汤:路桥,北京;MRS(deManRogosaSharpe agar)琼脂、MRB(deManRogosaSharpeBroth)肉汤:Oxoid,英国。
2)主要试剂
DNA Tissue Kit:QIAGEN,德国;Wizard SV Gel and PCR Clean-up System:Promega,美国;革兰氏染色液(自配);TE缓冲液(自配:10 mmol/L tris-HCL,1 mmol/L EDTA,pH 8.0)。去离子水:南京农业大学农畜产品加工与质量控制重点实验室自制。
1.1.4 仪器及设备
HI9025c Microprocessor pH计:葡萄牙,Hanna;PCR 仪 Mastercycler ep personal: 德 国 ,Eppendorf;Powerpac Basic 164-5050水平电泳仪、凝胶成像仪GelDoc 2000 system:美国,BioRad;DP12显微镜数码相机、PLYMPUS BX41系统显微镜:日本,OLYMPUS;Allegra64R高速冷冻离心机:美国,Beckman;2-6小型离心机:德国,Sigma;SW-CF-1F 超净工作台:中国,苏净;FA2004N电子天平:上海,丞明;BCD-192DC控温冰箱:中国,Haier;HZQ-F160(A)高低温恒温振荡培养箱:江苏,宏凯;微量进样器(1-10 μL、10-20 μL、20-200μL、100-1000μL):德国,ENPERNDORF;其它微生物实验常用试管、移液管、量筒、三角瓶等玻璃器皿及接种针、接种环等。
1.2 测定方法
1.2.1 优势腐败菌的分离、纯化和部分鉴定
无菌操作取25 g样品(2个重复)加入225 mL生理盐水(0.1%蛋白胨,0.9%NaCl)摇床振摇30 min。取1 mL上清液依次进行10倍递增稀释,选3个合适的稀释度,每个稀释度做2个重复,倾注平板。采用PCA和MRS培养基分别于37℃和30℃下培养48 h[5]。
每一次取样时间在PCA和MRS培养基上进行的培养,选择适当稀释浓度(菌落在30~300之间)的平皿,在其培养基上挑选典型的单一菌落,平板划线法反复进行分离、纯化(>3次),得到纯菌,然后进行菌落形态观察,细胞染色和细胞形态观察。
1.2.1.1 分离和纯化
从上述培养基平板上挑取典型生长的菌落,在相应的选择性培养基上反复进行平板划线分离,得到纯化的单菌落。
1.2.1.2 菌落特征与细菌形态特征观察
观察并记录已分离纯化的单个菌落的形态,包括大小、形态、隆起程度、边缘结构、表面形态、光泽度、透明度、质地及颜色等。
挑取培养18 h~24 h长势好的单一菌落,通过革兰氏染色观察菌株个体形态,包括细胞的形状、细胞间的排列方式等。
1.2.1.3 氧化酶试验
参考东秀珠等方法[6],用细玻棒挑取18 h~24 h菌龄的菌苔,涂抹在湿滤纸20 s反应,无气泡者为阴性。
1.2.1.4 触酶试验
以灭菌牙签挑取少量培养18 h~24 h的菌苔,涂抹于已滴有3%过氧化氢的玻片上,如有气泡产生则为阳性,无气泡为阴性。
1.2.1.5 分类保存
根据菌落特征和形态学特征,首先将挑选出来的菌株进行分组归类,再将各组菌株进行纯培养,重复以上比较,将菌落特征和形态学特征有差异的重新分类,再经过纯培养,重复以上操作3次,最后将纯菌株接种到营养肉汤(NB)和MRS肉汤中分别在37℃和30℃条件下培养24 h,处于对数生长期的细菌培养液取10 mL,4℃,10000×g离心 15 min,弃上清,将细菌于-20℃保存,用于下一步提取DNA[7]。
1.2.2 纯培养细菌DNA的提取
将上述纯细菌取出(2个重复),添加10 mL灭菌去离子水,充分振荡混均。取1 mL混合液于1.5 mL离心管,4℃、14000×g离心10 min。弃上清,将沉淀用100 μL TE缓冲液溶解混均,参照DNA Tissue Kit(QIAGEN,Germany)说明,用该试剂盒提取总的细菌DNA。所提取DNA溶于TE缓冲液,1.0%琼脂糖凝胶电泳检测后,-20℃条件贮藏。
1.2.3 PCR扩增
扩增引物参照文献[8]:gc338f:5′-CGCCCGCCGCG CGCGGCGGGCGGGGCGGGGGCACGGGGGGACTCCTA CGGGAGGCAGCAG-3′,518r:5′-ATTACCGCGGCTGC TGG-3′,扩增细菌 16S rDNA 的 V3 可变区序列[6,9]。25 μL 反应体系包含:1 μL 模板 DNA,引物各2.5 μL(1 μmol/L),GoTaq Green Master Mix(2 × )(Promega,USA)12.5 μL 以及双蒸水 6.5 μL。采用“降落”PCR(touchdown PCR)程序:94℃预变性5 min;94℃变性1 min,退火温度从65℃到55℃,每个循环降低0.5℃,退火时间为3 s,72℃延伸1 min,进行20个循环。再于恒定退火温度下进行10个循环(94℃变性1 min,55℃退火30 s,72℃延伸1 min)。PCR产物经1.2%琼脂糖电泳检测后于-20℃冷冻备用。
1.2.4 PCR产物测序及分析
PCR产物经纯化后送上海生工公司测序。登录NCBI(www.ncbi.nlm.nih.gov/blast/),将所得序列与数据库中的已知序列进行相似性比对[9]。
2 结果与分析
2.1 优势腐败菌的分离、纯化和初步鉴定
真空包装烟熏猪肉火腿切片4℃贮藏过程中(0 d~45 d),从PCA和MRS培养基上具有典型特征的菌落上共挑选出107株纯菌株。经反复进行形态学观察和比较,最后得到17株在菌落型态、细菌形态、生化特性上有差异的纯菌株。分离菌株的菌落特征、细菌形态特征和部分生理生化特性的观察结果和试验结果见表1。

表1 分离菌株的菌落特征、形态特征和部分生理生化特性Table 1 Characteristics of community,morphology and part of physiology of isolation strains
2.2 细菌16S rDNA的V3可变区PCR结果
以分离纯化的17株细菌DNA为模版,用16S rDNA的V3可变区引物进行PCR扩增,经1.2%琼脂糖凝胶电泳检测,获得230 bp左右的特异性扩增片断,如图1所示。

图1 分离纯菌株细菌16S rDNA的V3可变区PCR扩增产物琼脂糖电泳图Fig.1 Agaros electrophoresis photo of PCR amplification products of 16S rDNA V3 regions of 17 bacterium colonies
从图1可见,所有样品都有较亮的扩增条带,片段约230 bp左右,说明本试验的PCR扩增条件是比较合适的,适合用于测序分析。

表2 17株细菌的16S rDNA V3可变区序列Table 2 16S rDNA V3 region sequenc of 17 strains
2.3 序列分析及鉴定
序列进行测序,17株细菌16S rDNA V3可变区序列如表2所示。登陆NCBI与GenBank核酸数据库中已知序列比对,以最大相似率来确认,最后得到代表6个不同属或种的17株菌株,如表3所示。菌株1,4,5,6,11,16 代 表 肠 膜 明 串 珠 菌 种 的 细 菌(Leuconostoc mesenteroides spp.),其中6和11为肠膜明串株菌肠膜亚种(Leuconostoc mesenteroides subsp.mesenteroides);菌株 2,7,8,9,10,15 代表清酒乳杆菌清酒亚种的细菌(Lactobacillus sakei subsp.sakei);菌株3为清酒乳杆菌肉食亚种(Lactobacillus sakei subsp.carnosus);菌株 14为弯曲乳杆菌蜜二糖亚种(Lactobacillus curvatus subsp.melibiosus);17菌株代表绿色魏氏菌(Weissella viridescens);菌株 12,13分别代表细菌Dietzia sp.和Plantibacter aurantiacus。
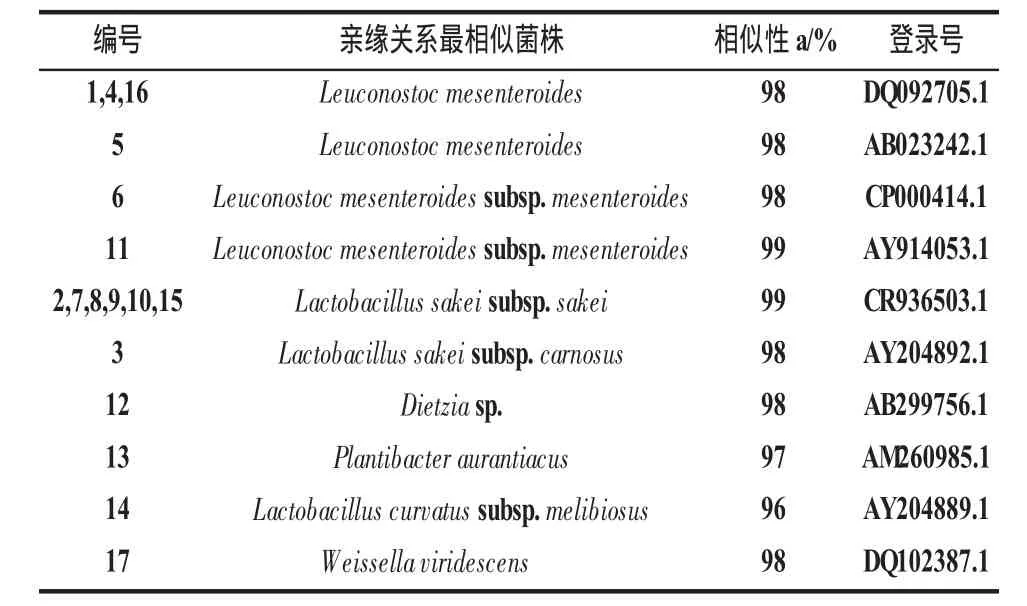
表3 通过16S rDNA序列鉴定切片火腿上分离出的纯菌株Table 3 Strains identified by means of 16S rDNA sequencing fragments from pure culture isolated from sliced cooked ham
3 讨论与结论
大量研究表明,乳酸菌是各种类型的肉及肉制品中的主要腐败菌[10-12]。本研究中所分离的17株菌中有14株菌是乳酸菌,因此可以推断真空包装烟熏火腿切片的主导腐败菌群也是乳酸菌。有研究报导真空包装低温肉制品产黏是由于同型发酵的乳酸杆菌(Lactobacillus spp.) 以及异型发酵的明串珠菌(Leuconostoc spp.)导致的[13-14]。有报导称清酒乳杆菌的某些能产生黏液的菌株具有很强的生长竞争力[15]。还有研究发现,清酒乳杆菌/弯曲乳杆菌(Lactobacillus sakei/curvatus)是很多发酵食品酸化后期的主要菌群,在发酵中起着重要的作用;Lactobacillus sakei/curvatus是烟熏蒸煮类低温肉制品中的主要菌群,这两种菌在低温肉制品中具有很好的共存特征[15-16]。在本研究中亦分离出了:肠膜明串珠菌、清酒乳杆菌和弯曲乳杆菌。这为进一步利用分子指纹图谱技术证实真空包装烟熏火腿切片的主导腐败菌群打下了很好的基础[17]。
由结果可知真空包装烟熏火腿切片的腐败微生物存在较高的多样性。除了肠膜明串珠菌、清酒乳杆菌、弯曲乳杆菌等乳酸菌外,还有绿色魏氏菌等污水常见腐败菌,而Dietzia sp.和Plantibacter aurantiacus.属于嗜冷菌,可能是原料肉在冷藏过程中污染的。可见,肉制品上乳酸菌的多样性反映了加工环境污染的差异性,说明该产品的微生物污染具有一定的复杂性,其中原料肉也被认为是一个重要的污染源。
快速、准确地确定那些强烈影响低温肉制品最终品质和卫生安全的腐败微生物,有助选择正确的加工工艺和采取有效的保鲜方法。本研究利用微生物分离纯化与16S rDNA分子鉴定方法相结合,对真空包装烟熏火腿切片主要腐败微生物菌相进行分离鉴定,最终 分 离 鉴 定 出 :Leuconostoc mesenteroides spp.、Lactobacillus sakei subsp.Sakei、Lactobacillus curvatus subsp.Melibiosus、Weissella viridescens、Dietzia sp. 和Plantibacter aurantiacus.等6个属/种的菌株。
[1]周光宏,徐幸莲.肉品学[M].北京:中国农业出版社,1999:433-436
[2]Borch E.Bacterial spoilage of meat and cured meat products[J].International Journal of Food Microbuology,1996,33:103-120
[3]Hansen L T,Huss H H.Comparison of the microflora isolated from spoiled cold-smoked salmon from three smoke houses[J].Food Res Inter,1998,31:703-711
[4]Holley R A.Impact of slicing hygiene upon shelf life and distribution of spoilage bacteria in vacuum packaged cured meats[J].Food Microbiol,1997,14:201-211
[5]白艳红.低温熏煮香肠腐败机理及生物抑菌研究[D].博士论文,2005:42-43
[6]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:2
[7]Miambi E,Guyot J P,Ampe F.Identification,isolation and quantification of representative bacteria from fermented cassava dough using an integrated approach of culture-dependent and culture-independent methods[J].International Journal of Food Microbiology,2003,82:111-120
[8]Ampe F,Ben Omar N,Moizan C,et al.Polyphasic study of the spatial distribution of microorganisms in Mexican Pozol,a fermented maize dough,demonstrates the need for cultivation-independent methods to investigate traditional fermentations[J].Applied and Environ Microbiol,1999,65:5464-5473
[9]Altschul S F,Madden T L,Schaffer A,et al.Gapped BLAST and PSIBLAST:a new generation of protein database search programs[J].Nucleic Acids Research,1997,25:3389-3402
[10]Gill C O,Newton K G.The ecology of bacterial spoilage of fresh meat at chill temperatures[J].Meat Science,1978(3):207-217
[11]Schillinger U,Lücke F K.Identification of lactobacilli from meat and meat products[J].Food Microbiology,1987(4):199-208
[12]Yang R,Ray B.Factors influencing production of bacteriocins by lactic acid bacteria[J].Food Microbiology,1994(11):281-291
[13]Korkeala H,Suortt T,Makela P.Ropy slime formation in vacuumpacked cooked meat products caused by homofermentative lactobacilliandaLeuconostocspecies[J].InternationalJournalofFoodMicrobiology,1988(7):339-347
[14]Dykes G A,Cloete T E,von Holy A.Taxonomy of lactic acid bacteria associated with vacuum-packaged processed meat spoilage by multivariate analysis of cellular fatty acids[J].International Journalof Food Microbiology,1995,28:89-100
[15]Bjorkroth J,Korkeala H.Ropy slime-producing Lactobacillus sake strains possess a strong competitive ability against a commercial biopreservative[J].International Journal of Food Microbiology,1997,38:117-123
[16]Lee J-S,Heo G-Y,L J W,et al.Analysis of kimchi microflora using denaturing gradient gel electrophoresis[J].International Journal of Food Microbiology,2005,102:143-150
[17]Hu ping,Zhou guanghong,Xu xinglian,et al.Characterization of the predominant spoilage bacteria in sliced vacuum-packed cooked ham based on 16S rDNA-DGGE.[J].Food Control,2009,20:99-104
Isolation and Rapid Identification of Molecular of the Predominate Spoilage Bacteria on Sliced Vacuum Packed Cooked Ham
HU Ping1,2,XU Xing-lian2,ZHOU Guang-hong2,LI Hong-min2,XIE Wei2,XU Bo3
(1.College of Life Science,Guizhou University,Guiyang 550025,Guizhou,China;2.Key Lab of Meat Processing and Quality Control,Ministry of Education,College of Food Science and Technology,Nanjing Agricultural University,Nanjing 210095,Jiangsu,China;3.BeiHua University,Jilin 132011,Jilin,China)
2010-05-31
国家科技支撑计划(2006 BAD05A15);贵州省农业攻关项目(黔科合NY字[2009]3076)
胡萍(1970—),女(汉),副教授,博士,研究方向:食品安全与生物技术。
