固定化β-甘露聚糖酶制备甘露低聚糖的研究
2010-09-12杨伟东
杨伟东
(宝鸡文理学院,陕西宝鸡721007)
固定化β-甘露聚糖酶制备甘露低聚糖的研究
杨伟东
(宝鸡文理学院,陕西宝鸡721007)
研究用固定化β-甘露聚糖酶水解魔芋精粉制备甘露低聚糖的工艺。试验结果表明反应时间、魔芋精粉浓度、温度及加酶量对甘露低聚糖的制备有一定影响,其中魔芋精粉浓度和加酶量影响较大,反应温度影响较小。通过正交试验优化出的固定化β-甘露聚糖酶制备甘露低聚糖的最佳工艺条件为:魔芋精粉浓度2%;加酶量为6400 U;反应温度70℃;反应时间17 h。在此条件下甘露低聚糖的得率为30.8%。
甘露低聚糖;固定化β-甘露聚糖酶;魔芋精粉
Abstract:The process conditions of Mannan-Oligosaccharides is studied by this paper,that produced by Immobilized β-mannanase.Experimental results show that the reaction time,konjac flour concentration,temperature and the amount of Immobilized β-mannanase on the Mannan-oligosaccharides have some influence,it is most influence that konjac flour concentration and time of reaction,but temperature was less.The orthogonal test results show when time was 17 h,temperature was 70℃,concentration of konjac flour was 2%,and amount of Immobilized β-mannanase was 6400 U.The synthesis of galacto-oligosaccharide amount was 30.8%.
Key words:mannan-Oligosaccharides;immobilized β-mannanase;konjac flour
甘露低聚糖是近年来国际上颇为流行的一种新型功能性低聚糖,它是由2个~10个甘露糖通过糖苷键连接形成主链,再在主链上连接葡萄糖或半乳糖的杂聚寡糖。它能有效促进人体内有益细菌双歧杆菌的生长繁殖,调节肠道菌群平衡,增强人体免疫力等多种功能[1]。由于游离酶的价格很高,为了节约成本,用固定化酶来生产甘露低聚糖具有许多游离酶无法比拟的优点[2-4]。例如反应后酶可以重复回收使用,可以实现连续生产,并且易于制成各种各样的生物反应器,因此得到广泛的利用。
1 材料与方法
1.1 主要试验材料
黑曲霉β-甘露聚糖酶:陕西科技大学生命科学与工程学院食品分析实验室制备;魔芋精粉:武汉清江魔芋制品有限公司。
1.2 方法
1.2.1 固定化β-甘露聚糖酶的制备
用0.5%的乙酸溶液配制1.5%的壳聚糖溶胶,并将其涂抹在60目~100目的层析硅胶上。再用戊二醛对硅胶—壳聚糖颗粒进行化学修饰,交联3h后彻底水洗至洗脱液中没有戊二醛,然后加入β-甘露聚糖酶于冰浴中搅拌1 h后,放入冰箱中4℃吸附过夜。次日用蒸馏水彻底水洗,过滤干燥,即得到固定化β-甘露聚糖酶[5-8]。
1.2.2 DNS试剂的配制
酒石酸钾钠18.2 g,溶于50 mL蒸馏水中,加热,于热溶液中依次加入3,5-二硝基水杨酸0.03 g,NaOH 2.1 g,苯酚0.5 g,搅拌至溶,冷却后用蒸馏水定容至100 mL,贮于棕色瓶中,室温保存。
1.2.3 固定化酶活力测定
固定化酶活力的测定方法:将10 mL用pH=5.8的缓冲溶液配制的0.3%的魔芋精粉底物于75℃的水浴中预热10 min,然后加入0.3 g的固定化酶准确反应10 min后,从中吸取1 mL反应液,然后加入3 mL DNS试剂于沸水浴中加热5 min后比色。
1.2.4 甘露低聚糖的制备
配制一定pH值的磷酸缓冲溶液,置于150 mL带塞锥形瓶中,加入一定量的魔芋精粉,预热后加入一定量的固定化β-甘露聚糖酶,在一定温度的恒温摇床中反应一段时间,取样,用薄层色谱法检测各糖组分的含量。
1.2.5 甘露低聚糖的检测
采用上行的薄层色谱法,以硅胶G作薄板,正丙醇∶水(体积比)=85∶15 为展开剂,点样量为 0.2 μg/μL,用苯胺-二苯胺-磷酸溶液喷雾后于110℃加热下显色10 min,用直接测定法检测各糖组分含量。
1.2.6 单因素试验
按照甘露低聚糖的制备方法,以甘露低聚糖得率为考察指标,依次进行了7个乳清粉浓度:0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%;8个反应温度:55、60、65、70、75、80、85、90 ℃;8 个 pH 值:3.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0;7 个酶用量:1280、2560、3840、5120、6400、7680,8960 U;17 个反应时间(h)的单因素试验。每个水平重复3次,测定结果取平均值。
1.2.7 正交试验
根据单因素试验结果,以甘露低聚糖得率为考察指标,选择反应温度、魔芋精粉浓度、酶添加量和反应时间,设计4因素3水平正交试验L9(34),进行3次平行试验,结果取其平均值,通过极差分析和试验结果优化固定化酶法制备甘露低聚糖的最佳工艺条件。
2 结果与讨论
2.1 反应时间对甘露低聚糖得率的影响
在反应温度60℃、乳清粉浓度3%、pH5.8、固定化酶用量6400 U时,研究了不同的反应时间对甘露低聚糖得率的影响,结果见图1。由图1可知:当反应时间小于15 h时,随着反应时间的增加,葡甘露低聚糖得率逐渐增加;当反应时间大于15 h时,随着反应时间的增加,葡甘露低聚糖得率反而逐渐减小。这是因为当反应时间小于15 h时,β-甘露聚糖酶随机降解糖苷键,葡聚糖分子被分解成各种糖类,随着时间的增加甘露低聚糖得率逐渐增加。当反应时间大于15 h时,随着时间的增加,甘露低聚糖分子被分解成单糖。
2.2 反应温度对甘露低聚糖的影响
在反应时间为15 h,乳清粉浓度3%、pH5.8、固定化酶用量6400 U时,研究了不同反应温度下固定化酶法制备甘露低聚糖的反应历程,结果如图2所示。
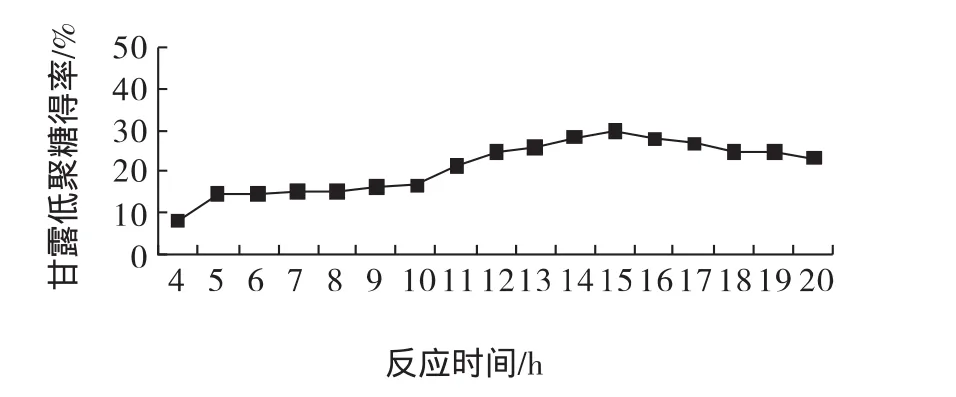
图1 反应时间对甘露低聚糖得率的影响Fig.1 The effect of reactive time on yield of Mannan-Oligosaccharides
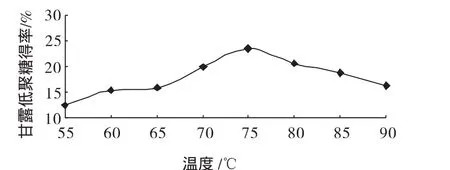
图2 反应温度对甘露低聚糖得率的影响Fig.2 The effect of the amount of enzyme activity on Mannanoligosaccharides
如图2可知,当温度小于70℃时,随着温度的升高,甘露低聚糖的得率逐渐增加,说明温度升高有利于糖苷键的断裂;当温度大于70℃时,随着温度的升高,甘露低聚糖的得率反而逐渐降低,这是由于甘露聚糖酶部分失活。
2.3 加酶量对甘露低聚糖得率的影响
加酶量对甘露低聚糖得率的影响见图3。

图3 加酶量对甘露低聚糖得率的影响Fig.3 The effect of the concentration of Konjac on Mannanoligosaccharides
由图3可知,当加酶量小于6400 U时,随着加酶量的增加,甘露低聚糖得率逐渐增加;当加酶量大于6400 U时,甘露低聚糖得率随着加酶量的增加反而减小,这是因为过多的酶将甘露低聚糖分解成为单糖。
2.4 底物浓度对葡甘露低聚糖得率的影响
底物浓度对葡甘露低聚糖得率的影响见图4。
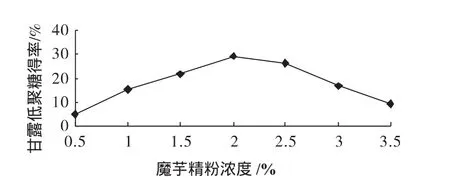
图4 魔芋精粉浓度对甘露低聚糖得率的影响Fig.4 The effect of the temperature of the reactive on Mannanoligosaccharides
由图4可知,当魔芋精粉浓度小于2%时,随着魔芋精粉浓度的增大,甘露低聚糖的得率逐渐增加;当魔芋精粉浓度大于2%时,甘露低聚糖的得率随着魔芋精粉浓度的增大反而减小,这是因为当魔芋精粉浓度较高时,甘露聚糖酶只将甘露聚糖分解成聚糖,而不是形成低聚糖。
2.5 正交试验的结果
正交试验的结果见表1。
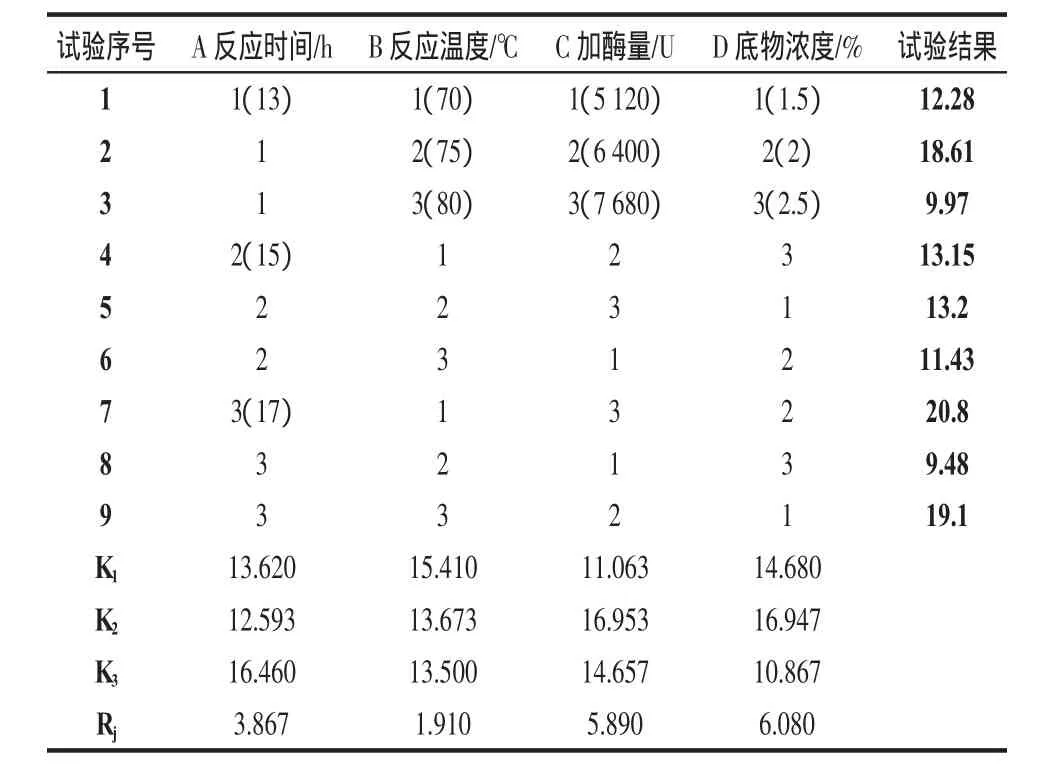
表1 正交结果及分析Table 1 The result of orthogonal
对正交试验结果进行极差分析可知,各因素极差值大小顺序为 RD>RC>RA>RB,4 个因素对甘露低聚糖制备影响的主次顺序为D>C>A>B。分析得知,各因素的最优水平组合是A3B1C2D2,即魔芋精粉浓度2%、固定化酶量6400 U、温度70℃、反应时间17 h。在各因素的最优水平组合条件下固定化酶法制备甘露低聚糖,重复3次进行验证试验,测得甘露低聚糖得率平均为30.8%。
3 小结
通过单因素试验和均匀试验得出最佳工艺条件:魔芋精粉胶浓度为2%;加酶量为6400 U;反应温度70℃;反应时间17 h。在该工艺条件下甘露低聚糖得率为:30.8%。
[1]龙健儿,陈一平.β-甘露聚糖酶的研究现状[J].微生物学杂志,1998,18(3):44-49
[2]张伟,杨秀山.酶的固定化技术及其应用[J].自然杂志,2000,22(5):282-286
[3][日]千烟一郎.固定化酶[M].胡宝华,译.石家庄:河北人民出版社,1981:45-60
[4]陈驹声,居乃琥,陈石根.固定化酶理论与应用[M].北京:轻工业出版社,1987:80-89
[5]蒋挺大.甲壳素[M].北京:化学工业出版社,2003:30-35
[6]Cetinus S A,Oztop H N.Immobilization of catalase on chitosan film[J].Enzyme Microb Technol,2000,26(7):497
[7]John Wiley,Sons Inc.Immobilization of Trypsin on chitin and ChitosanbySolid-StateMixGrinding[J].BiotcchnologyandBiotechnolengineering,1982,XXIV:753-756
[8]Cellapandian M,Krishnan M R V.Chitosan-poly(glycidyl methacrylate)copolymer for immobilization of urease[J].Process-Biochem,1998,33(6):595-600
The Study of Production of Mannan-Oligosaccharides by Immobilized β-mannanase
YANG Wei-dong
(Baoji University of Sciences and Arts,Baoji 721007,Shaanxi,China)
2010-04-02
杨伟东(1979—),男(汉),助教,硕士研究生,研究方向:生物新材料的制备与检测。
