壳聚糖和甲壳素热分解动力学研究*
2010-09-12刘廷国李斌张近祥朱黎萍陈建
刘廷国,李斌,张近祥,朱黎萍,陈建
1(华中农业大学食品科技学院,湖北武汉,430070)
2(池州学院化学与食品科学系,安徽池州,247100)
壳聚糖和甲壳素热分解动力学研究*
刘廷国1,2,李斌1,张近祥1,朱黎萍1,陈建1
1(华中农业大学食品科技学院,湖北武汉,430070)
2(池州学院化学与食品科学系,安徽池州,247100)
采用多重扫描速率法研究了壳聚糖和甲壳素2种物质的热分解动力学,2种物质的反应活化能E和指前因子lnA分别为(157.81±1.23)、(171.67±3.16)kJ/mol和(26.49±0.26)、(24.20±0.62)min-1。Achar微分法判定了两者的热分解最概然机理函数,壳聚糖的热分解机理函数为f(α)=2(1-α)3/2,属级数反应;甲壳素的分解机理函数为 f(α)=3/2(1-α)2/3[1-(1-α)1/3]-1,属三维扩散、球形对称机理。
壳聚糖,甲壳素,热分解,动力学,多重扫描速率
甲壳素(chintin)在天然有机化合物中产量仅次于纤维素,是地球上除蛋白质外含氮量最高的天然有机化合物,估计每年自然界生物合成的量将近100亿t。自然界中,甲壳素以高度有序的结晶微纤维形式广泛存在于节肢动物虾、蟹、昆虫等的外骨骼中,以及某些真菌、霉菌、酵母菌等的细胞壁甚至于某些低等植物的细胞壁中[1-2]。壳聚糖(chitosan)是甲壳素的N-脱乙酰化产物,由性质活泼的伯胺基取代了化学惰性的乙酰氨基,使得壳聚糖分子能够形成聚电解质,从而具有许多独特的性质:良好的生物相容性、广谱抗菌性、生物可降解性、重金属离子螯合性、成膜性和成纤性等[3-4]。甲壳素、壳聚糖及其衍生物在农业、废水处理、纺织印染行业、生物医药、食品、化妆品等领域均有很高的应用价值[5-6]。
生物质热解近年来受到人们的广泛关注,通过热解可将生物质转化为高附加值高品位的炭、生物油和可燃气等,深入研究生物质热解有助于推进生物质热化学转化的进程[7]。壳聚糖作为一种环境友好高聚物材料,在自然界的循环利用已经引起学术界的广泛重视,已有不少学者开始研究其热解行为。但尚有大量工作需要深入开展,而且目前国内尚无该方面报道。通过研究壳聚糖在不同环境条件下降解导致断链、主链或侧链的分解和挥发性成分的生成等,以及对其热分解动力学的研究能够更好地帮助设计壳聚糖的生产和利用,适当的动力学描述能够有效的对化学和物理过程进行设计、优化和预测[8-9]。本研究以甲壳素和壳聚糖为原料,利用DSC初步研究其热分解行为,为后续研究提供基础数据参考。
1 材料与方法
1.1 材料及主要仪器
甲壳素(脱乙酰度,DDA=21.1%),购自浙江金壳生物化学有限公司;壳聚糖(DDA=87.5%),实验室自制。
差示扫描量热仪(DSC),德国Netzsch公司。
1.2 方法
样品DSC曲线在Netzsch DSC 204 F1热分析仪上获得,仪器用纯金属铟校正。准确称取(5.0±0.1)mg样品放入盖子中心带孔的铝坩埚中,密封,用相同的空坩埚作参比。以20℃/min升温速率从30℃升至190℃,恒温5 min。然后重新称量,分别以5.0、10.0、15.0、20.0和25.0℃/min的升温速率加热到600℃。整个过程均在干燥N2下进行,吹扫气流量20 mL/min,保护气60 mL/min[10-11]。数据的采集和处理均采用仪器配套Proteus软件包。
2 结果与分析
2.1 壳聚糖和甲壳素的热特性分析
图1为壳聚糖和甲壳素在动态N2,加热速率为10℃/min条件下的DSC曲线。甲壳素的热分解过程是典型的吸热过程,壳聚糖则是典型的放热过程。在整个升温过程中甲壳素只出现一个峰值为400.6℃,起始温度309.4℃、终止温度419.7℃的宽的吸热峰,这个吸热过程可能是由于在N2气氛下,甲壳素解聚过程中伴随着小分子挥发性产物和炭黑的形成,这说明刚性结构的甲壳素热稳定性很好。壳聚糖则出现了一个峰值为310.0℃,从289.3~326.3℃的尖锐放热峰,与甲壳素相比峰值温度明显下降。这个放热过程可能是由于热处理过程中发生了氧化或热交联反应形成新的聚合物,这种聚合物的二次解聚导致在N2气氛下,DSC曲线上出现放热行为。这与甲壳素在更高温度下缓慢的热解聚显著不同,一方面显示了由于更多自由胺基的存在而导致热稳定性的降低,另一方面也可能因为分子柔性的增强,链段运动的增加而导致热分解速度显著加快,之所以甲壳素吸热解聚,而壳聚糖放热解聚,目前尚无明确的解释,或许与交联反应有关。

图1 壳聚糖和甲壳素样品的DSC(DDSC)图谱(10℃/min)
升温速率对DSC实验结果的影响十分明显,提高升温速率通常使分解反应的起始温度To、峰值温度Tp和终止温度Te增高。快速升温时,反应尚未开始,便进入更高的温度,造成反应滞后性,然而却能提高信号强度,增大灵敏度,使峰幅变窄呈尖高状,有利于微弱相变的测定。慢速升温则有利于阶段反应的相互分离,使DSC曲线呈分离的多重峰,尽管会减弱信号强度,但能够提高分辨率,有利于多重相变的测定。图2给出了壳聚糖在动态N2气氛中不同升温速率条件下的DSC曲线。由图2可知,在程序升温过程中,不论快速升温(25℃/min)还是相对慢速升温(5℃/min),整条DSC曲线只有一个放热峰,甲壳素的多重扫描速率DSC曲线与壳聚糖类似。
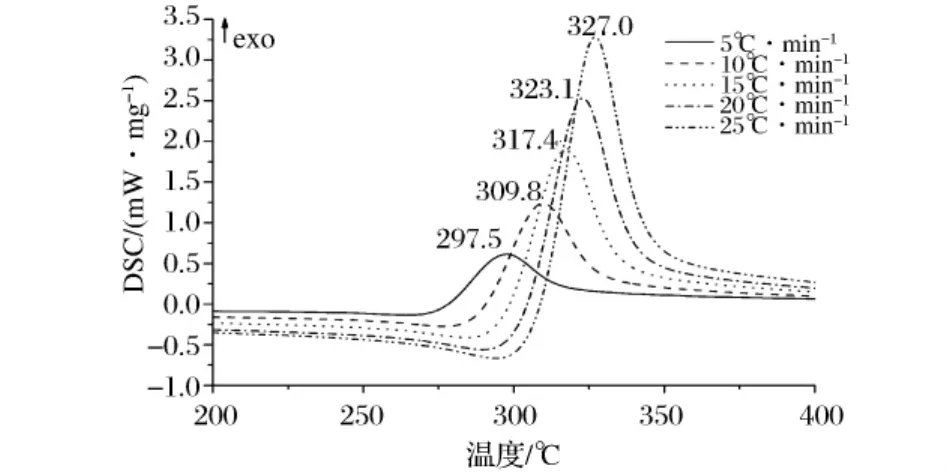
图2 壳聚糖在动态N2中不同升温速率下的DSC曲线
2.2 动力学分析
2.2.1 动力学数据处理方法
根据等温动力学理论,固体分解反应动力学方程一般可表示为:
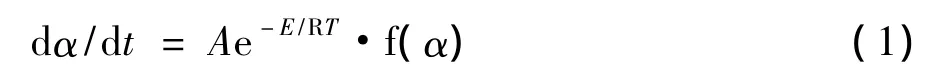
式中:α为转化率(%)、A为指前因子、E为活化能、R为普适常数、T为温度(K)。在热分析实验中升温速率β=dT/dt是恒定的,将β代入上式,就得到非等温非均相反应的动力学方程:
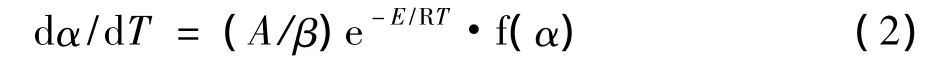
式(2)经微分和积分后变形可以得到Friedman法和Flynn-Wall-Ozawa(FWO)法所对应的方程:
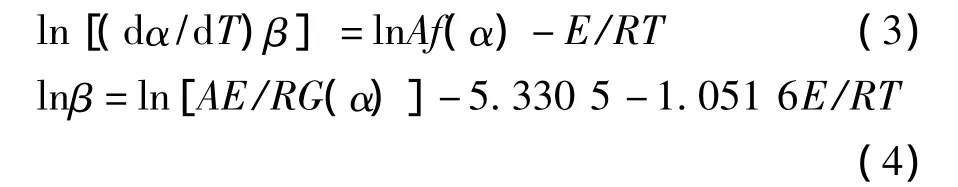
Friedman法和Ozawa-Flynn-Wall法也称为多重扫描速率法,它是指用不同升温速率所测得的几条热分析曲线来进行动力学分析的1种方法。它常用到几条热分析曲线上同一转化率α处的数据进行动力学处理,所以又称为等转化率法(Iso-conversional method)。这类方法的特点是能将k(T)和f(α)或G(α)分离,在相同转化率α下f(α)或G(α)的值不随升温速率的不同而改变,从而在不引入动力学模型函数的前提下得到比较可靠的活化能值,所以也称之为无模式函数法(model-free method)。
由于这2种方法避开了反应机理函数的选择而直接求出E值,消除了因反应机理函数的假设不同而可能带来的误差,因此往往被用来检验由假设反应机理函数的方法求出的活化能值,这是其突出优点[12-13]。
2.2.2 动力学参数的获得
由于仪器噪音的影响,信噪比太小使得数据的可靠性降低;另外在反应开始时动力学模型和主反应阶段有较大差异性,在反应末期的反应相当复杂,并存在连续反应的倾向,因此转化率α常选择在0.2~0.8内[14]。对于Ozawa法,在多个升温速率β下选择相同的数个α,以各个α时的lnβ对1/T进行线性回归,由斜率得到不同转化率α条件下的活化能E值(式4)。而对于Friedman法当转化率α一定时,lnAf(α)是常数,以ln[β(dα/dT)]对1/T作图可得直线,由斜率可进一步计算得到E值,确定机理函数后由截距求得A值(式3)[12]。根据文献[12]报道方法将DSC数据转化为转化率α对温度的关系曲线。
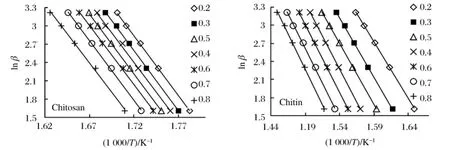
图3 壳聚糖和甲壳素在不同转化率下的lnβ与1/T的关系图(Ozawa法)
图3 是采用Ozawa法计算壳聚糖和甲壳素反应活化能时,lnβ对1/T在转化率20%~80%时的线性拟合图,线性相关系数几乎都在0.9990以上。采用Friedman法进行计算时,所得结果与Ozawa法结果相差不大。表1列出了分别采用Ozawa法和Friedman法计算的壳聚糖和甲壳素的反应活化能结果。由于计算过程中采用的是数据逐点计算的方法,故不可避免地会产生累积误差,因而取2种方法所得结果的平均数作为热分解的活化能。由表中数据可以算出,两者的热分解活化能分别为(155.95±2.19)和(171.52±14.36)kJ/mol。
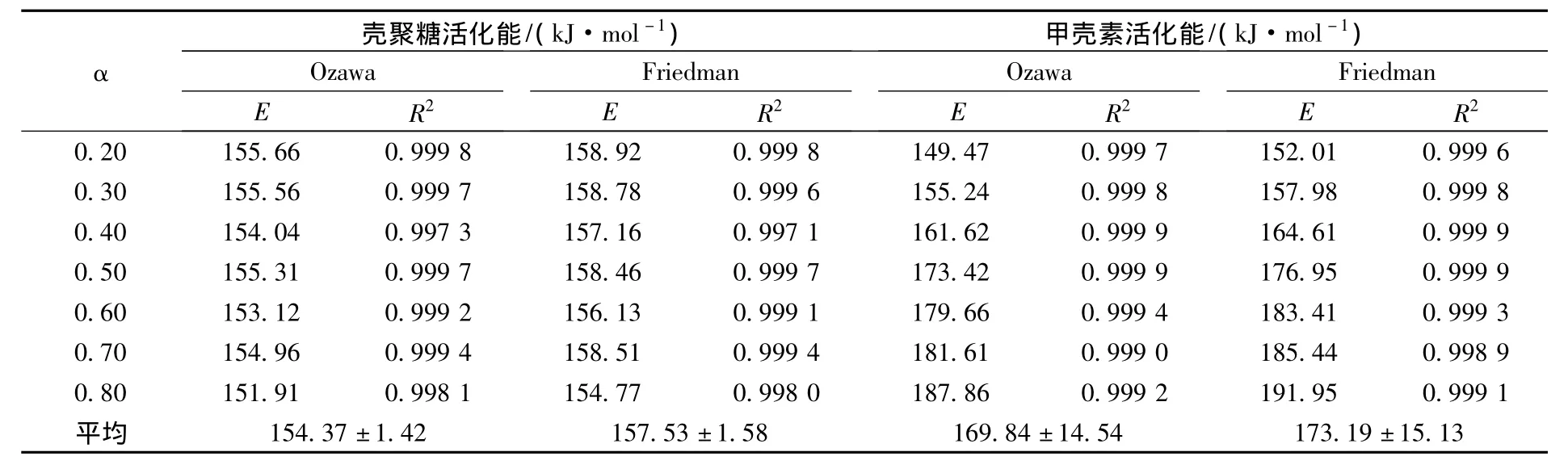
表1 用不同方法计算的壳聚糖和甲壳素热分解活化能
壳聚糖和甲壳素热分解反应活化能E与转化率α之间的关系,可以直观的转化为图4所示。采用Ozawa法计算的壳聚糖的热分解活化能受转化率的影响比较小,但似有渐降的趋势;而甲壳素的热分解活化能强烈依赖于转化率α,并呈几乎线性关系增长,反应从20%进行到80%,活化能升高了38.39kJ/mol,表明甲壳素的分解可能不是简单的1步反应。采用Friedman方法计算结果也出现相同规律,这与Tang等 人[9]的报 道 相 反,而 与Britto[15],MacCallum[16]和Pawlak[17]等人的结果更为接近,其原因有待进一步研究。
2.2.3 最概然机理函数的判定
将Achar方程[12]进行分离变形得:
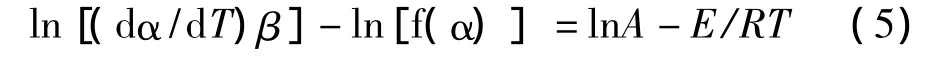
图4 甲壳素和壳聚糖热分解反应活化能E与转化率α之间的关系
将表2中文献报道的21种常见固体反应动力学机理函数f(α)以及各个样品的DSC基础数据分别带入式5,首先计算出 l n[(dα/dT)β]-ln[f(α)]和1000/T,然后以 l n[(dα/dT)β]-ln[f(α)]对1000/T分别作图,经迭代和最小二乘法进行多元线性回归拟合,得到不同动力学模型函数的E,lnA及相关系数R2值[12,18-20],详细结果列于表3中。

表2 常见动力学机理函数的微分表达式

表3 壳聚糖和甲壳素的热分解反应动力学参数的微分法计算结果
根据用机理函数处理的数据结果和用Ozawa法计算的E值相比较,选取E值较为接近且相关系数比较好、自身偏差比较小的一组,该组所对应的机理为该反应的热分解机理。依据上述数据,符合要求的机理函数分别是壳聚糖(No.19)和甲壳素(No.3),则对应的f(α)即可确定为最概然机理函数。综上所述,壳聚糖的热分解机理函数为f(α)=2(1-α)3/2,属级数反应;甲壳素的分解机理函数为f(α)=3/2(1-α)2/3[1-(1-α)1/3]-1,属三维扩散、球形对称机理[12]。
3 结论
甲壳素和壳聚糖的热分解过程都只有一个分解峰,是其主降解峰。采用多重扫描速率法研究了壳聚糖和甲壳素的热分解过程,分别计算了2种物质主分解阶段的反应活化能E和指前因子lnA值分别为(157.81 ± 1.23)、(171.67 ± 3.16)kJ/mol和(26.49±0.26)、(24.20 ±0.62)min-1。但这些参数与 DSC曲线上的热分解温度并无绝对对应关系,尚难于与热分解微观反应过程直接建立联系。对壳聚糖的活化能值计算与文献出入不大,但甲壳素的计算结果与文献有较大偏差,具体原因有待进一步研究。
[1]严淑兰,陆大年.甲壳素/壳聚糖的应用[J].广西纺织科技,2000,29(2):38-40.
[2]张正生,薛绍玲.甲壳素/壳聚糖的应用研究进展[J].科技信息,2007,21:328-329.
[3]Chae S Y,Jang M Y,Nah J W.Influence of molecular weight on oral absorption of water soluble chitosans[J].J Controlled Release,2005,102:383-394.
[4]Je J Y,Cho Y S,Kim S K.Cytotoxic activities of watersoluble chitosan derivatives with differentdegree of deacetylation[J].Bioorg Med Chem Lett,2006,16:2122-2126.
[5]Baxter S,Zivanovic S,Weiss J.Molecular weight and degree of acetylation of high-intensity ultrasonicated chitosan[J].Food Hydrocolloids,2005,19:821-830.
[6]No H K,Park N Y,Lee S H,et al.Antibacterial activity of chitosans and chitosan oligomers with different molecular weights[J].Int J Food Microbiol,2002,74:5-72.
[7]王明峰,蒋恩臣,周岭.玉米秸秆热解动力学分析[J].农业工程学报,2009,25(2):204-207.
[8]Schlotzhauer W S,Chortyk O T,Austin P R.Pyrolysis of chitin,a potential tobacco extender[J].J Agric Food Chem,1976,24(1):177-180.
[9]Tang W J,Wang C X,Chen DH.Kinetic studies on the pyrolysis of chitin and chitosan[J].Polym Degrad Stab,2005,87:389-394.
[10]Kittur F S,Prashanth K V H,Sankar K U,et al.Characterization of chitin,chitosan and their carboxymethyl derivatives by differential scanning calorimetry[J].Carbohydr Polym,2002,49:185-193.
[11]Guinesi L S,Cavalheiro é T G.The use of DSC curves to determine the acetylation degree of chitin/chitosan samples[J].Thermochim Acta,2006,444:128-133.
[12]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001.
[13]任宁,张建军.热分析动力学数据处理方法的研究进展[J].化学进展,2006,18(4):410-416.
[14]戚桂斌,刘庆阳,贝逸翎,等.三种糖类物质的热降解动力学研究[J].山东大学学报:理学版,2007,42(7):19-21.
[15]Britto D D,Campana-filho S P.Kinetics of the thermal degradation of chitosan[J].Termochim Acta,2007,465:73-82.
[16]Maccallum J R.Polymer Characterisation(Vol.1)[M].Oxford:Pergamon,1989:903-909.
[17]Pawlak A,Mucha M.Thermogravimetric and FTIR studies of chitosan blends[J].Termochim Acta,2003,396:153-166.
[18]王海东,李延团,陈勇,等.Cu(Ⅱ)草酰胺衍生物热分解动力学研究[J].四川大学学报:自然科学版,2002,39(4):733-737.
[19]张堃,林少琨,林木良.热分析动力学多元非线性拟合法简介及其应用[J].现代科学仪器,2005(5):15-18.
[20]张志国,伊红.聚氧丙烯醚的非等温热分解动力学及寿命[J].浙江大学学报:工学版,2006,40(4):689-693.
ABSTRACTDSC non isothermal multiple scan curves were applied to investigate the pyrolysis kinetics of chitosan and chitin.The apparent activation energy(E)and frequency factor(lnA)for thermal decomposition were(157.81±1.23)、(171.67±3.16)kJ/mol and(26.49±0.26)、(24.20±0.62)min-1,respectively.And the most probable mechanism functions were obtained by Achar’s differential method.The functions of chitosan and chitin were f(α)=2(1-α)3/2and f(α)=3/2(1-α)2/3[1-(1-α)1/3]-1,which was considered as 2/3 order chemical reaction and 3D diffusion and ball symmetry mechanism.
Key wordschitosan,chitin,pyrolysis,kinetic,multiple scan rates
Kinetic Studies on the Pyrolysis of Chitosan and Chitin
Liu Ting-guo1,2,Li Bin1,Zhang Jin-xiang1,Zhu Li-ping1,Chen Jian1
1(College of Food Science and Technology,Huazhong Agricultural University,Wuhan 430070,China)
2(Department of Chemistry and Food Science,Chizhou University,Chizhou 247100,China)
硕士,讲师(李斌教授为通讯作者,E-mail:libinfood@mail.hzau.edu.cn)。
*国家“863”资助项目(2007AA10Z310);池州学院化学材料与工程省级实验中心建设项目资助
2010-03-04,改回日期:2010-05-16
