蛹虫草固体发酵培养基多糖的分离纯化及组成分析
2010-09-12任大明李冬琦劳云云
任大明,李冬琦,劳云云
(沈阳农业大学生物科学技术学院,辽宁沈阳110161)
蛹虫草固体发酵培养基多糖的分离纯化及组成分析
任大明,李冬琦,劳云云
(沈阳农业大学生物科学技术学院,辽宁沈阳110161)
为研究蛹虫草固体发酵培养基中多糖的分离纯化及组成,本实验利用水提醇沉法与Sevage法相结合,得到蛹虫草固体发酵培养基粗多糖(CMSMP)。经DEAE-cellulose 52柱层析分离得到纯化蛹虫草固体发酵培养基多糖组分(CMSMP1)后,采用紫外光谱、醋酸纤维素薄膜电泳和Sephadex G-150凝胶柱层析鉴定其纯度,高效液相色谱及红外光谱分析其组成、结构。结果表明,CMMSP1为均一多糖,且由木糖、阿拉伯糖和葡萄糖三种单糖组成。同时红外光谱显示,CMSMP1具有典型多糖吸收峰。
蛹虫草固体发酵培养基多糖,分离纯化,纯度鉴定,组成分析
Abstract:To study the purification and composition of polysaccharides from Cordyceps militaris solid fermentation medium,the crude polysaccharides(CMSMP)were obtained by water extraction and alcohol precipitation,then removal of protein by enzymatic hydrolysis and Sevage in this experiment.The deproteinated CMSMP were purified by DEAE-cellulose 52,and it was analyzed by the techniques of U∨,cellulose acetate membrane electrophoresis and Sephadex G-150.Composition was analyzed by HPLC and IR.The results showed that CMSMP1 was homogeneous polysaccharides which were composed of xylose,arabinose and glucose.IR showed CMSMP1 had a typical absorption peak of the polysaccharide.
Key words:Cordyceps militaris solid fermentation medium polysaccharide;isolation and purification;purity determination;composition analysis
维持生命所需生理功能息息相关的多糖是构成生命活动四大基本物质之一,是一种具有开发潜力的天然药物化学成分。目前对多糖研究引起了学者的浓厚兴趣,研究领域包括糖生物学、糖工程学等。同属异种的蛹虫草(C.militaris)[1]与冬虫夏草有效成分种类及含量接近,但蛹虫草多糖研究甚少。在虫草多种生理活性物质中,多糖具有多种生物活性,具有广泛的药理作用。为此,对蛹虫草培养及活性成分研究与日俱增。1992年,盖新杰等[2]从蛹虫草菌体培养液中提取含有少量蛋白的半乳甘露糖。1997年,李信等[3]发现蛹虫草胞外多糖具有良好的抗逆性及抗氧化活性。2003年,宾文等[4]研究发现蛹虫草多糖具有体液免疫及红细胞免疫增强作用。同时,蛹虫草多糖还具有促进SOD酶活力的作用。为进一步发掘具有潜在经济价值和药用价值的蛹虫草多糖,本实验对蛹虫草固体发酵培养基中多糖进行分离纯化后,应用紫外吸收光谱、高效液相色谱和红外光谱对其单糖组成和简单结构进行初步分析和鉴定,为蛹虫草固体发酵培养基中多糖的开发与利用提供参考。
1 材料与方法
1.1 材料与仪器
蛹虫草固体培养基 由沈阳农业大学食用菌研究所提供;DEAE-cellulose 52、Sephadex G-150、木瓜蛋白酶、苯酚、硫酸、氯仿、正丁醇、氯化钠、甲苯胺蓝、三氟乙酸等 均为国产分析纯。
HH-6型数显恒温水浴锅,TGL-10C高速台式离心机,DHL-A电脑恒流泵,SBS-100自动部分收集器,UV-2100紫外可见分光光度计,DYY-6B型稳压稳流电泳仪,DYY-Ⅲ型电泳槽,Equinox 55红外光谱仪。
1.2 实验方法
1.2.1 蛹虫草固体发酵培养基中多糖的分离纯化水提醇沉法提取得到蛹虫草固体发酵培养基粗多糖[7]。采用木瓜蛋白酶与 Sevag法[5]相结合除蛋白,得到精制蛹虫草固体发酵培养基多糖CMSMP。利用DEAE-cellulose 52[6-7]分级,最终得到纯化蛹虫草固体发酵培养基多糖组分。
1.2.2 蛹虫草固体发酵培养基中多糖分级组分的纯度鉴定[8-9]采用紫外光谱扫描法、醋酸纤维薄膜电泳法及Sephadex G-150凝胶柱层析法对蛹虫草固体发酵培养基多糖分级组分的纯度进行鉴定。
1.2.3 蛹虫草固体发酵培养基中多糖分级组分的单糖组成分析
1.2.3.1 多糖的完全水解[6]取10mg CMSMP1于一安瓿管中,加入4mL 2mol/L的三氟乙酸,封管,110℃水解6h,于40℃将三氟乙酸蒸干,加入4mL甲醇,蒸干,重复3~5次,加入1mL蒸馏水溶解,用于高效液相色谱分析。
1.2.3.2 高效液相色谱(HPLC)分析 色谱条件为:流动相:乙腈∶水 =90∶10;流速:0.8mL/min;固定相:氨基柱(3.0×150mm);检测器:岛津SPD-10A型示差折光率检测器;柱温:室温;进样量:5!L。
1.2.4 蛹虫草固体发酵培养基中多糖分级组分的红外光谱(IR)分析 取2mg CMSMP1,用KBr研磨压片后,在4000~400cm-1范围内进行扫描。
2 结果与分析
2.1 CMSMP的分离纯化
采用DEAE-cellulose 52柱层析对CMSMP进行分级,其洗脱曲线如图1所示。经蒸馏水,0.1、0.3、0.5、1.0mol/L NaCl洗脱后(分别对应 1~24,25~48,49~72,73~96,97~120 管),得到2 个多糖洗脱峰,分别为CMSMP1、CMSMP2,根据其含量,收集主要级分CMSMP1。
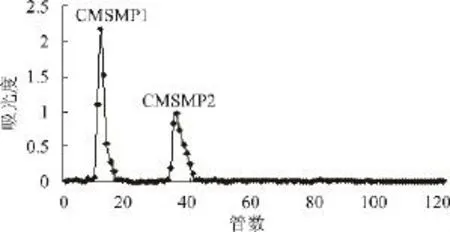
图1 CMSMP的DEAE-cellulose 52柱层析洗脱曲线
2.2 CMSMP1的纯度鉴定
2.2.1 CMSMP1的紫外光谱扫描 CMSMP1在200~400nm的紫外扫描图谱见图2。在260、280nm处均无吸收,说明多糖中无蛋白质、多肽及核酸。
2.2.2 CMSMP1的醋酸纤维薄膜电泳 CMSMP1的醋酸纤维薄膜电泳结果见图3。显示一个斑点,说明CMSMP1在组成上较唯一,是一种多糖纯品。
2.2.3 CMSMP1的Sephadex G-150凝胶柱层析CMSMP1经过Sephadex G-150凝胶柱层析,洗脱曲线为单一狭窄的对称洗脱峰(图4),结合紫外吸收光谱及醋酸纤维薄膜电泳结果,说明CMSMP1级分为多糖纯品,可进行性质和结构研究。

图2 CMSMP1的紫外光谱图

图3 CMSMP1的醋酸纤维素薄膜电泳图
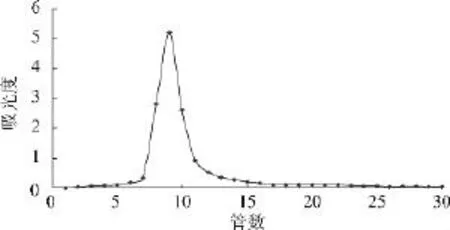
图4 CMSMP1的Sephadex G-150凝胶柱层析洗脱曲线
2.3 CMSMP1的单糖组成
从图5中可以看出,与标准单糖的保留时间对比,CMSMP1完全酸水解含有3种单糖:D-木糖、D-阿拉伯糖、D-葡萄糖,其摩尔比为 1∶0.26∶4.62,可见蛹虫草固体发酵培养基多糖CMSMP1是一种由3种单糖组成的杂多糖。
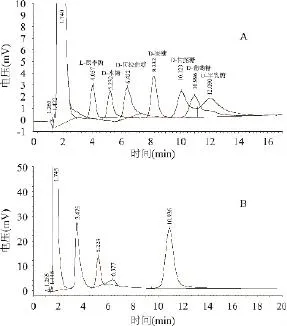
图5 单糖标准品(A)及CMSMP1水解样品(B)的高效液相色谱图
2.4 CMSMP1的红外光谱(IR)分析
CMSMP1 在 3412.0、2928.0、1639.4、1381.7、1041.3、579.8cm-1处出现多糖特征吸收峰(图6)。据相关资料报道,3600~3200cm-1为糖类O-H键的伸缩振动,表明多糖存在分子内和分子间的氢键;3000~2800cm-1的吸收峰是C-H键的伸缩振动,为糖类的特征吸收峰;2928.0cm-1为糖类C-H伸缩吸收峰;1639.4cm-1为 CHO的 C=O键的伸缩振动;1455~1327cm-1出现的多个峰为C-H变角振动吸收峰,这组峰是糖类的特征吸收峰;1200~1000cm-1之间的吸收峰是由两种C-O键伸缩振动所形成,其中一种属于C-O-H键,另一种是糖环的C-O-C键。

图6 CMSMP1的红外吸收图谱
3 讨论
1969年,日本人发现具有抗肿瘤活性的真菌多糖,掀起了从真菌中寻找抗肿瘤成分的高潮[10]。目前,蛹虫草中多糖形成途径和机理及提高产量因素尚不明确。蛹虫草多糖产量一直没有得到明显提高。虫草具有提高免疫力、抗癌及保肝等功效,越来越受到人们重视。蛹虫草产量的增加及明确其活性物质的生物合成途径、机理和调控等已成为急待解决问题,那么,在问题尚未解决之前是否可以充分利用现有资源变废为宝?基于此,本实验将蛹虫草固体发酵培养基残渣进行再次利用,提取分离得到木糖、阿拉伯糖、葡萄糖3种单糖成分,避免了蛹虫草固体发酵培养基的浪费。应用水提醇沉法提取蛹虫草固体发酵培养基中多糖,用木瓜蛋白酶结合Sevag法除蛋白,经过离子交换层析进行纯化,得到一种不含蛋白、纯度较高的蛹虫草固体发酵培养基多糖CMSMP1。高效液相色谱分析显示,CMSMP1含有木糖、阿拉伯糖、葡萄糖3种单糖成分;红外光谱分析进一步证明了其具有糖类特征吸收峰。
实验结果表明,采用DEAE-cellulose 52柱层析,能够有效地对蛹虫草固体发酵培养基中多糖进行组分分离,并取得了较好的分离效果,为进一步充分利用蛹虫草固体发酵培养基中有效资源并深入研究其详尽结构和生物活性等提供了理论依据。
[1]车振明.虫草多糖生物活性研究进展及其应用前景[J].食用菌,2004(6):3-5.
[2]盖新杰,张翼伸.蛹虫草胞外多糖的研究[J].真菌学报,1992,11(4):300-307.
[3]李信,许雷.蛹虫草菌产生的胞外多糖及其理化性能和抗氧化活性的初步研究[J].微生物学杂志,1997,17(3):13-16.
[4]宾文,宋丽艳,等.人工培养蛹虫草多糖的抗炎及免疫作用研究[J].时珍国医国药,2003,14(1):1-2.
[5]徐建祥,晏志云,赵谋明,等.酶法脱蛋白技术用于螺旋藻多糖提取工艺的研究[J].食品与发酵工业,1998,24(3):24-28.
[6]顾林,姜军.山药多糖的分离纯化及组成研究[J].食品科学,2007,28(9):158-161.
[7]杜志强.猴头多糖发酵生产及其生物学功能研究[D].沈阳农业大学生物科学技术学院,2007.
[8]申明月,聂少平,谢明勇.茶叶多糖的纯化及其光谱特性研究[J].食品科学,2007,28(11):39-43.
[9]张凯,戴玲,郑子瑞.仙鹤草多糖的分离纯化及理化性质研究[J].中国生化药物杂志,2008,29(3):171-174.
[10]唐茂芝,贝峰.食用菌类作为功能性食品的优势和特点[J].食品科技,1999(3):5-6.
Purification and composition analysis of polysaccharides from Cordyceps mi/itaris solid fermentation medium
REN Da-ming,LI Dong-qi,LAO Yun-yun
(College of Biological Science and Technology,Shenyang Agriculture University,Shenyang 110161,China)
TS201.2+3
A
1002-0306(2010)10-0121-03
2009-10-15
任大明(1959-),男,博士,教授,研究方向:酶工程与微生物。
