铜绿假单胞菌mexA基因的克隆及其序列分析
2010-09-11程小平沈定霞罗燕萍权秋宁
程小平,沈定霞,罗燕萍,周 光,陈 荣,权秋宁
(1、南昌大学第一附属医院检验科,江西 南昌 330006;2、中国人民解放军总医院微生物科;3、南昌大学医学院06级检验系)
铜绿假单胞菌mexA基因的克隆及其序列分析
程小平1,沈定霞2*,罗燕萍2,周 光2,陈 荣2,权秋宁3
(1、南昌大学第一附属医院检验科,江西 南昌 330006;2、中国人民解放军总医院微生物科;3、南昌大学医学院06级检验系)
目的 克隆铜绿假单胞菌临床菌株mexA基因并进行序列分析。 方法 从临床分离多重耐药的铜绿假单胞菌抽提DNA,经PCR扩增出mexA基因与PUC18克隆载体连接,对重组质粒进行测序验证。 结果 成功地克隆了mexA基因,重组质粒(PUC/mexA)经测序与Genebank检索的mexA基因序列进行对比证实为99.9%同源 。 结论 所构建的铜绿假单胞菌临床菌株mexA基因克隆适于进一步的克隆表达。
铜绿假单胞菌,mexA基因,克隆,序列分析
近年来的研究发现,铜绿假单胞菌(Pseudomonas aeruginosa,PA)内存在着多种主动外排系统,该系统能够主动将扩散进细菌细胞中的抗菌药物泵出细胞外,从而使细菌获得耐药性。进一步研究表明,PA对碳青酶烯类抗生素的高度耐药与其存在的主动外排系统密切相关[1]。随着新的主动外排系统陆续被发现及其在临床主要病原菌耐药中的重要作用不断被揭示和认同,主动外排系统成为目前细菌耐药机制研究中的新热点[2]。目前已明确的导致铜绿假单胞菌多重耐药性的主动外排泵系统共分为:MexAB-OprM[3],MexCD-OprJ[4],MexEF-OprN[5],MexXY-OprM[6],MexJK-OprM[7],MexGHI-OprJ[8],MexVW-OprM[9]。MexAB-OprM在所知的多药外排泵中具有最广的底物特异性,包括β-内酰胺类和β-内酰胺酶抑制剂、氟喹诺酮类、四环素、氯霉素、大环内酯类、新生霉素类、磺胺类及甲氧苄氨嘧啶。为了构建基因工程抗体,本文从临床分离的多重耐药铜绿假单胞菌扩增和克隆出mexA基因,并测定和分析了其全部核苷酸序列,现报告如下。
材料与方法
1 材料
1.1 菌株与质粒标准菌株 :P.ueruginosa PAO4290 lue-10,argF10,aph-9004,FPP.aeruginosa TNP 030#10 OFLX and CFS-resistant日本 TaiJi Nakae教授惠赠;临床铜绿假单胞菌菌株:中国人民解放军总医院微生物科提供。质粒PUC18购自Takara公司。
1.2 酶类及主要试剂 限制性内切酶XbaⅠ,HindⅢ为Takara公司产品;小量胶回收试剂盒为华舜公司产品;T4 DNA ligase为Takara公司产品。
2 方法
2.1 引物设计 设计扩增mexA基因的引物两条,mexA基因的上游引物 ABM F5’-GC TCTAGA CAATCGAGCTCGCTCTGG-3’,引入了XbaⅠ酶切位点。下游引物ABM R5’-GCC AAGCTT TCAGCCCTTGCTGTCGG-3’,引入了HindⅢ酶切位点。引物由上海生工公司合成。
2.2 模板提取 用无菌吸管挑取铜绿假单胞菌MexAB-OprM外排泵过度表达菌株(P.aeruginosa TNP030#10)和临床铜绿假单胞菌菌株的单个菌落,放于含100μl去离子水的Eppendorf管中,100℃煮10min,10,000rpm离心10min,吸取上清液50μl,作为DNA模板 ,-20℃冷藏备用。
2.3 PCR扩增获取mexA基因 以提取的DNA为模板进行PCR扩增,PCR反应体积50μl:5.0μl缓冲液(10×)、5.0μl dNTP(10mmol/L)、引物1和引物2各 3.0μl(2.5μmol/L)、模板 4.0μl、高保真酶 2U、MgCl23.0μl(25mmol/L)和水26μl,混匀,置PCR仪(PER kin ELMER DNA Thermal·cycler 480)上扩增,95℃总变性5min,94℃变性 30s,65℃退火 45s,72℃延伸90s,35次循环反应后,72℃延伸10min。PCR产物上样于1.0%琼脂糖凝胶孔内电泳。
2.4 克隆和DNA序列分析 取PCR产物电泳,用凝胶回收试剂从琼脂糖凝胶中回收PCR产物。连接反应体系10μl:7.0μl PCR产物、PUC18酶切产物1μl、T4 DNA ligase 1μl、10x T4 Buffer 1μl,16℃18h,向连接液中加入200μl感受态Ecoli DH 5α菌转化,然后接种于含氨苄青霉素的LB培养皿中,37℃过夜培养,挑取菌落进一步培养,用质粒提取试剂盒提取重组质粒,用XbaI与HindⅢ双酶切,然后电泳分析结果。将含有重组质粒(PUC18/mexA)的菌株送上海生工公司进行DNA序列分析。
结果
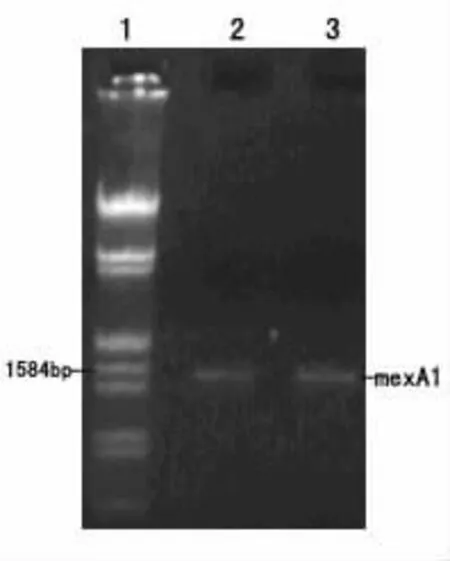
图1 MexA基因PCR扩增产物琼脂糖凝胶电泳图
1 PCR扩增产物(MexA基因 图1)PCR产物经1.0%琼脂糖凝胶电泳,以DNA Markers为分子量标准参考物,可见PCR产物全长 1.5 kb,与预期长度一致。
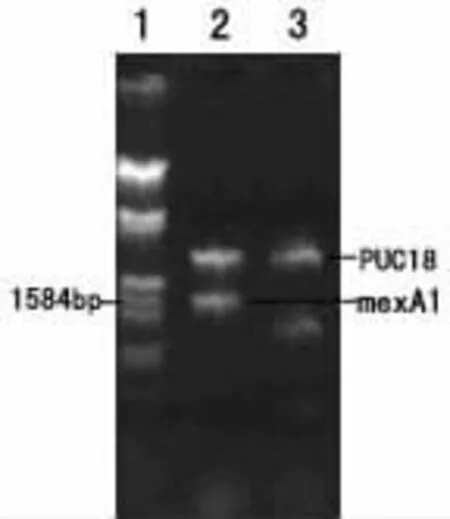
图2 重组质粒PUC18/mexA酶切鉴定琼脂糖凝胶电泳图
2 mexA基因克隆酶切鉴定结果(图2)将PCR扩增目的基因mexA与PUC18载体连接,重组质粒(PUC18/mexA)经XbaⅠ/HindⅢ酶切,1.0%琼脂凝胶电泳,出现2.67kb载体大片段和1.5kb的mexA片段。
3 序列分析和同源性比较结果 含有重组克隆质粒PUC18/mexA的菌株委托上海生工公司行DNA序列分析,序列为:
序列分析结果表明,重组质粒含有1500bp的mexA基因序列,与GeneBank中PAo1mexA基因序列比较在基因大小上完全一致;只有两个碱基不同,392位的碱基由T变为A,1352位的碱基由G变为A,但对应的氨基酸没有变化。
讨论
铜绿假单胞菌(Pseudomonas aeruginosa,PA)所涉及耐药机制相当复杂,包括抗生素灭活酶或修饰酶的生成、外膜低渗透性、外膜孔蛋白缺失、生物膜形成和主动外排等[10]。MexAB-OprM是在PA中发现的第一个RND家族外排系统,在PA对多种β-内酰胺类抗生素(包括碳青霉烯类)的固有耐药机制中发挥重要作用,MexAB-OprM是迄今为止最具有临床意义的药物外排系统。MexAB-OprM主动外排系统的3种蛋白 MexA、MexB、OprM是由同一操纵子所编码,MexR及mexR-MexAB-OprM操纵元的阻遏蛋白[12]氨基酸的替换和插入都可能会影响阻遏蛋白MexR的结构,使其不能与操纵子结合,从而导致主动外排MexAB-OprM的高表达。也有文献报道用mexR PCR产物测序,当126位缬氨酸突变为谷氨酸时,发现不能明显增强MexAB-OprM的表达[11]。 目前国内关于铜绿假单胞菌多药外排泵MexAB-OprM检测主要是通过用RT-PCR法从内膜蛋白结构基因mexB的mRNA转录水平观察MexAB-OprM主动外排系统的表达情况[12]。国外关于临床株的研究较多,经典方法主要是对外膜蛋白进行SDS-PAGE电泳分析,并进一步用免疫印迹方法对外膜蛋白进行定性和半定量的研究。我们用免疫印迹方法或斑点免疫方法检测部分临床铜绿假单胞菌株MexAB-OprM外排泵,效果较理想。本课题曾用 MexA的 92到 106位 氨基酸 YQIDPATYEADYQSA免疫家兔,但未能获得MexA抗体。由于国内没有现成的MexA抗体出售,而铜绿假单胞菌MexAB-OprM外排泵中MexA/MexB和OprM蛋白都具有较好的抗原性和免疫原性,本试验已成功构建了PUC18/mexA克隆载体,为表达MexA蛋白,并用MexA蛋白免疫家兔制作MexA抗体奠定了基础。
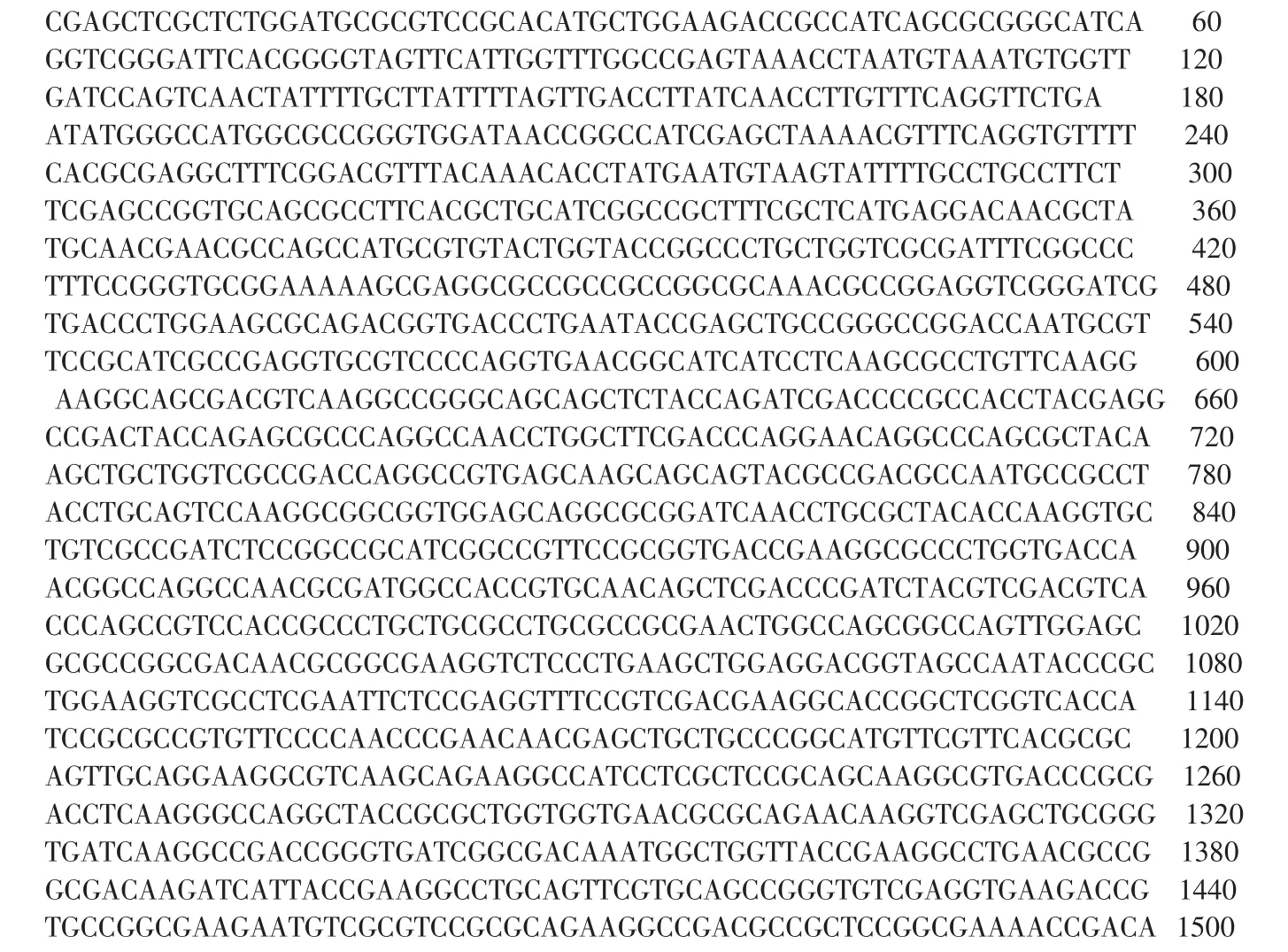
[1]刘香萍,钟 霞,向开富,等.MexAB-OprM和MexXY-OprM在耐药铜绿假单胞菌中的表达[J].中国热带医学,2007,7(5):675-676.
[2]向 莉,段 勇.铜绿假单胞菌主动外排系统MexAB-OprM的研究进展[J].临床药学,2009,15(9):1386-1387.
[3]Poole K,Krebes K,McNally C,et al.Multiple antiblotic resistance in Pseudomonas aeruginosa: evidence for involvement of an efflux operon[J].JBacteriol,1993,175(22):7363-7372.
[4]Poole K,Gotoh N,Tsujimoto H,et al.Overexpression of themexC-mexD-oprJ efflux opreton in nfxB-type multidrug-resistant strains of Pseudomonas aeruginosa[J].Mol Microbiol,1996,21(4):713-724.
[5]Kohler T,Michea-Hamzehpour M,Henze U,et al.Characterization of MexE-MexF-OprN,a positively regulated multidrug efflux system of Pseudomonas aeruginosa[J].Mol Microbiol,1997,23(2):345-354.
[6]Aires JR,Kohler T,Nikaido H,et al.Involvement of an active efflux system in the natural resistance of Pseudomonas aeruginosa to aminoglycosides[J].Antimicrob Agents Chemother,1999,43(11): 2624-2628.
[7]Chuanchuen R,Narasaki C T,Schweizer H P.The MexJK efflux pump of Pseudomonas aeruginosa requires OprM for antibiotic efflux but not for efflux of triclosan[J].J Bacteriol,2002,184(18):5036-5044.
[8]Aendekerk S,Ghysels B,Comelis P,et al.Characterization of a new efflux pump,MexGHI-OpmD, from Pseudomonas aeruginosa that confers resistanceto vanadium[J].Microbiology,2002,148(Pt8):2371-2381.
[9]Li Y,Mima T,Komori Y,et al.A new member of the tripartitemultidrug efflux pumps,MexVW-OprM,in Pseudomonas aeruginosa[J].J Antimicrob Chemother,2003,52(4):572-575.
[10]施凯舜,潘发愤.铜绿假单胞菌耐药研究进展[J].浙江医学,2008, 30(2):199-202.
[11]李 良,张焕萍,王秋婷,等.铜绿假单胞菌主动外排系统MexABOprM与碳青霉烯类药物耐药的关系研究[J].中国卫生检验杂志, 2010,20(2):243-245.
[12]衣美英,黄汉菊,王鹏远,等.多重耐药铜绿假单胞菌MexAB-O-prM、MexXY-OprM主动外排系统的耐药作用[J].中华微生物学和免疫学杂志,2006,26(10):956-961.
Molecular strouin of cloning and sequencing of mexA gene from clinical pseudomonas aeruginosa
CHENG Xiaoping,SHEN Dingxia,LUO Yanping,et al.Department of Clinical Laboratory,The First Affiliated Hospital of Nanchang University Nanchang 330006,China.
ObjectiveTo clone the 40kDa outermembrane protein gene(mexA)from clinical Pseudomonas aeruginosa for nucleotide sequencing.MethodsClinical Pseudomonas aeruginosa was cultured and then mexA temple DNA was extracted.PCR was used to amplify the mexA gene from clinical Pseudomonas aeruginosa DNA. The PCR productswere directly ligated into PUC-18 vector.The recombinat plasmid was verified by sequencing.ResultsThe clone of mexA gene was successfully constructed.The recombinat plasmid(PUC/mexA)was verified to share 99.9%homologies with that Gren Bark by sequencing.ConclusionThe cloning of mexA gene of clinical Pseudomonas aeruginosa is adapted to further expression.
Pseudomonas aeruginosa;MexA gene;Cloning;Sequence analysis
R446.5,R378.99+1,Q785
A
1674-1129(2010)03-0227-03
10.3969/j.issn.1674-1129.2010.03.008
军队“十一·五”基金资助课题(06MA 294)。
程小平,1969年出生,男,硕士,主管技师,从事医学检验。
*通信作者:沈定霞,1962年出生,女,博士,主任医师,教授,从事微生物检验。
