丹皮酚传递体的制备及其稳定性研究
2010-09-11胡海英
李 志,胡海英,王 盼
(郑州大学药学院,河南 郑州 450001)
丹皮酚传递体的制备及其稳定性研究
李 志,胡海英,王 盼
(郑州大学药学院,河南 郑州 450001)
目的 制备丹皮酚传递体并进行质量评价。方法 采用薄膜分散-超声法制备丹皮酚传递体,以粒径为考察指标,通过单因素考察和正交试验设计优选最佳处方和工艺;考察其多分散度、Zeta电位、包封率,并对传递体稳定性进行研究。结果 丹皮酚传递体分散于0.9%氯化钠注射用水中,室温放置20 d稳定,粒径变化较小。最佳配方为磷脂/胆固醇3∶1,磷脂/吐温-80 2∶1,磷脂/丹皮酚10∶1;水合温度为37℃,平均粒径为89.34 nm。结论 丹皮酚传递体制备工艺简单可行,所得传递体粒径较小且均匀。
丹皮酚;传递体;薄膜分散-超声法;正交试验
Abstract:Objective To prepare the paeonol transfersome and to evaluate its quality.Methods Paeonol transfersome was prepared by filmultrasonic dispersion method.The effects of the temperature and the ratio of different components in the transfersome products on particle size were investigated.Results The appropriate formulation was phospholipids and cholesterol 3 ∶1,phospholipids and tween-80 2 ∶1,phospholipids and paeonol 10∶1 with the temperature of 37℃ and the particle size of 89.34 nm.The transfersome remained stable during dispersion and preservation in 0.9% sodium chloride injection water for 20 d.Conclusion Thepreparation method is simpleand reasonable with small and uniform particle size.
Key words:paeonol;transfersome;film-ultrasonic dispersion method;orthogonal experiment
丹皮酚是牡丹皮和徐长卿的主要活性成分,化学名称为2-羟基-4-甲氧基苯乙酮[1],具有祛风、镇痛、降压、抗菌消炎、抗氧化、活血、消瘀以及抑制肿瘤细胞增殖、侵袭、转移和诱导其分化、凋亡等作用[2],临床上用于肌肉痛、关节痛、风湿痛、神经痛、腹痛等。它还能抑制细胞内O2-自由基产生,抑制黑色素细胞内酪氨酸酶活性及黑色素生成,对色斑、皮肤瘙痒、牛皮癣、带状疮疹、湿疹等具有较好的治疗和保健效果[3]。但其在水中的溶解度很低,性质不稳定,易挥发,见光易氧化分解,从而严重影响了使用和疗效。若将丹皮酚制成脂质体可有效地解决难溶性问题,并且可以提高药物稳定性。但由于角质层细胞间隙孔径仅约为30 nm,普通脂质体具有刚性,无法直接穿过比其自身小的角质层细胞间隙,故在经皮转运过程中易沉积于皮肤角质层,不易进入皮肤深部[4]。传递体(transfersomes)又称柔性纳米脂质体,是一种自聚集泡囊,由普通脂质体经处方改进而来,即在脂质体磷脂成分中加入了表面活性剂,与普通脂质体相比具有适宜的柔韧性、亲水性和渗透性,在透皮水化力的作用下可携带药物变形穿过皮肤屏障[5]。笔者制备了丹皮酚传递体,考察了制备方法以及各配方成分质量比对传递体粒径的影响,并对优选配方制备的传递体稳定性作了进一步研究。
1 仪器与试药
RE-52AA型旋转蒸发器(郑州长城科工贸有限公司);UV-2102C型紫外分光光度计(unico-尤尼柯<上海>仪器有限公司);Nano-ZS90型激光散射粒径分析仪(英国马尔文公司);JY92-!型超声波细胞粉碎机。丹皮酚(洛阳弗林生化研究所,含量为90%);注射级卵磷脂(郑州四维磷脂技术公司);吐温-80;胆固醇;鱼精蛋白(上海第一生化药业有限公司);0.9%氯化钠注射液;无水乙醇、乙醚均为分析纯。
2 方法与结果
2.1 薄膜分散-超声法制备丹皮酚传递体[6]
取处方量的卵磷脂、丹皮酚、胆固醇,用2 mL无水乙醇和8 mL乙醚溶解在50 mL茄形瓶中,用旋转蒸发器减压蒸发30 min,使类脂材料在容器壁上形成均匀的薄膜,再加入处方量的吐温-80,然后在一定温度下用0.9%氯化钠注射液10 mL洗膜、水合1 h,再用超声波细胞粉碎机超声5 min(超声2 s,停3 s,200 W,60次),接着用0.45"m滤膜过滤2次,得乳白色丹皮酚传递体混悬液,密封并于4℃低温下保存。
2.2 丹皮酚普通脂质体制备[7]
取处方量的卵磷脂、丹皮酚、胆固醇,用2 mL无水乙醇和8 mL乙醚溶解,用旋转蒸发器在一定的温度下减压蒸发30 min,使类脂材料在容器壁上形成均匀的薄膜,直接用0.9%氯化钠注射液10 mL洗膜水合1 h。此后制备工艺同2.1项下方法。
2.3 粒径、分布、Zeta电位测定
吸取样品0.8 mL,置测量杯中,于常温下测试,经激光散射粒径分析仪散射后的光在90°范围内变化不同角度检测。
2.4 包封率测定
采用鱼精蛋白沉淀法测定[8]。用移液枪精密吸取0.2 mL传递体悬液于10 mL塑料离心管中,加入10 g/L鱼精蛋白溶液0.2 mL搅匀,静置3 min,加入2.8 mL 0.9%氯化钠注射液,5 000 r/min离心30 min,吸取上清液1 mL于10 mL量瓶中,用无水乙醇定容至刻度。在274 nm波长处,用紫外分光光度计测定吸收度。包封率计算公式为 EE=(1-W游/W总)×100%,EE为包封率,W游为未包封于传递体中的丹皮酚的量,W总为投药量。
2.5 稳定性测定
用同一方法制备一批传递体,在不同条件下(4℃低温和室温)保存放置,并在 1,3,5,10,15,20,30 d 时测定,观察粒径、多分散度和Zeta电位的变化。
2.6 正交试验设计及结果
通过预试验并参考文献[9],选择L9(34)正交设计,考察磷脂与胆固醇的质量比(因素A)、磷脂与吐温-80的质量比(因素B)、磷脂与主药丹皮酚的质量比(因素C)、蒸发水合温度(因素D)等对传递体粒径影响,以确定最佳制备工艺。因素水平表见表1。正交试验结果见表2。可知,各因素对粒径的影响大小依次为因素A、因素B、因素 C、因素 D,各水平对粒径的影响为 A1<A3<A2,B1<B2<B3,C3<C1<C2,D1<D3<D2。

表1 因素水平表

表2 正交试验结果
2.7 投药比对粒径的影响
投药比指投料中磷脂与丹皮酚的质量比。根据正交试验结果,在A1B1的条件下改变投药比,测定传递体粒径。结果见图1。可见,投药比为12∶1时,粒径最大,其后粒径随丹皮酚用量增加而减少。考虑到配方中主药含量过低,可能影响疗效,故综合投药比与粒径两因素,采用磷脂/丹皮酚(mg/mg)为10∶1为宜,优选配方A1B1C1D1。
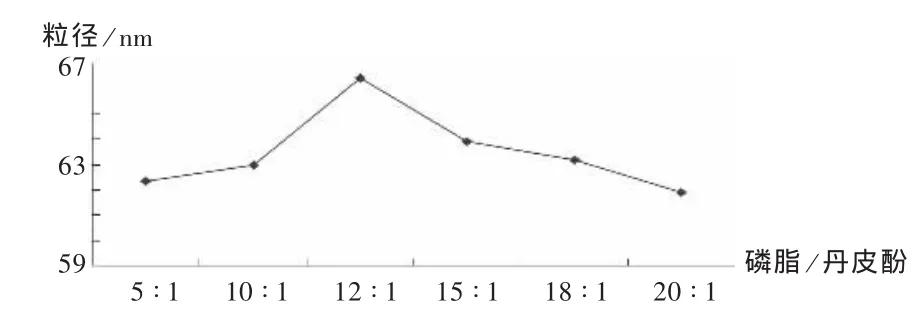
图1 投料比对粒径的影响
2.8 传递体理化特性及包封率测定结果
由表2可见,随着配方中胆固醇用量增加,传递体粒径明显增加。最终按A3B1C1D1配方制备的传递体的平均粒径为89.34 nm,多分散度为0.226,Zeta电位为-1.953 mV。按A1B1C1D1配方制备传递体的平均粒径为62.97 nm,多分散度为0.167,Zeta电位为-2.927 mV。两配方平均粒径相差不大。按A3C1D1制备的普通丹皮酚脂质体的平均粒径为221.8 nm,多分散度为0.316,Zeta电位为-3.355 mV,粒径明显大于传递体粒径。可见,配方中加入表面活性剂可明显减少脂质体粒径。根据相关报道[10],增加胆固醇用量有利于增加包封率。结果显示,包封率按A3B1C1D1配方制备的传递体为44.00%,按A1B1C1D1配方制备的为33.99%,普通脂质体为35.67%。考虑到胆固醇用量对传递体粒径和包封率两方面因素的影响,最终确定最佳配方为A3B1C1D1。
2.9 温度对传递体稳定性影响
按最佳配方A3B1C1D1制得的传递体,在不同温度下保存放置一段时间后测得的粒径、多分散度(PDI)和Zeta电位的变化见表3。可见传递体在4℃低温条件下,粒径、多分散度和Zeta电位在20 d内的变化比较小;在室温条件下,放置10 d,各项参数变化较小,超过10 d粒径迅速增大。这可能与传递体的Zeta电位绝对值较小,不容易产生电位相斥,导致放置时容易聚集,使其粒径明显增大。因此在不加入稳定剂情况下,宜4℃低温保存传递体。
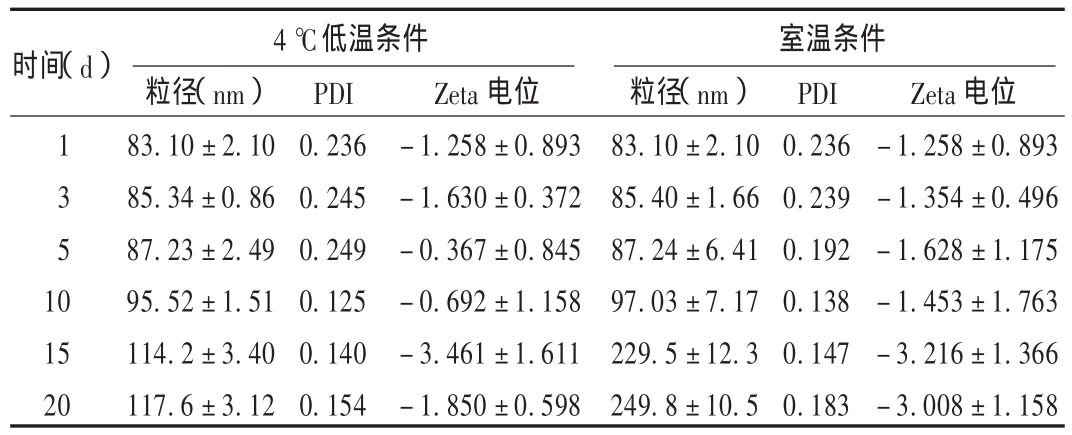
表3 传递体在不同温度下粒径、PDI和Zeta电位随时间变化的结果(n=3)
3 结论
采用薄膜分散-超声法制备丹皮酚传递体方法简单易行,最佳配方为磷脂/胆固醇3∶1、磷脂/吐温-80 2∶1、磷脂/丹皮酚10∶1,水合温度为37℃,低温4℃可长期存放。传递体粒径大小与胆固醇用量有关,随胆固醇用量减少而减少,而传递体的包封率则相反。因此在优选配方时,应根据要求综合两因素,合理选择胆固醇用量。
[1]邢国胜,房德敏,周咏梅.丹皮酚的制备及药理作用研究进展[J].中草药,2006,37(11):附 2- 附 7.
[2]Bu J,Ma PC,Chen ZQ,et al.Inhibition of MITF and Tyrosinase by Paeonol-Stimulated JNK/SAPK to Reduction of Phosphorylated CREB[J].Am J Chin Med,2008,36(2):245-263.
[3]解士海,陈志强.丹皮酚在体外对人黑素细胞酪氨酸酶活性及黑素生成的影响[J]. 中华皮肤科杂志,2006,39(11):639-641.
[4]Elsayed MM,Abdallah OY,Naggar VF,et al.Lipid vesicles for skin delivery of drugs:Reviewing three decades of research[J].Science Direct,2007,332(1-2):1-16.
[5]Lee EH,Kim A,Oh YK,et al.Effect of edge activators on the formation and transfection efficiency of ultradeformable liposomes[J].Biomaterials,2005,26(2):205-210.
[6]Trotta M,Peira E,Carlotti ME,et al.Deformable liposomes for dermal administration of methotrexate[J].Int J Pharm,2004,270(1-2):119-125.
[7]穆莜梅,钟振声.化妆品用果酸脂质体的制备研究[J].日用化学工业,2002,32(5):27-29.
[8]孙维彤,黄桂华,叶杰胜,等.鱼精蛋白凝聚法测定脂质体和纳米脂质体包封率[J]. 中国药学杂志,2006,41(22):1 716-1 720.
[9]Cevc G,Schatzlein A,Blume G.Transdermal drug carrier:basle properties,optimization and transfer efficiency in the case of epicutaneouslyapl pliedpepides[J].J Control Release,1995,36(12):3-9.
[10]郭海燕,莫穗林.脂质体物理稳定性和包分率的影响因素[J].中国新药杂志,2004,13(6):498-501.
Preparation and Stability of Paeonol Transfersome
Li Zhi,Hu Haiying,Wang Pan
(College of Pharmacy,Zhengzhou University,Zhengzhou,Henan,China 450001)
TQ461
A
1006-4931(2010)01-0029-02
李志(1977-),女,河南郑州人,讲师,硕士研究生,(电子信箱)Bianca@zzu.edu.cn。
2009-02-19)
