牙槽嵴种植牵张器-骨三维有限元模型的构建
2010-09-10惠光艳贾文敏
仇 敏,惠光艳,贾文敏
各种原因引起牙颌部分或全部缺失后,牙槽嵴将发生不同程度的吸收萎缩,破坏义齿固位和稳定,难以取得良好的修复效果。对于种植义齿修复,由于植入区骨量不足,难以容纳种植体,即使勉强植入,过大冠根比也常导致种植义齿松动[1]。萎缩的牙槽嵴要进行修复治疗必须行牙槽嵴增高术以满足必要的修复条件。近年来,牵张成骨(distraction osteogenesis,DO)技术在牙槽外科得到广泛应用,有望成为一种理想的牙槽嵴增高技术。本研究试图建立牙槽嵴种植牵张器-骨复合体三维有限元模型以模拟牙槽嵴种植牵张器所处的生物力学环境,为进一步了解其生物力学特性提供基础。
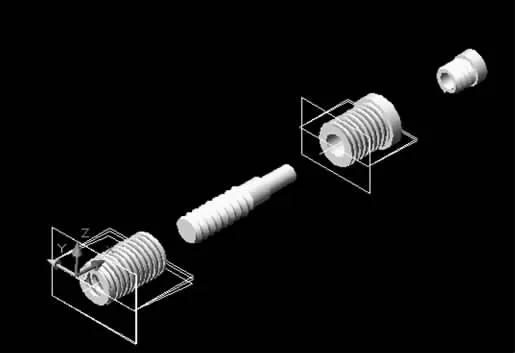
图 1 牵张种植体分解视图
1 材料和方法
1.1 软硬件环境 硬件为电脑1台,配置如下:CPU:AMD Athlon AM2 3800+x2;RAM:2G; Harddisk:Seagate 200G;Video Card:Nvidia 6600GT。 软 件 :AutoDeskMechanicalDesktop2004DX中文版(AutoDesk 公司),ANSYS Workbench 10.1(ANSYS公司),运行于Windows XP环境下。
1.2 牙槽嵴种植牵张器模型设计 本研究选用由何黎升等设计的种植体型牙槽嵴牵张器,全长
11.0 mm,设计牵张全程为16.0 mm,直径3.7 mm,螺距0.7 mm,螺纹深0.25 mm。具体结构及外形数据见文献[2]化模型需要,将牵张器分解为两部分,即基骨段和输送段。
运行MDT2004软件,通过定义并约束轮廓截面的方法获得未添加螺纹的零件原始模型,继而采用定义三维螺旋扫略路径的方法运用扫略、零件布尔运算等软件操作技术分别获得输送段及基段牵张器CAD模型。打开零件装配增强控制器,为输送段和基段添加三维装配约束,使两者连接,螺纹吻合紧密。得到该牵张器的CAD模型,分解视图见图1。
1.3 骨段模型设计 绘制下颌骨骨段模型。模型近远中向长10 mm,高15 mm,颊舌向宽10 mm。除近远中面外,外层均被覆1.2 mm厚密质骨,内层为松质骨构成。模型通过参数化建模方式获得,各项数据均可调整并自动更新模型。
1.4 牙槽嵴牵张器-骨复合体CAD模型的生成利用零件布尔运算功能,以生成的牵张器模型切削萎缩段骨模型中心位置,以模拟种植窝的制备。采用零件分割技术将萎缩段近咬合面部分骨质切开,形成 8 mm(近远中)×10 mm(颊舌向)×5 mm(高度)大小之游离骨段以模拟牵张中的矩形截骨术;继而利用零件装配增强控制器将牵张器模型植入种植窝中,使基段和输送段的分界线位于前述的截骨线上,最终建立牙槽嵴牵张器-骨复合体CAD模型。图2示牵开1 mm时的骨-牵张器复合体CAD模型。

图 2 输送段被牵开1 mm时骨-种植牵张器复合体CAD模型
1.5 牙槽嵴牵张器-骨复合体三维有限元模型的生成 运行ANSYS Workbench 10.1软件将MDT 2004所生成的CAD模型导入,即生成牙槽嵴牵张器-骨复合体三维有限元模型。通过在MDT软件中使用增强零件操纵器调整输送段骨和牵张器的位置,可模拟牵张进行的各个阶段。图3示牵开1 mm时的骨-牵张器复合体有限元模型。
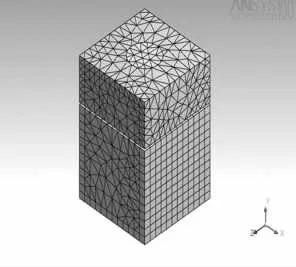
图 3 输送段被牵开1 mm时骨-种植牵张器复合体有限元模型
1.6 材料力学特性与加载约束 本实验设定骨组织为Ⅲ类骨质,为简化模型,假设模型中骨和种植体均为连续、均质和各向同性的线弹性材料,各部分力学参数见表1[1]。设定牵张开始前及进行中时,牵张器与骨之间关系为紧密接触并可做少许滑动。约束条件设定为基骨段近远中面施加刚性约束。

表 1 有关组织和材料的力学参数
2 结果
三维有限元模型具有良好的形态,牵张器模型质量好,无零件间相互干涉,螺纹密合。对牵张过程的模拟与临床所见类似。
3 讨论
与骨移植术、膜引导组织再生术、羟基磷灰石牙槽嵴重建术等常规牙槽嵴增高方式相比,DO技术具有诸多优点:创伤较小,不需开辟第二术区;组织兼容性好,不存在生物相容性问题;牵张过程中软组织和骨组织得到同步增加,术后牙槽嵴软硬组织外形恢复好,且不易吸收,便于种植和修复治疗。牵张成骨是一个骨愈合和再生的过程,力学环境对相关连接组织的材料形态和结构强度的维持、修复和再生具有关键作用。牵张能否成功,不仅有赖于在骨切开时最大限度地保留骨膜和血供、有足够的时间形成修复性骨痴、适宜的牵张速度和频率以及合适的固定期等生物学因素,还取决于生物力学因素[3]。
机体组织在缓慢、有规律、稳定的牵引力作用下可产生张力,刺激和保持骨组织结构的再生和生长,使牵张区内细胞增生、生物合成功能被激活。由于牵张间隙是逐渐、缓慢增加的,间隙内组织所受张力小于快速牵引时的应力,此时,周围骨膜、筋膜、神经、肌肉、血管、皮肤和肌腱等软组织就会发生对应力的适应性反应。张应力的效应首先是粘弹性材料的抗屈服特性,然后是骨周软组织顺应牵引速度与距离的力学效应,最后出现由此造成的间隙内骨组织的增殖反应,这是DO的生物力学基础。组织界面的应力传导和分布,是DO过程中一个重要研究方面[4],牵张器就位后,其界面上应力分布合理与否将直接影响成骨的方向与连续性。虽然学者们通过动物实验进行了研究,但是动物模型与人牙槽嵴萎缩患者的真实情况有较明显的区别。目前,大多数动物模型是通过拔牙并辅以牙槽嵴修整术模拟,其缺损部位的下颌骨牙槽嵴除高度丧失外,没有结构的明显变化。而根据文献报道,有齿下颌骨,无齿下颌骨及缺牙区下颌骨的形态及内部结构均存在差异。因此,其实验结果与牙槽嵴萎缩真实情况有一定差异。临床应用中,由于对骨组织应力的改变不甚明了,不可避免出现一些并发症。因此,明确牵张器这一特殊种植体植入萎缩牙槽嵴后的生物力学特性对ARA的临床应用有指导意义。
作为一种重要的理论应力分析发法,有限元法最基本、最重要的步骤就是建立有限元模型[5],将直接影响分析结果的准确性与信度。由于相对规则的种植体几何外形以及相对较小的研究范围,在目前的牙种植体有限元研究中非实体建模法逐渐占据了主流。该方法将种植体和颌骨几何外形做一定简化后,直接利用计算机辅助设计软件绘制生成模型。与利用活体或离体颌骨并通过磨片、CT扫描等予以数字化的实体建模法相比,所需设备简单,大大减轻了工作量,并可满足种植体骨界面应力分析的要求。对于种植牵张器-骨复合体模型来说,由于矩形截骨术使骨模型被一分为二,牵张器结构也远较种植体为复杂,模型计算量大大增加,因而更适用于非实体法建模。由于正常及异常牙槽嵴临床表现不同,个体差异明显,因而利用CT等影像手段获得的模型分析结果往往缺乏足够的代表性,难以全面说明问题。本研究利用CAD软件简化模型,是目前广泛应用的建模方法[6]。
与种植体有限元研究中加载和约束设定的条件不同,种植体型牵张器在牵张阶段通常不承受咬合力,患者因术区疼痛不适,一般较少给予机械性刺激。牵张过程中,输送骨段主要受到来自下方被牵拉而伸长的无定型基质的拉力以及来自表面覆盖口腔黏膜等软组织的张力。牵张器植入后到牵张开始通常只有5~7 d的原位固定期,无法发生种植体的骨结合,故设定骨和牵张器紧密接触,并可出现少许滑动。
利用本方法生成的有限元模型,在模型装配控制器的控制下,可模拟牵张进行的各个时期,通过对各不同阶段模型的加载分析,可以获得牵张进行过程中不同时期的生物力学参数,这将是本实验的后续研究。
综上所述,可见通过CAD和FEA软件的结合,能建立外形逼真,网格适当,图像还原好,且能够从力学上代表实物的牙槽嵴种植牵张器骨复合体有限元模型。
[1]Maezawa N,Shiota M,Kasugai S.Three-dimensional stress analysis of tooth/lmplant-retained long-span fixed dentures.Int J Oral Maxillofac Implants,2007,22(5):710-8.
[2]王 桥,何黎升,赵晋龙,等.种植型骨牵张器的初步实验研究.实用口腔医学杂志,2001,17(4):309-31.
[3]Veziroglu F,Yilmaz D.Biomechanical evaluation of the consolidation period of alveolar distraction osteogenesis with threedimensional finite element analysis.Int J Oral Maxillofac Surg,2008,37(5):448-52.
[4]Boccaccio A,Prendergast PJ.Tissue differentiation and bone regeneration in an osteotomized mandible:a computational analysis of the latency period.Med Biol Eng Comput,2008,46(3):283-98.
[5]Boccaccio A,Lamberti L,Pappalettere C.Mechanical behavior of an osteotomized mandible with distraction orthodontic devices.J Biomech,2006,39(15):2907-18.
[6]Basciftci FA,Korkmaz HH,Iseri H.Biomechanical evaluation of mandibular midline distraction osteogenesis by using the finite element method.Am J Orthod Dentofacial Orthop,2004,125(6):706-15.
