糙苏素的抗肿瘤作用及机制研究Δ
2010-09-10谢文利万宗明赵艳威武警医学院药理学教研室天津市300162
谢文利,朱 江,万宗明,赵艳威(武警医学院药理学教研室,天津市 300162)
糙苏素的抗肿瘤作用及机制研究Δ
谢文利*,朱 江,万宗明,赵艳威(武警医学院药理学教研室,天津市 300162)
目的:研究糙苏素的抗肿瘤作用及其对端粒酶活性和细胞周期的影响。方法:采用血清药理学与体内、外抑瘤实验相结合的方法,MTT法检测糙苏素含药血清对体外培养的人白血病K562细胞增殖的抑制作用,聚合酶链反应-酶联免疫吸附法检测K562细胞在糙苏素作用后端粒酶活性的变化,流式细胞仪分析细胞周期的改变;体内实验采用小鼠肝癌H22细胞株接种小鼠,连续给药14 d,计算抑瘤率。结果:糙苏素含药血清在10%~50%剂量范围内对K562细胞有抑制作用,且呈剂量依赖关系(P<0.05);糙苏素作用后端粒酶活性出现抑制,且各给药组随糙苏素浓度增加抑制作用显著增强(P<0.01),同一浓度随作用时间延长,抑制作用逐渐增强(P<0.05);K562细胞的DNA合成后期/分裂期(G2/M)细胞含量显著增高(P<0.01);糙苏素(2.5、5、10 mg·kg-1)灌胃能显著抑制小鼠移植性肝癌H22细胞的生长。结论:糙苏素具有抗肿瘤作用,其作用是通过抑制肿瘤细胞的端粒酶活性而实现的。
糙苏素;端粒酶;肿瘤细胞
糙苏素(phlomio1)为唇形科(Labiete)糙苏属(Phlomis)植物螃蟹甲中的一种环烯醚萜苯类成分。现代药理研究表明,植物中许多环烯醚萜苷类化合物有抗炎、抗肿瘤、抗氧化和抗菌等活性[1],因此我们推测糙苏素可能具有抗肿瘤作用。端粒酶的激活可以维持端粒的长度并使细胞获得无限增殖能力而逃避死亡。近年来,许多研究发现绝大部分肿瘤都呈端粒酶阳性,提示端粒酶在肿瘤的发生、发展过程中起着重要作用。本文对糙苏素的抗肿瘤作用及对端粒酶和细胞周期的影响进行探讨。
1 仪器与材料
1.1 仪器
DG3022A型酶标仪(瑞士Tecan公司);ProfileⅡ型流式细胞仪(美国Coulter公司);LDZ4型台式高速离心机(德国Eppendorf公司);TS100型倒置显微镜(日本Nikon公司)。
1.2 试药
糙苏素(中国药品生物制品检定所,批号:100641-200401);端粒酶-PCR-ELISA检测试剂盒(美国Boehringer Mannheim公司,批号:20071105);MTT(美国Sigma公司,批号:071055)。
1.3 动物、细胞株及动物瘤株
健康ICR小鼠40只,♂♀兼半,体质量(21±4.6)g,北京维通利华实验动物中心提供(动物生产许可证号:SCXK(京)2002-0003)。人白血病细胞K562细胞株,由中国医学科学院药物研究所提供。动物移植性肿瘤小鼠H22细胞,由天津医药科学研究所提供。
2 方法
2.1 实验血清制备
按文献方法[2]制备2组实验血清,即无药血清和含药血清组。每组取大鼠6只,♂♀兼半。实验前禁食不禁水18 h,含药血清组ig糙苏素溶液,剂量为100 mg·kg-1;无药血清组ig等容积生理盐水,每天2次,连续3 d。末次给药2 h后乙醚麻醉,眼眶静脉无菌采血。收集的全血以2 500 r·min-1离心15 min,取血清,合并同组血清后,经56℃水浴、30 min灭活,放入-20℃冰箱中贮藏,备用。
2.2 糙苏素含药血清对体外培养的K562细胞的抑制作用
方法[3]进行细胞复苏、传代,消化并计数,细胞数为1×104个·mL-1。接种于96孔板上,置于37 ℃、5%CO2培养箱中培养24 h。细胞分为空白对照(50%)和糙苏素含药血清高、中、低浓度(50%、20%、10%)组。每孔加入100 μL相应浓度药物或空白培养基,做4复孔。相同条件继续培养48 h。终止培养前4 h加入20 mL MTT,培养结束后,离心去除上清液,每孔加入200 μL二甲基亚砜,振荡器混匀,在酶标仪上于490 nm波长处测定溶液吸光度(OD)值。
2.3 糙苏素对小鼠H22肝癌的生长抑制作用
采用常规方法[4],分别设对照(ig,等量生理盐水)、环磷酰胺(ip,100 mg·kg-1)和糙苏素高、中、低剂量(ig,10、5、2.5 mg·kg-1)组。各组于接种次日开始每天给药1次,连续给药10 d。
2.4 端粒酶活性测定
分组同“2.2”项下方法操作。K562细胞接种于100 mL培养瓶中至对数生长期,分别加入浓度为10%、20%、50%的糙苏素含药血清作用48、72 h,空白对照组加等量培养液。分别收集不同浓度糙苏素作用后不同时间点的细胞(105个),加入500µL磷酸盐缓冲液(PBS)洗涤,4℃下3 000 r·min-1离心10 min,弃上清,沉淀加适量细胞裂解液悬浮,置冰浴30 min,4℃下14 000 r·min-1离心20 min,吸取上清于-70℃贮藏,备用。采用Kim NW等[5]的改良聚合酶链反应-酶联免疫吸附法进行测定,操作步骤均按试剂盒说明书进行。
2.5 细胞周期分析
参考文献方法[6]分别收集10%、20%、50%的糙苏素含药血清作用72 h和未处理的K562细胞,用PBS清洗2次,再用预冷无水乙醇700 mL·L-1固定,4℃贮藏。检测前离心去除乙醇,碘化丙啶染色20 min,于流式细胞仪测定细胞周期中不同时相的细胞数。
2.6 统计学方法
实验数据采用SPSS11.0软件进行分析,2组间比较采用t检验,多组间比较行方差分析和q检验。
3 结果
3.1 糙苏素含药血清对体外培养的K562细胞的抑制作用
糙苏素对K562细胞均具有抑制作用,且在浓度为10%~50%范围内抑制作用呈剂量依赖性(P<0.01或P<0.05)。糙苏素含药血清对K562细胞的抑制作用见表1。
表1 糙苏素含药血清对K562细胞的抑制作用(±s,n=4)Tab 1 Inhibitory effect of serum containing phlomiol on the growth of K562 tumor cell(±s,n=4)

表1 糙苏素含药血清对K562细胞的抑制作用(±s,n=4)Tab 1 Inhibitory effect of serum containing phlomiol on the growth of K562 tumor cell(±s,n=4)
与空白对照组比较:*P<0.05,**P<0.01vs.blank control group:*P<0.05,**P<0.01
组别空白对照组糙苏素含药血清低浓度组糙苏素含药血清中浓度组糙苏素含药血清高浓度组环磷酰胺组OD值0.83±0.11 0.62±0.17*0.43±0.12**0.25±0.03**0.21±0.03**
3.2 糙苏素对小鼠H22肝癌的生长抑制作用
实验过程中可观察到糙苏素高、中、低剂量和环磷酰胺组小鼠饮食饮水正常、皮毛柔顺光滑、活动自如,生活质量明显优于对照组小鼠。各组间小鼠体质量增加无显著差异(P>0.05)。同时,高、中、低剂量糙苏素对肿瘤具有抑制作用(P<0.01或P<0.05),抑制强度呈剂量依赖性。糙苏素对小鼠H22肝癌的生长抑制作用见表2。
3.3 糙苏素含药血清对端粒酶活性的影响
10%的糙苏素含药血清作用48 h后端粒酶活性出现抑制,且各给药组随糙苏素浓度增加抑制作用显著增强(P<0.01);同一浓度随作用时间延长,抑制作用逐渐增强(P<0.05)。糙苏素含药血清对端粒酶活性的影响见表3。
3.4 糙苏素含药血清对细胞周期的影响
采用10%、20%、50%的糙苏素含药血清作用72h后的K562细胞的G2/M期细胞数所占百分比均明显提高(P<0.01或P<0.05),20%糙苏素含药血清组与50%糙苏素含药血清组比较无显著差异(P>0.05)。糙苏素含药血清对细胞周期的影响见表4。
表2 糙苏素对小鼠H22肝癌的生长抑制作用(±s,n=8)Tab 2 Inhibitory effect of phlomiol on the growth of mice hepatic cancer H22 cell(±s,n=8)
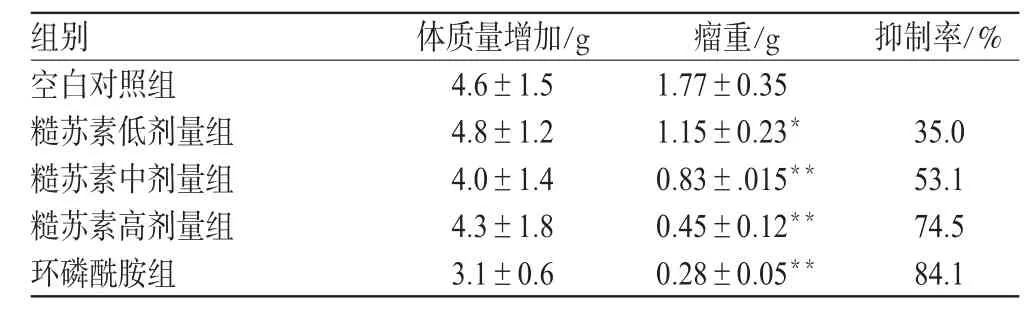
表2 糙苏素对小鼠H22肝癌的生长抑制作用(±s,n=8)Tab 2 Inhibitory effect of phlomiol on the growth of mice hepatic cancer H22 cell(±s,n=8)
与空白对照组比较:*P<0.05,**P<0.01 vs.blank control group:*P<0.05,**P<0.01
抑制率/%组别空白对照组糙苏素低剂量组糙苏素中剂量组糙苏素高剂量组环磷酰胺组体质量增加/g 4.6±1.5 4.8±1.2 4.0±1.4 4.3±1.8 3.1±0.6瘤重/g 1.77±0.35 1.15±0.23*0.83±.015**0.45±0.12**0.28±0.05**35.0 53.1 74.5 84.1
表3 糙苏素含药血清对端粒酶活性的影响(±s,n=4)Tab 3 Effect of serum containing phlomiol on the activity of telomeras(e±s,n=4)
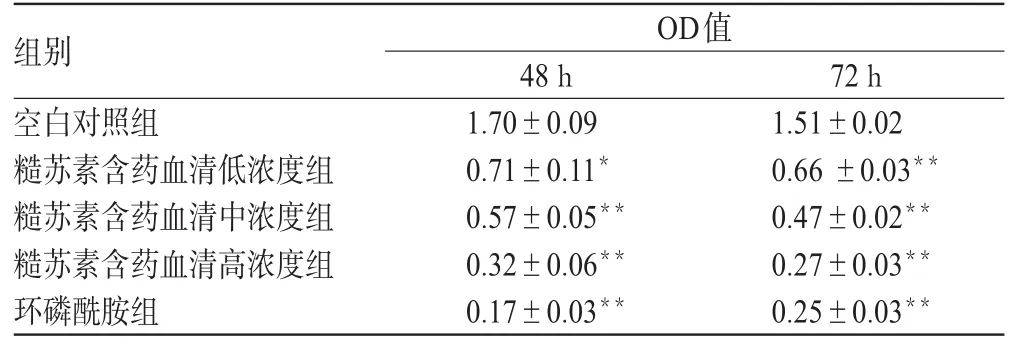
表3 糙苏素含药血清对端粒酶活性的影响(±s,n=4)Tab 3 Effect of serum containing phlomiol on the activity of telomeras(e±s,n=4)
与空白对照组比较:*P<0.05,**P<0.01vs.blank control group:*P<0.05,**P<0.01
组别空白对照组糙苏素含药血清低浓度组糙苏素含药血清中浓度组糙苏素含药血清高浓度组环磷酰胺组OD值48 h 1.70±0.09 0.71±0.11*0.57±0.05**0.32±0.06**0.17±0.03**72 h 1.51±0.02 0.66 ±0.03**0.47±0.02**0.27±0.03**0.25±0.03**
表4 糙苏素含药血清对细胞周期的影响(±s,n=4)Tab 4 Effect of serum containing phlomiol on cell cycle(±s,n=4)

表4 糙苏素含药血清对细胞周期的影响(±s,n=4)Tab 4 Effect of serum containing phlomiol on cell cycle(±s,n=4)
与空白对照组比较:*P<0.05,**P<0.01vs.blank control group:*P<0.05,**P<0.01
组别空白对照组糙苏素含药血清低浓度组糙苏素含药血清中浓度组糙苏素含药血清高浓度组环磷酰胺组K562细胞的G2/M期细胞数所占百分比/%19.1±1.5 43.3±4.5*62.5±6.4**58.1±4.2**60.9±3.2**
4 讨论
糙苏属植物在全球约有100种以上,在我国,糙苏属植物多作药用,中医学、民族医学的药性理论认为本属植物具有理气健脾、清热解毒、消肿止痛、祛风活络、活血调经、止咳化痰之功效,广泛用于治疗消化不良、筋骨疼痛、疮疥肿毒、咳嗽痰多、感冒发热、风湿性关节炎、肺炎、支气管炎等疾病[7]。糙苏素为糙苏属植物螃蟹甲中的一种环烯醚萜类成分,该成分很可能就是糙苏属植物治疗“疮疥肿毒”的主要药理基础,即抗肿瘤作用的主要成分[8]。
笔者采用体内、体外2种方法对糙苏素的抗肿瘤作用及其机制进行了初步研究,其中体外实验采用了血清药理学的方法,它排除了传统中药体外实验中中药本身的理化性质对实验的干扰,又能反映药物在体内的生物转化过程及其作用结果[9]。近年来,中药抗肿瘤分子机制的研究主要集中在诱导凋亡、诱导分化、端粒酶抑制、微管蛋白活性抑制等方面,笔者选择的是端粒酶活性测定及细胞周期分析的方法。端粒酶特异性地表达于各种肿瘤细胞,又是肿瘤细胞无限增殖能力所必需,那么,理论上端粒酶的抑制可能导致肿瘤细胞生长停止或死亡[10]。
研究结果表明,糙苏素含药血清体外可以抑制细胞生长,具有抑制K562细胞端粒酶活性的作用,而且该作用具有时间和剂量依赖性;采用流式细胞仪进行细胞周期分析表明,端粒酶活性被抑制72 h后,K562细胞增殖也出现障碍,将49.3%以上的K562细胞阻滞在G2/M期,结果表明,端粒酶活性依赖于细胞所处的分裂周期的时相。体内实验中,荷瘤小鼠ig糙苏素可以使H22肿瘤显著抑制。总之,糙苏素体内、外均有抗肿瘤作用,糙苏素对肿瘤细胞的抑制和细胞周期阻滞作用可能与端粒酶抑制有关。
参考文献
[1]边巴次仁,旺 姆,魏 锋,等.藏药螃蟹甲挥发油化学成分的GC-MS分析研究[J].中国中药杂志,2003,37(12):904.
[2]金龙男,孙 抒,杨万山,等.蛴螬提取物抗肿瘤作用的体外血清药理学实验[J].山东医药,2008,48(1):31.
[3]赵明宏,郭 涛,王敏伟,等.钩吻中非生物碱不同组分体内、外抗肿瘤作用比较研究[J].中国药房,2006,17(23):1 776.
[4]王 茜,杨柳萌,郑永唐.天然产物中的HIV-1非核苷类逆转录酶抑制剂[J].中草药,2003,34(4):381.
[5]Kim NW,Wu F.Advances in quantification and characterization of telomerase activity by the telomeric repeat amplification protocol(TRAP)[J].Nucleic Acids Res,1997,25(13):2 595.
[6]陈鸿雁,王 驰,舒 艳,等.苦参碱与3种抗肿瘤药物联合作用对KBV200耐药细胞株细胞周期的影响[J].中国药房,2006,17(7):500.
[7]Ismailoglu UB,Saracoglu I,Harput US,et al.Effects of phenylpropanoid and iridoid glycosides on free radical-induced impairment of endothelium-dependent relaxation in rat aortic rings[J].J Ethnopharmacol,2002,79(2):193.
[8]邓瑞雪,李军波,刘 普,等.糙苏属植物苷类活性成分及药理研究进展[J].海峡药学,2009,21(1):4.
[9]顾琳娜,顾 昊.天然抗肿瘤药物筛选方法的研究进展[J].医药导报,2009,28(4):496.
Anti-tumor Effect of Phlomiol and Its Mechanism Study
XIE Wen-li,ZHU Jiang,WAN Zong-ming,ZHAO Yan-wei(Dept.of Pharmacology,Medical College of Chinese Armed Police Force,Tianjin 300162,China)
OBJECTIVE:To study the anti-tumor effect of phlomiol,and its influences on the activity of telomerase and cells phases.METHODS:Serologic pharmacological method,in vivo and in vitro anti-tumor experiments were adopted in the study.The inhibition effect of serum containing phlomiol on the proliferation of K562 tumor cells in vitro were detected by MTT method.The activity of telomerase in K562 tumor cell was determined by TRAP-PCR-ELISA.Flow cytometry was used to analyze the change of cell cycle.In vivo experiment,mice was inoculated with hepatic cancer H22 cells and the mice were orally administrated with phlomiol for 14 days.The inhibition rate of tumor was caculated.RESULTS:Serum containing 10%~50%phlomiol inhibited the proliferation of K562 tumor cells in vitro in dose-dependent manner(P<0.05).Phlomiol inhibited the activity of telomerase in K562 tumor cells.The inhibition effect was in dose-dependent manner(P<0.01).Meanwhile the inhibition effect increased gradually when the action time extended in the same dose of phlomiol group(P<0.05).The content of cell in K562 tumor cells were markedly increased in G2/M phase(P<0.01).Phlomiol(2.5,5,10 mg·kg-1,i.g)inhibited the growth of implanted hepatic cancer H22 cells signiflcantly.CONCLUSION:The anti-tumor activity of phlomiol is performed by inhibiting the activity of telomerase in tumor cells.
Phlomiol;Telomerase;Tumor cells
R285;R94
A
1001-0408(2010)39-3653-03
2009-12-07
2010-04-18)
