邻苯二甲酸酯对浅层含水层沉积物微生物多样性的影响
2010-09-09施霞珍中国地质大学武汉生物地质与环境地质教育部重点实验室湖北武汉430074
吴 琼,刘 慧,张 丹,施霞珍 (中国地质大学(武汉),生物地质与环境地质教育部重点实验室,湖北 武汉430074)
邻苯二甲酸酯对浅层含水层沉积物微生物多样性的影响
吴 琼,刘 慧*,张 丹,施霞珍 (中国地质大学(武汉),生物地质与环境地质教育部重点实验室,湖北 武汉430074)
在模拟浅层地下水低温、缺氧的环境条件下,利用BIOLOG ECO微平板法研究了经不同浓度邻苯二甲酸正丁酯(DBP)处理的江汉平原浅层含水层沉积物中微生物的数量、整体活性、多样性指数以及代谢功能多样性.结果表明,微生物的数量、整体活性随DBP浓度不同有差异;丰富度指数、Shannon指数与对照相比差异均不显著,而Simpson指数和McIntosh指数差异显著.低浓度DBP(<400mg/kg)可以抑制部分微生物的生长,而促进与DBP代谢有关的微生物活性;高浓度DBP(796mg/kg)则抑制了微生物数量,破坏物种的均一度,最终导致沉积物中微生物功能多样性发生改变而产生代谢变异性.
邻苯二甲酸正丁酯(DBP);浅层含水层;微生物多样性;BIOLOG
Abstract:Impact of di-n-butyl phthalate (DBP), an endocrine-disrupting chemical, on microbial community diversities and activities in shallow aquifer sediments in Jianghan plain were investigated in batch cultures via BIOLOGECO microplates. Sediments were amended with different concentrations of DBP varied from 0 to 796mg/kg and incubated under a condition of hypothermia-hypoxia which was commonly found in subsurface aquifer. Average well colour development (AWCD) was measured with mircosation biolog periodically. It was observed that the microbial populations and activities varied with DBP concentrations. With the variation of DBP concentrations no obvious difference was detected among the richness (R) and Shannon’s index (H), while remarkable differences was found among the Simpson’s indices and McIntosh’s indices of the control and sediments amended with DBP (P<0.05). The microbial activity which might potentially related to DBP degradation was enhanced by DBP with low concentration (<400mg/kg). However, with higher concentrations, (≥796mg/kg), DBP grossly inhibited microbial growth and metabolism as manifested by the reduction in microbial count, and destabilized the natural balance of microbial communities.
Key words:di-n-butyl phthalate (DBP);shallow aquifer;microbial diversity;BIOLOG
地下水通常温度较低,营养物质缺乏,微生物种类和数量少[1].邻苯二甲酸酯类化合物(PAEs)是一类环境内分泌干扰物.研究表明,PAEs广泛存在于地下水中[2-5].然而,关于PAEs在地下水环境中能否被微生物降解以及其对地下水环境介质中的微生物多样性有何影响至今还缺乏足够的研究.本研究以江汉平原第四系浅层含水层沉积物为研究对象,在模拟浅层地下水低温缺氧的环境条件下采用BIOLOG ECO微平板法测定了该沉积物中微生物种群对邻苯二甲酸正丁酯(DBP)污染的响应,旨在揭示DBP在浅层含水层环境中对微生物生长及多样性的影响,为地下水的保护和污染修复提供理论依据.
1 材料与方法
1.1材料
供试的含水层沉积物样品取自武汉市蔡甸区奓山镇檀树村(30°28′19″N/113°59′13″E),采样点深度为地下2.2m,样品颜色为灰褐色,有较软结块.样品pH值为6.80,含水率22.17%,有机碳含量5.9g/kg.采集的沉积物样品盛装于不锈钢锅中,密封,置于4℃冰箱中保存,一周内开展实验.
DBP购于天津市恒兴试剂制造有限公司,分析纯.
1.2实验设计
称取5份相当于25g 烘干样品的新鲜沉积物样品于100mL小口玻璃瓶中,分别加入0,2.4,5, 10,19mg DBP和25mL无菌去离子水,使沉积物样品中DBP含量分别为0,96,200,400,796mg/kg.聚四氟乙烯材料封口后在18℃下振荡8h (200r/min),然后在供氧受限条件下(图1)18℃避光静置培养,并在不同时间内取样测定微生物数量及其多样性的变化.

图1 微生物富集培养示意Fig.1 The schematic diagram of microbial enrichment
1.3微生物的计数
培养13d后,将样品瓶从恒温培养箱中取出,在18℃下摇30min(200r/min).静置2min后分别取上层1mL,用无菌磷酸缓冲液(0.145mol/L, pH7.0)稀释,摇匀,冰浴1min得到1:10的提取液,同理逐级稀释得到1:100、1:1000的提取液.分别将提取液涂布于牛肉膏蛋白胨培养基平板,在(30±1)℃下培养18h,纪录并计算微生物的数量.
1.4BIOLOG测试
将BIOLOG ECO板(Biolog Inc., Hayward, CA, USA)从4℃的冰箱中取出,预热到25℃.将1:1000提取液接种到ECO板上,接种量为150 µL,每样一板(3次重复),将接种好的ECO板加盖在供氧受限条件下(碱性焦性没食子酸法[6]) (30± 1)℃下培养21d,并分别于0,24,48,72,96,120,144, 168,192,240,312,384,456,504h在Microstation-Biolog板读数仪(BIO-TEK Instruments INC,USA)上测定吸光度,测定波长分别为590,750nm.测试在生物地质与环境地质教育部重点实验室地微生物实验室完成.
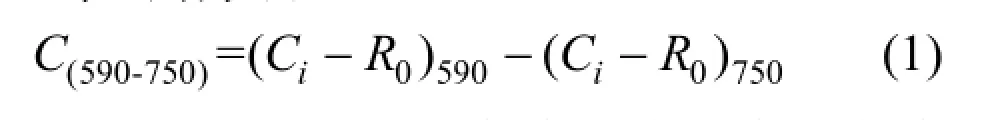
ECO板的96个单孔颜色值计算采用Classen等[7]的方法.式中: Ci为BIOLOG ECO板各反应孔在相应波下的光密度值(OD);R0为对照孔的在相应波长下的OD,其中数值小于0.06时按0处理[7];
平均吸光值(AWCD)的计算按照Garland等的方法[8].式中: 31为BIOLOG ECO板上供试碳源的种类数.

1.5多样性指数应用模型
根据数据筛选原则[9-11],本实验采用培养时间为312h时的数据来评价微生物多样性.根据相关文献[12-13]计算Shannon指数、Simpson指数 和McIntosh指数.其中在计算Simpson指数时,数据扩大了1000倍以防止出现负数.
1.6数据处理方法
所有数据采用Microsoft Excel 2003、Origin 8.0处理.
2 结果与讨论
2.1DBP对含水层沉积物中微生物数量的影响
方差分析表明,不同浓度DBP处理的沉积物样品中微生物数量彼此之间差异极显著(P<0.01).由图2可见,低浓度(96,200mg/kg)和高浓度(796mg/kg)的DBP使沉积物中微生物数量均低于对照,而400mg/kg的DBP使微生物数量增加.该结果表明,DBP的加入可能抑制了沉积物中某些微生物的活性,但促进了另外一些与DBP代谢有关的微生物活性,如以DBP为碳源的微生物和与其产生共代谢过程的微生物.在一定浓度范围内(96~400mg/kg)该类微生物随着DBP浓度的增加数量增多,在400mg/kg时达最大值.当DBP浓度高达796mg/kg时,DBP对该类或其中部分微生物产生毒副作用,致使微生物数量急剧下降[14].
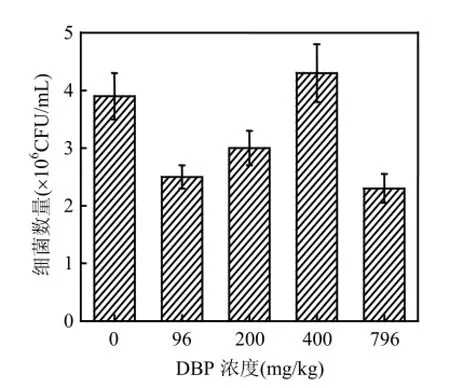
图2 培养13d后不同DBP浓度处理下浅层含水层沉积物中细菌数量Fig.2 Bacterial counts of shallow aquifer sediments amended with different concentrations of DBP after 13 d incubation
2.2DBP对微生物整体活性的影响
由图3可知,不同浓度DBP处理的浅层含水层沉积物中微生物群落AWCD值在整个培养期间差异比较明显.在0~196h之间,DBP处理过的沉积物中微生物的AWCD均高于对照.196h至培养结束(504h),796 mg/kg DBP处理的微生物的AWCD均最低,其他3个浓度下AWCD值随浓度增大而增大,且依次高于对照.该结果表明,一定浓度范围内的DBP(≤400mg/kg)使沉积物整体微生物的活性增强,而高浓度的DBP (796mg/kg)则抑制了整体微生物的活性.
Garland等[8,15]认为土壤微生物群落ELISA速度和最终能达到的程度与群落能利用单一碳底物的微生物数目和种类有关,因此对照和不同浓度DBP处理的沉积物中微生物群落组成上可能是不同的.陈中云等[16]研究了多种内分泌干扰物如多菌灵、丁草胺、呋喃丹等对土壤微生物的活性影响,结果表明同一种内分泌干扰物在低浓度时刺激了某种微生物的活性,浓度过高时则对该微生物具有明显的抑制作用.
本研究中低浓度的DBP(96,200mg/kg)虽减少了整体微生物的数量,但却增强了整体微生物的活性,说明DBP刺激了其中某些微生物的活性,而高浓度的DBP(796mg/kg)则抑制了该类微生物的活性.
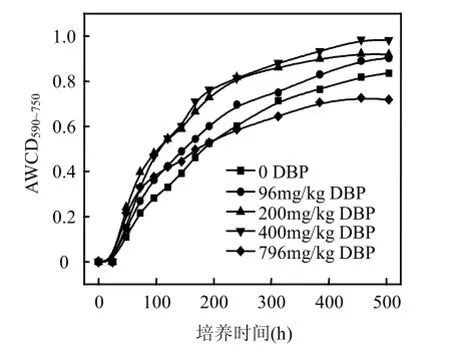
图3 浅层含水层沉积物中微生物群落温育过程中AWCD的变化Fig.3 AWCD changes of microbial communities in shallow aquifer sediments with incubation time
2.3DBP对微生物群落多样性指数的影响
2.3.1丰富度和Shannon指数 颜色变化的孔数即微生物对BIOLOG ECO板上31种底物碳源利用数(S)通常被作为土壤微生物群落功能多样性的丰富度(R)[10,15,17],用于表征微生物群落对底物利用的广泛性和差异性.Shannon指数、Simpson指数和McIntosh指数分别反应微生物群落功能多样性的不同侧面.Shannon指数是研究群落内部物种数量、个体数量和分布均匀程度的综合指标,受群落物种丰富度影响较大, Simpson指数较多反映了群落中最常见的物种[13].McIntosh指数则是群落物种均一性的度量[18].
在整个实验过程中,不同浓度DBP对沉积物中微生物的R值和Shannon指数影响都不显著,但均存在先增后减的趋势,最高点处在200mg/kg (图4).该结果表明,沉积物中微生物种类在200~400mg/kg时最丰富.
2.3.2Simpson指数和McIntosh指数 方差分析得出不同浓度DBP对沉积物中微生物Simpson指数和McIntosh指数造成了显著的影响(图5).200mg/kg DBP作用下,微生物群落的Simpson指数较对照显著增高(P<0.05),之后随DBP浓度的增强该指数下降,表明沉积物中最常见的微生物种类随DBP浓度的增加有先增加后减少的趋势,DBP为200mg/kg时种类最多. McIntosh指数衡量的主要是物种的均一程度.随着DBP浓度的增加,McIntosh指数也呈现先增加后降低的趋势,而最高点为DBP浓度为400mg/kg时.
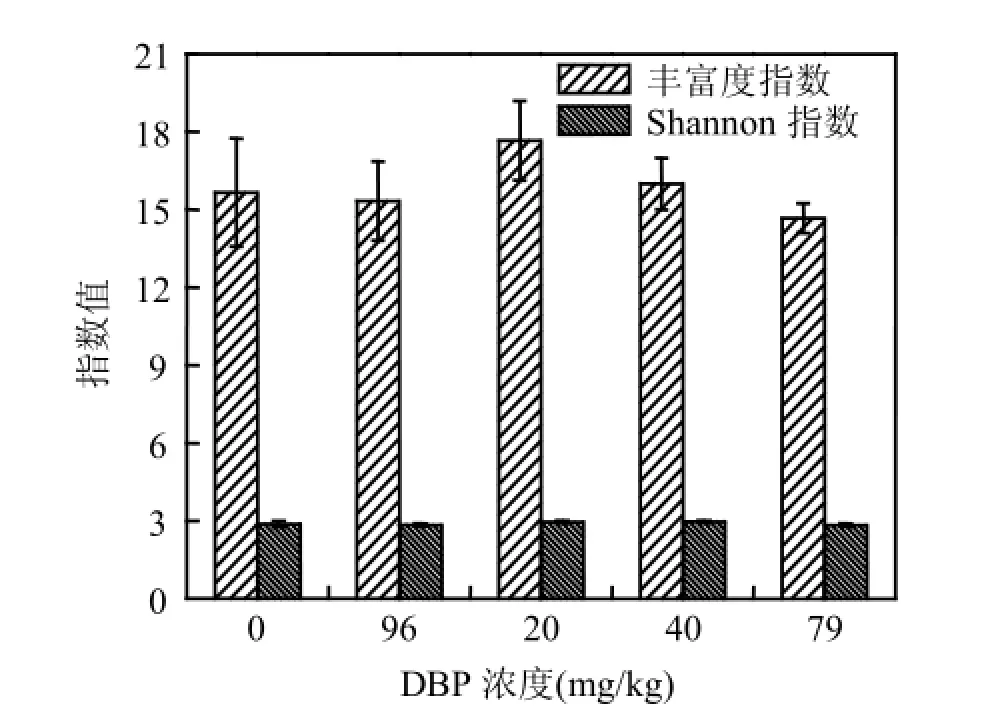
图4 温育312h后不同浓度DBP处理的浅层含水层沉积物中微生物群落丰富度指数和Shannon指数Fig.4 Richness indices and Shannon’s indices of microbial communities in the shallow aquifer sediments amended with different concentrations of DBP after 312h incubation
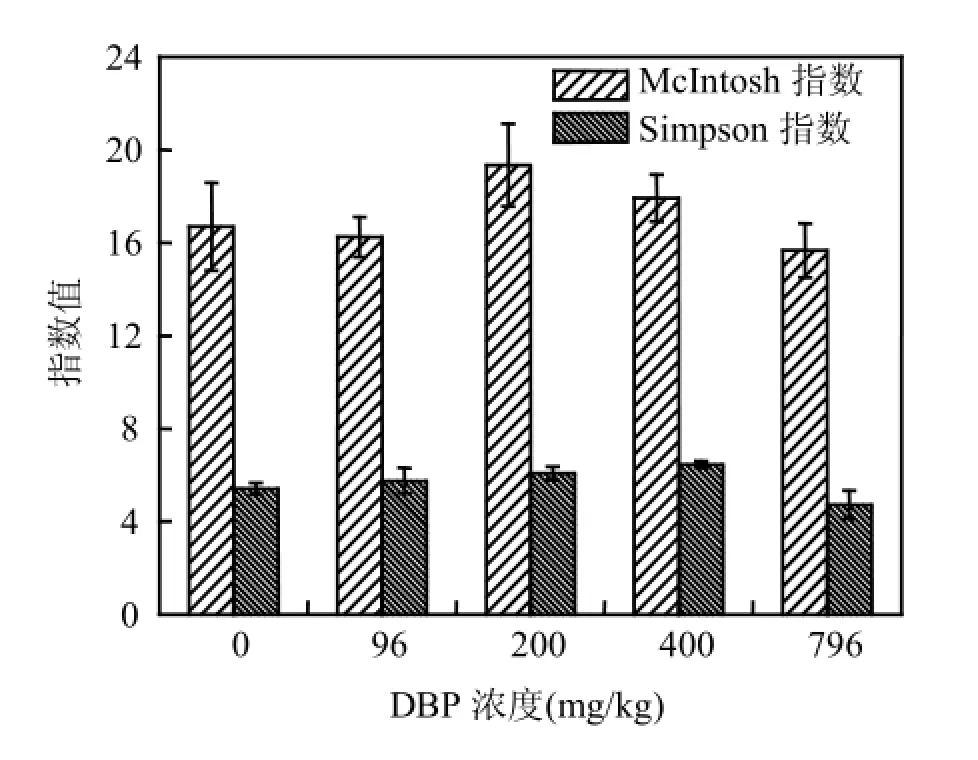
图5 温育312h后不同浓度DBP处理的浅层含水层沉积物中微生物群落Simpson指数和McIntosh指数Fig.5 Simpson’s indices and McIntosh’s indices of the microbial communities in shallow aquifer sediments amended with different concentrations of DBP after 312h incubation
综上所述,在低浓度的DBP范围内(0~200mg/kg),沉积物中最常见微生物的种类随着DBP浓度的增加而增多,至DBP 200mg/kg时最常见物种数目达到最多.之后,微生物的种类随DBP浓度的增加而减少.同时,与DBP代谢有关的微生物活性随着DBP浓度的增加而增强,致使群落的均一程度在DBP浓度达400mg/kg时开始下降,至浓度为796mg/kg时沉积物中与DBP代谢有关的微生物所占比例最大.
2.4DBP对微生物群落功能代谢多样性的影响在研究微生物群落功能多样性上,BIOLOG技术是一个很有效的方法[19].BIOLOG ECO微平板上含有31种碳源,其中聚合物类4种,碳水化合物类7种,羧酸类9种,氨基酸类6种,胺类2种,其它化合物类3种[12,20].图6为育温312h后不同处理沉积物中微生物对六大类碳源的相对利用率.
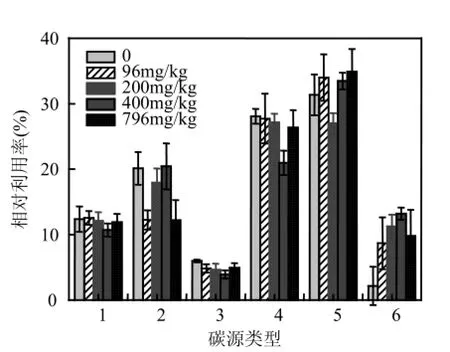
图6 不同浓度DBP处理的浅层含水层沉积物中微生物群落对BIOLOG ECO板中六类碳源的相对利用率Fig.6 Relative utilization efficiencies of 6 kinds of carbon sources in BIOLOG ECO micro plate by the microbial communities in shallow aquifer sediment amendedwith different concentrations of DBP
由图6可知,不同处理样品中的微生物对羧酸类和氨基酸类的利用程度均较高,对其他化合物的利用程度较低.外源DBP对微生物利用聚合物的影响较小,但显著促进了微生物对胺类的利用(促进倍数n>4).在400mg/kg DBP处理下,微生物对氨基酸类的利用程度最大,对羧酸类利用程度明显下降.该结果表明,外源DBP导致沉积物中微生物群落代谢功能产生了变化.
相关研究表明,土壤微生物群落组成及其多样性受一系列因素的影响,如有机碳质含量、养分输入、土壤类型、污染物等环境扰动因子[21-25].
土壤有机质含量直接影响土壤中能利用复杂有机质为营养物质的微生物种群数量及其代谢活性,有机质含量高,土壤微生物的种群和数量相对较高.由于供试含水层沉积物样品中有机质含量低,微生物较表层土壤数量小,一定量DBP的加入一方面为某些可以利用DBP的微生物提供了碳源,参与微生物的呼吸作用;另一方面,也会影响到与该类微生物产生共代谢作用的微生物的数量.因此,DBP会影响微生物的功能多样性.
3 结论
3.1DBP抑制了沉积物中某些微生物的生长繁殖,使其数量与活性下降,同时也促进了与DBP代谢有关的微生物的生长与活性,这类微生物在400mg/kg DBP时活性最强,当浓度更高时会对其产生毒副作用并导致其数量急剧下降.
3.2沉积物中微生物的丰富度、最常见微生物的种类和数量、物种的均一度均随DBP浓度的增加出现先增加后降低的趋势,DBP浓度为200~400mg/kg时微生物种类最丰富.
3.3在浓度96~796mg/kg,DBP导致微生物群落代谢功能产生了变化.
[1] Haveman S A, Pedersen K. Distribution of culturable microorganisms in Fennoscandian Shield groundwater [J]. FEMS Microbiology Ecology, 2002,39:129-137.
[2] Zeng F, Cui K, Xie Z, et al. Distribution of phthalate esters in urban soils of subtropical city, Guangzhou, China [J]. Journal of Hazardous Materials, 2009,164:1171-1178.
[3] Bauer M J, Herrmann R, Martin A, et al. Chemodynamics, transport behaviour and treatment of phthalic acid esters in municipal landfill leachates [J]. Water Science and Technology, 1998,38:185-192.
[4] Zhang D, Liu H, Liang Y, et al. Distribution of phthalate esters in the groundwater of Jianghan plain, Hubei, China [J]. Frontiers of Earth Science in China, 2009,3:73-79.
[5] Zheng Z, He P-J, Shao L-M, et al. Phthalic acid esters in dissolved fractions of landfill leachates [J]. Water Research, 2007, 41:4696-4702.
[6] 沈 萍,范秀荣,李广武.微生物学实验 [M]. 北京:高等教育出版社, 2006:77-79.
[7] Classen A T, Boyle S I, Haskins K E, et al. Community-level physiological profiles of bacteria and fungi: Plate type and incubation temperature influences on contrasting soils [J]. Microbiology ecology, 2003,44:319-328.
[8] Garland J L, Mills A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization [J]. Applied and Environmental Microbiology, 1991,57:2351-2359.
[9] O'Connell S, Lawson R D, Watwood M E, et al. BASIC program for reduction of data from community-level physiological profiling using Biolog microplates: rationale and critical interpretation of data [J]. Journal of Microbiological Methods, 2000,40:213-220.
[10] Zak J C, Willig M R, Moorhead D L, et al. Functional diversity of microbial communities: A quantitative approach [J]. Soil Biology and Biochemistry, 1994,26:1101-1108.
[11] 杨永华,姚 健,华晓梅.农药污染对土壤微生物群落功能多样性的影响 [J]. 微生物学杂志, 2000,20:23-25.
[12] Wang G H, Liu J J, Qi X N, et al. Effects of fertilization on bacterial community structure and function in a black soil of Dehui region estimated by Biolog and PCR-DGGE methods [J]. Acta Ecologica Sinica, 2008,28:220-226.
[13] Magurran A E. Ecological diversity and its measurement [M]. Princeton: Princeton University Press, 1988:141-162.
[14] Chao W L, Lin C M, Shiung I I, et al. Degradation of di-butyl-phthalate by soil bacteria [J]. Chemosphere, 2006,63: 1377-1383.
[15] Garland J L. Analysis and interpretation of community-level physiological profiles in microbial ecology [J]. FEMS Microbiology Ecology, 1997,24:289-300.
[16] 陈中云,闵 航,张夫道,等.农药污染对水稻田土壤硫酸盐还原菌种群数量及其活性影响的研究 [J]. 土壤学报, 2004,41: 97-102.
[17] Harch B D, Correll R L, Meech W, et al. Using the Gini coefficient with BIOLOG substrate utilisation data to provide an alternative quantitative measure for comparing bacterial soil communities [J]. Journal of Microbiological Methods, 1997, 30:91-101.
[18] Atlas R M. Diversity of microbial community [J]. Advanced Microbiology Ecology, 1984,7:19-47.
[19] Xue D, Yao H-Y, Ge D-Y, et al. Soil microbial community structure in diverse land use systems: a comparative study using Biolog, DGGE, and PLFA analyses [J]. Pedosphere, 2008,18: 653-663.
[20] Preston-Mafham J, Boddy L, Randerson P F. Analysis of microbial community functional diversity using sole-carbonsource utilisation profiles - a critique [J]. FEMS Microbiology Ecology, 2002,42:1-14.
[21] Kong W-D, Zhu Y-G, Fu B-J, et al. Effect of long-term application of chemical fertilizers on microbial biomass and functional diversity of a black soil [J]. Pedosphere, 2008,18:801-808.
[22] He J-Z. Molecular bacterial diversity of a forest soil under residue management regimes in subtropical Australia [J]. FEMS Microbiology Ecology, 2006,55:38-47.
[23] Bending G D, Turner M K, Jones J E. Interactions between crop residue and soil organic matter quality and the functional diversity of soil microbial communities [J]. Soil Biology and Biochemistry, 2002,34:1073-1082.
[24] Renella G, Mench M, van der Lelie D, et al. Hydrolase activity, microbial biomass and community structure in long-term Cd-contaminated soils [J]. Soil Biology and Biochemistry, 2004, 36:443-451.
[25] Johnson M J, Lee K Y, Scow K M. DNA fingerprinting reveals links among agricultural crops, soil properties, and the composition of soil microbial communities [J]. Geoderma, 2003, 114:279-303.
致谢:在本研究论文撰写过程中,得到了地微生物实验室王红梅教授的悉心指导;另外在实验测试过程中,得到了环境学院研究生赵锐同学的帮助,在此一并表示感谢.
Effect of di-n-butyl phthalate (DBP) on the microbial diversity in shallow aquifer sediment.
WU Qiong, LIU Hui*, ZHANG Dan, SHI Xia-zhen (Key Laboratory of Biogeology and Environmental Geology, Ministry of Education, China University of Geosciences, Wuhan 430074, China). China Environmental Science, 2010,30(5):671~676
X172
A
1000-6923(2010)05-0671-06
吴 琼(1987-),女,湖北十堰人,中国地质大学(武汉)生物地质与环境地质教育部重点实验室硕士研究生,从事有机污染化学及微生物学研究.
2009-09-25
国家自然科学基金资助项目(40602038,40811120027)
* 责任作者, 副教授, zliuhui@hotmail.com
