大鼠心肌缺血再灌注模型构建的改良
2010-09-08陈冰心段明军
陈冰心,任 澎,段明军,田 飞
(1.石河子大学医学院,石河子 832000;2.新疆自治区人民医院心内科,乌鲁木齐 830000; 3.新疆医科大学第一附属医院实验动物科学研究部,乌鲁木齐 830054; 4.新疆自治区第三人民医院心内科,乌鲁木齐 830002)
研究报告
大鼠心肌缺血再灌注模型构建的改良
陈冰心1,2,任 澎1,2,段明军3,田 飞4
(1.石河子大学医学院,石河子 832000;2.新疆自治区人民医院心内科,乌鲁木齐 830000; 3.新疆医科大学第一附属医院实验动物科学研究部,乌鲁木齐 830054; 4.新疆自治区第三人民医院心内科,乌鲁木齐 830002)
目的 改良大鼠心肌缺血再灌注模型的构建方法,增强实用性。方法32只SD雄性大鼠随机分为四组(A组:伪手术组;B组:缺血组;C组:缺血30 min再灌注组;D组:缺血60 min再灌注组)。缺血过程在人工机械通气条件下完成,术前术中监测心电图变化,模型成功72 h后抽血进行心肌酶谱分析,并观察左室压变化。结果造模成功率为91%。B、C、D组各心肌酶含量明显高于A组(P<0.05),C、D组低于B组(P<0.05)。B、C、D组左室压值低于A组(P<0.05),C、D组高于B组(P<0.05)。结论改进后的模型制备方法简便易行,成功率高,评价指标符合临床应用。
模型,动物;缺血再灌注;心肌;大鼠
由于大鼠冠脉走形及血液循环途径上比较接近人类,且其冠状动脉侧支循环少,心肌坏死出现早,稳定性好,费用低廉,大鼠心肌缺血再灌注损伤模型被广泛用于该病发生发展机制的探索、可行性干预措施的研究等[1]。但纵观近年各研究结果,均集中在对具体操作某一环节进行改进,且模型制作过程中随意性大,存活率不稳定。术后模型成功的评价也主要应用病理学方法进行检测,这与临床上对患者进行心电监测、心肌酶谱分析、心功能检测的实际应用不相符合。本实验综合各模型制作的优势,注重细节的操作,就实用性、稳定性等进行了改进。
1 材料和方法
1.1 材料
1.1.1 实验动物与分组:健康成年雄性SD大鼠32只,体重220~260 g[新疆医科大学实验动物中心提供,SYXK(新)2003-0001],随机分为四组。A组:伪手术组(只穿线,不结扎),B组:心肌缺血组(72 h),C组:心肌缺血再灌注组1(心肌缺血30 min后再灌注),D组:心肌缺血再灌注组2(心肌缺血60 min后再灌注)。
1.1.2 主要仪器与器械:小动物呼吸机(成都泰盟,HX-200)、心电图机(上海光电,ECG8951D),心电监护仪(迈瑞,Beneview T5)、显微镜(Carl ZEISS)、自制小拉钩(曲别针弯曲而成)、气管插管(16号套管针套)、动脉插管延伸管(移液器枪头拉制成长约10 cm,直径约1.5 mm)、小塑胶管(24号套管针套,长约5 mm)、手术台(长约50 cm,宽约40 cm泡沫板而制)、各种手术器械(显微镊、显微针持、眼科剪等)、缝合针、可吸收肠线等(图1,见彩插2)。
1.1.3 主要药品与试剂:10%水合氯醛,注射用青霉素钠,医用生理盐水等。
1.2 实验方法
1.2.1 术前准备:大鼠适应性喂养3 d,术前禁食12 h。称重,10%水合氯醛按0.32 mL/100 g量腹腔注射麻醉(为避免扎到血管,正中腹白线外1 cm左右斜进针,进针后回抽),个别大鼠可酌情追加剂量。麻醉后仰卧位于手术台上,头后仰位,经口腔进行气管插管(注意清理口腔、气道分泌物)。待呼吸、心率平稳后,左侧卧位固定于手术台上,消毒左侧胸前及腋窝下皮肤,并备皮。
1.2.2 胸部手术:于胸骨左缘3、4肋间或4、5肋间,心脏搏动最明显处,沿肋骨走行斜向剪开皮肤约2 cm,逐层分离皮下组织、肌肉,暴露3、4肋间或4、5肋间,可看到心脏暗影,用弯头止血钳在心脏搏动最明显处打开肋间隙,与此同时连接呼吸机,以保持肺内正压,设定呼吸频率60次/min,呼吸比为1:1,潮气量为2 mL/100 g,有条件时可接氧气。适应3 min后,单人操作,用3枚自制拉钩在左、右、上三方向拉开胸壁,另一端用废针头固定于手术台上,调整拉钩位置,充分暴露心脏,剪开心包膜,轻轻推开脂肪垫,显示左心耳,持7-0针线,在其与肺动脉圆锥之间的左冠状动脉前降支(left descending anterior branch,LAD)下穿一缝合线,打一松结,松结内垫一小塑胶管,而后把冠脉及塑胶管一起进行结扎,造成心肌缺血。随后用一把直头止血钳夹闭皮肤及肌肉层,造成假关胸。规定时间后,松开止血钳,再次打开胸腔,一把显微镊轻轻提起结扎的线头,另一把显微镊顺势轻轻拔出垫管,恢复血流灌注。清理胸腔,挤压关胸。肌肉层连同肋骨进行8字缝合,皮肤及皮下脂肪层连续缝合。关胸前加大潮气量,膨肺,3次呼吸后调为正常。缝合后用自制针头抽吸胸腔内残留的气体、液体,形成自然状态下的负压。撤出呼吸机,恢复自主呼吸后,轻轻拔出气管插管,再次清理口腔及呼吸道。术后于青霉素钠15万单位肌注预防感染。手术时间长者可于尾静脉少量补液。术中及术后注意保温。
1.2.3 模型成功的判定:肉眼所见:结扎后可见结扎范围心肌变白,血管供应范围心肌紫绀;再灌注后,心肌紫绀消失或减轻,变白心肌部分恢复红色。心电图示:结扎后ST段弓背抬高或与高耸的T波形成单向曲线,QRS波电压增高或(且)波幅增宽;再灌注后,ST段及T波下落,QRS波趋于术前。
1.3 主要分析指标
1.3.1 心电图变化:于术前、结扎后(5 min、30 min、60 min)、再灌注后(5 min、15 min、30 min)的不同时间点分别测心电图。观察P波、QRS波、T波、ST段及心律失常发生情况。
1.3.2 心功能改变:72 h后,所有大鼠麻醉,颈部皮肤切开,分离颈总动脉,用自制动脉延伸管插入颈总动脉,伸入左心室,接换能器,利用心电监护仪观察左室压变化。
1.3.3 心肌酶谱检测:测定心功能后,打开大鼠腹腔,进行腹主动脉取血,标本静置30 min后离心,取血清检测肌酸激酶(Creatine Kinase,CK)、肌酸激酶同工酶(Creatine Kinase-MB,CK-MB)、谷草转氨酶(Aspartate Aminotransferase,AST)、乳酸脱氢酶(Lactate Dehydrogenase,LDH)水平。
1.4 统计学处理
采用SPSS13.0软件进行统计学分析。计量资料以均数±标准差表示,组间采用单因素方差分析,两组间采用LSD-t检验。
2 结果
2.1 一般情况
整个实验过程中,32只大鼠总死亡率12.5%,其中B组一只死于手术过程中,另一只在术后第2天死亡,C组一只死于手术过程中,D组一只死于术后第3天。考虑手术过程中死亡的原因与结扎位置过高,从而出现广泛心肌梗死及恶性心律失常有关;而术后死亡的原因经尸检考虑与心力衰竭有关。其余实验大鼠于取标本时,精神状态良好,呼吸、心率平稳。冠脉结扎的24只大鼠,除两只死于缺血过程,余22只均出现心梗变化,造模成功率为91%。
2.2 心电图改变
P波及QRS波变化:缺血期B、C、D组24只大鼠,结扎后10只出现P波低平、倒置、双向,其中6只在缺血40 min后,P波逐渐恢复正常。24只大鼠均出现一过性 R波电压增高,其中16只出现 QRS波的增宽,缺血5min后,R波逐渐降低。再灌注期,P波均恢复正常,R波电压回落至正常但有6只增宽的QRS波未回落。缺血后期及再灌注期可出现Q波或Q波加深。A组无变化。
ST段及T波:缺血期24只大鼠,结扎LAD后,4只出现ST的弓背抬高,其余皆与T波融合成单向曲线。再灌注期,ST段及T波回落。A组大鼠3只在术后出现ST段的压低。
心律失常情况:22只大鼠16只发生室性心律失常,多出现在缺血和再灌注早期,以室性早搏、二连律为最多,多数可自行或经利多卡因棉球擦拭后恢复(图2)。

图2 心电图变化Fig.2 The changing of ECG
2.3 对心肌酶谱的影响
B、C、D组的CK、AST及B、D组的CK-MB、LDH较A组均显著升高(P<0.01);C组CK-MB、LDH较A组显著升高(P<0.05);C、D组的CK、CK-MB、LDH、AST较B组均显著降低(P<0.01);C组的CK、CK-MB、LDH、AST均低于D组(P<0.01)(表1)。
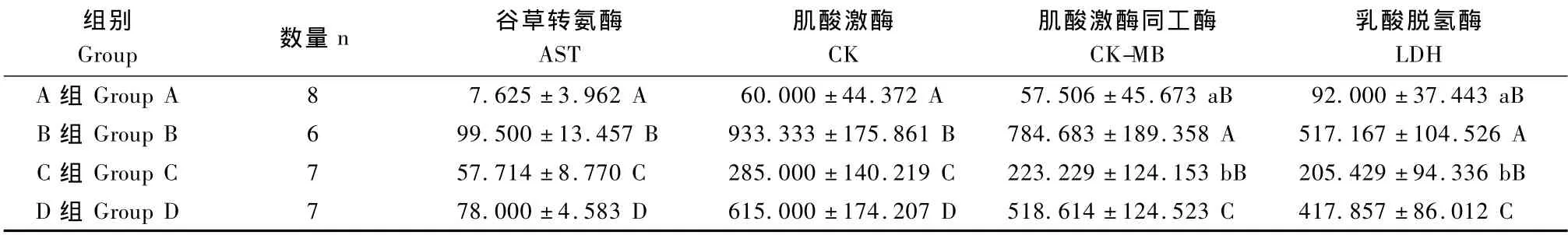
表1 各组血清心肌酶AST、CK、CK-MB、LDH含量比较Tab.1 Comparison of the level of plasma AST,CK,CK-MB and LDH in various groups
2.4 左心室压变化情况
A、B、C、D组左室压分别为:120.875±11.763 mmHg、63.833±17.680 mmHg、85.857±13.397 mmHg、83.857±15.159 mmHg。B、C、D组左室压较A组显著降低(P<0.01);C、D组左室压均显著高于 B组(P<0.05);C、D组比较无显著差异(P>0.05)。
3 讨论
模拟心肌缺血-再灌注损伤疾病模型的制作方法从解剖位置上可分为两种:原位结扎和胸腔外结扎。在此基础上,具体操作又可分为推管法和垫扎法。此外,在具体实施时又有许多细节的不同。我们经过预试验的摸索,结合本实验室条件,对该模型制作做了综合改进:1.采用原位结扎及垫管法。原位结扎可使心脏处于正常解剖位置,对于术后大鼠的心脏生理功能影响较小,可提高术后动物的存活时间,适合慢性再灌注的实验研究。对于其视野小、操作困难等缺点我们采用3把自制拉钩打开胸腔。实验证明,自制拉钩不仅可以充分暴露心脏,而且灵活、损伤小,避免了使用扩胸器、开睑器等带来的损伤及操作不便,很好的解决了原位结扎的局限性,同时制作拉钩的原材料常见且经济,任何实验室均可具备。对于冠脉结扎我们仍用垫管法,自制塑胶管较常见且实验效果与特制的聚乙烯小管及改进后应用的鱼线、球囊无明显差异[2,3]。在整个实验过程中,我们未发现有些学者提出的管不易固定和缺血效果不好等问题[4],而且在具体操作中证明垫扎法比推管法、打活结法更易操作。2.应用动物呼吸机。保持肺内正压,避免动物在手术过程中缺氧对于实验结果的干扰。术后动物清醒快,存活率高。3.经口腔进行气管插管。自制气管插管实用性较强,操作简易。经口腔插管可减少创伤,避免术后感染、气道分泌物增多、气道塌陷等,可延长存活时间,适用于慢性再灌注的实验观察。4.固定采用左侧卧位,使前降支定位简单化。同时不剪断肋骨,减少动物创伤。5.术中、术后注意保温。我们在预实验中发现麻醉剂对于动物的体温影响很大,间接的降低了动物承受手术的能力,全程保温后大大提高了术后的存活率。
我们的资料显示大鼠心率较快,体表心电图 T波起始与QRS波相融合,无明确 ST段,且ST段还受心肌损伤的影响,而 T波电压的变化更直观、更容易测量,我们认为一定程度上可以替代 ST段作为模型成功的指标。资料还显示Q波变化,提示心肌坏死的形成,也可作为造模成功的指标之一。这与国内研究基本一致[5]。我们的实验结果观察到QRS波也出现了变化,这可能与急性损伤的心肌组织出现传导延迟有关。血管再通后,QRS波应该回落,不回落代表再通不良,我们认为QRS波变化也可以作为模型制作成功与否的观察指标之一。我们实验中有6只未见回落,考虑与再灌注时间短有关,我们监测的是再灌30min后的心电图,心肌缺血时间长会出现心肌细胞顿抑现象,随着时间的延长,是否会回复正常,将有待进一步研究。实验中我们观察到有73%大鼠出现心律失常,比国内报道数值高,但在临床血管再通后,心律失常发生率却不高[6],差异原因将有待更深入研究。
以往造模成功后的评价指标都集中在病理学范畴,如Evan’s蓝染色、TTC染色等,染色后比较心肌梗死面积的范围,但不同个体血管变异性较大,供应范围不等,且与临床上常用的评价指标不符,我们认为单纯以此值作为评价指标在实际应用上欠妥当。我们采用心肌酶谱分析、心功能测定来评价,符合临床实际应用[7]。我们资料显示各心肌酶指标缺血组及再灌注组比对照组均明显升高,但缺血30 min组低于缺血60 min组,说明血管开通后,可使心肌梗死范围大大缩小,血管开通越早,心肌梗死程度越轻。左室压变化亦类似,血管开通后,心功能降低程度减轻。但缺血30 min变化与缺血60 min变化差异无明显统计学意义。这可能与大鼠心肌细胞对缺血的耐受性有关,缺血30 min和缺血60 min都造成了心肌细胞缺血损伤,再灌注只能避免缺血心肌细胞进一步损伤,对于已梗死的心肌细胞无改善作用。
改进的造模方法能够成功的复制心肌 I/R模型,实用性强、成功率高、操作简易且经济,可在大多数实验室条件下进行。但本实验仍存在一些问题。我们的模型制作仍是以大鼠麻醉状态为前提,对于急性心肌梗塞患者是在清醒状态下接受溶栓或PCI术,如用清醒自由活动大鼠研究心肌缺血再灌注损伤,将更接近人类疾病的发生情况。我们对于心功能测定是采用有创的左室压变化来评价,此方法有其局限性。这些问题我们将在后续试验中进一步摸索。
[1] 张健发,马依彤,杨毅宁,等.小鼠心肌缺血后适应模型的建立及其相关影响因素[J].中国比较医学杂志,2007,17(10):576-580.
[2] 唐晓敏,汪克明.改良式大鼠心肌缺血再灌注模型的复制[J].浙江中医药大学学报,2007,(1):49-51.
[3] 赵秀敏,孙胜,刘秀华.垫扎球囊法复制大鼠在体心肌缺血/再灌注模型[J].中国微循环,2007,11(3):206-208.
[4] 王晓樑,刘磊,梁峰,等.大鼠在体心肌缺血/再灌注模型制备方法的改进[J].山西医科大学学报,2006,37(9):980-982.
[5] 王砚青,汪时森,刘平,等.大鼠心肌缺血-再灌注模型心电图变化分析[J].医学研究生学报,2006,19(8):700-702.
[6] Hansen PR.Myocardial reperfusion injury:experimental evidence and clinical relevance[J].Eur Heart J,1995,16:734-740.
[7] 杨迪成,肖明第,卢成宝.心肌缺血-再灌注模型血流动力学的实验研究[J].医学研究生学报,2006,19(6):524-529.
Improvement of Establishing a Myocardial Ischemic Reperfusion Model in Rats
CHEN Bing-xin1,2,REN Peng1,2,DUAN Ming-jun3,TIAN Fei4
(1.Shi Hezi Medical College,Shehezi 832000,China;2.People Hospital of Xingjiang,Urumqi 830000,China; 3.First Affiliated Hospital of Xingjiang Medical University,Urumqi 830054,China; 4.Third People Hospital of Xingjiang,Urumqi 830002,China)
ObjectiveTo improve the method of establishing model in myocardial ischemic reperfusion rat. Methods 32 SD male rats were divided into four groups randomly(Group A:sham group,Group B:myocardial ischemic,Group C:ischemic 30 min and reperfusion,Group D:ischemic 60 min and reperfusion).Inspected the changing of ECG in preparation/in-operation and rats breathing were finished under the control of artificial respirator in the period of MI.After 72 h of the operation,the levels of myocardial zymogram were determined and the left ventricular pressure was traced. Results Survival rate was 91% after operation.Myocardium zymogram content in the group B,C,D was significantly higher than that of group A(P<0.05);Myocardium zymogram content in group C、D was lower than that of group B(P<0.05).The left ventricular pressure in group B,C,D was lower than that of group A(P<0.05);The left ventricular pressure in group C、D was higher than that of group B(P<0.05)。ConclusionThe improving method is convenient,higher survival rate,and the evaluation was according with clinical procedures.
Model,animal;Ischemia-reperfusion;Myocardial;Rat
R542.2
A
1671-7856(2010)05-0024-05
2009-11-26
新疆自治区自然科学基金(200821117)。
陈冰心(1984-),女,住院医师,硕士生,主要从事冠心病的临床与基础研究。E-mail:chen115150@163.com
任澎,男、主任医师、博士、主要从事冠心病的临床与基础研究。E-mail:renpengcvd@126.com
