肥胖大鼠瘦素信号传导通路的变化
2010-09-08马晓红张文明刘红霞张连峰
苏 卫,马晓红,张文明,刘红霞,张连峰
(中国协和医科大学中国医学科学院实验动物研究所,北京 100021)
研究报告
肥胖大鼠瘦素信号传导通路的变化
苏 卫,马晓红,张文明,刘红霞,张连峰
(中国协和医科大学中国医学科学院实验动物研究所,北京 100021)
目的筛选与人类代谢障碍性肥胖症发病病因学相似的肥胖大鼠模型,并对肥胖个体Leptin信号传导通路的改变情况进行初步研究。方法离乳雄性Wistar大鼠以高脂饲料喂养6周后,取体重增加值大的前1/4部分作为肥胖倾向组大鼠。对肥胖倾向组大鼠,继续进行高脂饲料喂养,并观察其体重、血清 Leptin的变化趋势;试验49周后,大鼠处死,对内脏脂肪含量、附睾脂肪细胞大小以及下丘脑 LRb(Leptin受体 b亚型)表达水平及Stat3磷酸化水平(Tyr705磷酸化)进行测定。结果正常对照组大鼠和肥胖倾向组大鼠在不同饲料喂养的第17周开始体重相对增加值出现组间显著性差异;除第16周肥胖倾向组大鼠的血清 Leptin浓度高于正常对照组,但不存在显著性差异之外,其它采血时间点,肥胖倾向组的血清 Leptin浓度均显著高于正常对照组;动物处死后,肥胖倾向组大鼠的内脏脂肪含量和附睾脂肪细胞大小均显著大于正常对照组;两组大鼠在下丘脑LRb表达水平和细胞浆内Stat3磷酸化水平方面不存在显著性差异。结论本研究得到了与营养性肥胖人群临床表现相似的肥胖大鼠;同时发现,肥胖大鼠在长期高浓度Leptin刺激后,可能引起了中枢性 Leptin抵抗,致使 Leptin对体重调节的正常生理作用受到抑制,脂代谢异常的程度进一步加深,最终表现为脂肪细胞体积增大、内脏脂肪含量升高和体重增加。
肥胖大鼠;高脂饮食;廋素;信号传导通道
肥胖是遗传因素、环境因素和心理因素共同作用所导致的代谢障碍性疾病,肥胖症的发生,不仅对机体自身产生直接影响,也是诸多代谢性疾病的主要诱因[1]。
本研究选用具有遗传多态性的封闭群 Wistar大鼠[2],以高脂饲料作为大鼠能量摄入来源,通过长期的喂养、筛选后,希望能够得到与人类营养性肥胖症病因相近,临床表现相似的肥胖大鼠模型。而瘦素(Leptin),主要通过白色脂肪细胞分泌,是食物摄入和能量消耗的重要传入型信号分子,通过作用于中枢神经下丘脑中特定神经元上的瘦素受体(Ob-Rb)激活下游不同的信号通路进行食物摄入和能量消耗的调节[3]。其中在下丘脑核团高度表达的主要功能受体b型(LRb),为长跨膜受体,属于细胞因子 I受体超家族,该受体激活后,通过 JAKSTAT(Jak激酶-信号传导及转录激活因子)途径进行生物信息的传递,从而对食物摄入和能量消耗进行调控。故本研究将血清Leptin、下丘脑LRb、Stat3和Tyr705磷酸化的 Stat3作为考察的主要指标,力求在Leptin信息传导通路方面对肥胖发生的病理学机制进行探索性研究。
1 材料和方法
1.1 实验对象
离乳雄性Wistar大鼠(SPF),中国医学科学院实验动物研究所资源中心提供[SCXK(京)2000-0006]。
1.2 主要试剂和仪器
1.2.1 主要试剂:Leptin测定用试剂盒(Assay Designs,900-015);Stat3抗体(兔抗鼠 Stat3,Cell Signaling Technology,#9132);Phospho-Stat3抗体(兔抗 鼠 Phospho-Stat3,CellSignaling Technology,# 9131S),LRb抗体(兔抗鼠 LRb,Alpha Diagnostic International,OBR13-A);化学发光底物 (Pierce Biotechnology,34077)。
1.2.2 主要仪器:粗纤维测定仪(M6型,Tecato);高温炉(KM-100型,ASH);索氏脂肪提取装置;全自动酶标仪(Stat fax2100型,Awareness Technology Inc);高速冷冻离心机(CS-15R型,Bcekman);Nikon显微镜;垂直式电泳仪(AE-6450型,ATTO Co.日本);半干式电转移装置(AE-6675型,ATTO Co.日本);凝胶图像成像分析仪(GAS7001B型,UVI,英国);成像软件:UVIPhoto;分析软件:UVISoft UVIBand Application V97.04。
1.3 实验用饲料
特定能量值的维持饲料和高脂饲料由中国医学科学院实验动物研究所资源中心提供[SCXK(京) 2001-0003]。
对饲料中碳水化合物、粗脂肪、粗蛋白均采用化学法进行含量测定,具体的操作步骤见GB14924.9-2001。
饲料中各营养素提供能量的计算标准为[4]:炭水化合物提供能量为16.75 kJ/g;蛋白提供能量为16.75 kJ/g;粗脂肪提供能量为37.68 kJ/g,其余成分不提供能量。
1.4 方法
1.4.1 动物分组:离乳雄性 Wistar大鼠进入动物房,适应环境3 d,称重(W0)后随机分组,9只/组。在保证动物有充足的食物和饮水的前提下,取其中任一组作为正常对照组,给予维持饲料;其余为高脂饮食组,给予高脂饲料(室温22℃ ±3℃,相对湿度30%~73%,12 h昼夜光照)。正常对照组大鼠和高脂饮食组大鼠分别喂养6周后,称重(W1)。正常对照组动物保持不变,将高脂饮食组各大鼠按照体重增加值(W1-W0)的大小进行排队,取体重增加值大的前1/4部分(即体重增加显著的9只大鼠)作为肥胖倾向组;其余高脂饮食组大鼠弃去[5]。
1.4.2 观察指标:体重、血清Leptin水平:实验过程中每周测定体重一次;Leptin的测定用双夹心ELISA法。
1.4.3 组织收集和样本处理:大鼠乙醚麻醉后股动脉取血,离心,收集血清;为进行Western Blot分析,将大鼠处死后,分离下丘脑,称重,置于0.3 mL蛋白裂解液中(10 mmol/L Tris-HCl,pH6.8;2%SDS;0.08 μg/mL okadaic acid。蛋白酶抑制剂,1 mmol/L PMSF,0.1 mmol/L Benzamidine,和 2 μmol/L leupetin),以手动组织研磨器研磨。将匀浆迅速煮沸 2 min后,置冰上冷却,14000 r/min,4℃ 离心15 min。取上清,Brandford法测定总蛋白浓度后分装冻存于-70℃。
1.4.4 内脏脂肪含量的测定:分别取附睾脂肪垫、腹膜后脂肪垫和肠系膜脂肪垫,称重,依据下述公式进行计算:内脏脂肪含量%=(附睾脂肪垫重+腹膜后脂肪垫重+肠系膜脂肪垫重)÷体重×100%
1.4.5 附睾脂肪细胞大小的测定:取附睾脂肪垫,用40 g/L甲醛固定,酒精梯度脱水,石蜡包埋切片,HE染色。将固定切片处理过的附睾脂肪垫置于400倍显微镜下计数全视野中的脂肪细胞个数,用测微尺测量脂肪细胞的大小。每张切片计数10个视野的细胞数,测量10个细胞的直径,取平均值作为每例的数据[6]。
1.4.6 LRb分析:取蛋白提取液(160 μg)于SDSPAGE凝胶分离,电转移至硝酸纤维素膜,将膜与特异的抗LRb抗体孵育,通过增强酶联化学发光法和灰度扫描来定量。
1.4.7 Stat3和 phospho-Stat3分析:取蛋白提取液(60 μg)于SDS-PAGE凝胶分离,电转移至硝酸纤维素膜,将膜与特异的抗Stat3抗体(磷酸化和非磷酸化)和Tyr705磷酸化的Stat3抗体孵育,通过增强酶联化学发光法和灰度扫描来定量。
2 结果
2.1 维持饲料和高脂饲料营养素
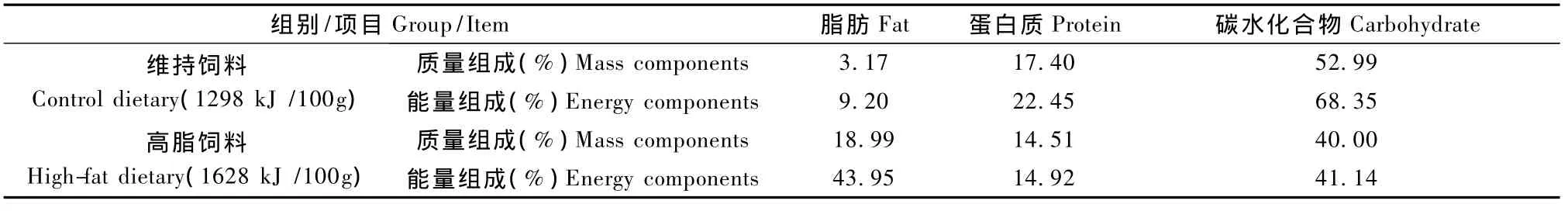
组别/项目Group/Item 脂肪Fat 蛋白质Protein 碳水化合物Carbohydrate维持饲料Control dietary(1298 kJ/100g)质量组成(%)Mass components 3.17 17.40 52.99能量组成(%)Energy components 9.20 22.45 68.35高脂饲料High-fat dietary(1628 kJ/100g)质量组成(%)Mass components 18.99 14.51 40.00能量组成(%)Energy components 43.95 14.92 41.14
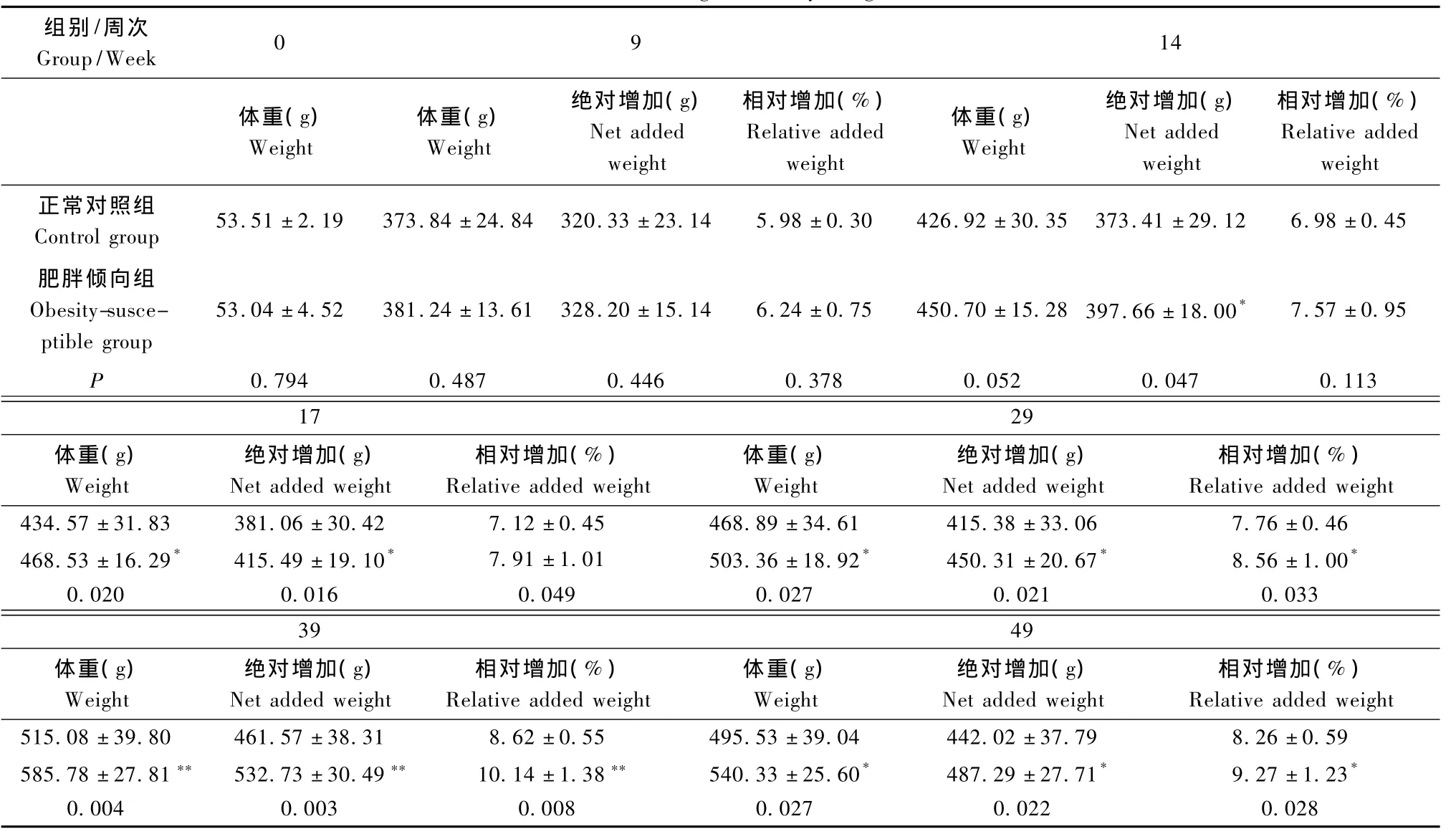
表2 大鼠体重变化Tab.2 Changes of body weight
经化学分析,实验所使用的维持饲料和高脂饲料中的各种营养素的质量组成和能量组成如表1。
2.2 大鼠体重的变化
通过1年对肥胖倾向组与正常对照组大鼠体重的动态观察,发现高脂饲料喂养的大鼠在第14周开始,体重绝对增加值较正常对照组出现显著性的增加,第17周开始体重相对增加值出现显著性增加,从而表明,本研究所采用的肥胖倾向大鼠筛选方案是可行的(表2)。
2.3 血清Leptin的变化
对血清Leptin进行测定的结果表明,除第16周肥胖倾向组大鼠的血清 Leptin浓度高于正常对照组,但不存在显著性差异之外,其它肥胖倾向组的血清Leptin浓度均显著高于正常对照组(表3)。肥胖倾向组大鼠在Leptin水平长期高于正常对照组大鼠的情况下仍然表现为显著性的体重增加,这说明,肥胖倾向组大鼠可能发生了Leptin抵抗。
2.4 脂肪组织与细胞的变化
正常对照组大鼠和肥胖组大鼠处死后,取附睾脂肪垫进行 HE染色,于400倍镜下观察形态学变化(图1,见彩插2)。通过对正常对照组大鼠和肥胖组大鼠内脏脂肪重量、显微镜下相同视野内脂肪细胞的记数进行统计,肥胖大鼠的脂肪细胞直径、内脏脂肪重量及内脏脂肪含量(%)都显著高于正常对照组(表4)。对所有18只大鼠(包括正常对照组和肥胖组各9只)的内脏脂肪重量和Leptin浓度之间的相关性进行分析(图2)表明,二者之间呈正的直线相关关系,这表明,内脏脂肪含量对血清Leptin浓度的增加发挥了直接作用。
2.5 下丘脑Leptin受体b亚型(LRb)蛋白表达量及胞内Stat3蛋白Tyr705磷酸化水平
用Western Blot测定下丘脑 Leptin受体 b亚型(LRb)蛋白表达量(图3A)和胞内Stat3蛋白Tyr705磷酸化水平(图3B),结果均未出现显著性差异。

表3 血清Leptin的测定结果Tab.3 Changes of serum Leptin concentration

表4 大鼠脂肪组织、细胞指标Tab.4 Changes of rats adipose tissue and adipocytes
3 讨论
肥胖,不仅仅是体重增加,血脂异常。随着包括高血压、糖尿病和心脏病等代谢性疾病与肥胖密切关联的不断明晰,对肥胖,特别是代谢障碍性肥胖的研究已提升到一个新的高度。肥胖的形成,与生活行为方式、摄食行为、嗜好、胰岛素反应以及社会心理因素相互作用有着密切的关系,而多基因的遗传因素则是其致病的本质因素。在对基因剔除小鼠的研究中就发现,有超过6000个基因可能影响小鼠的体重[7]。众多的基因,在环境因素,特别是食物营养结构和能量供给发生极大变化(高糖、高脂肪饮食)的情况下,使机体正常的食物神经调节网络[8],脂肪因子调节[9]和能量平衡系统[10]的相互调节作用发生紊乱,致使机体能量平衡失调,从而导致肥胖。

图2 内脏脂肪重量与血清Leptin浓度间的相关性分析Fig.2 Correlativity between weight of visceral fat and concentration of serum Leptin

图3 高脂饮食对LRb蛋白表达量和Stat3蛋白Tyr705磷酸化水平的影响Fig.3 Effect of the high-fat diet on protein expression of Leptin receptor b(LRb)and phosphorylation extent of Stat3 at the location of tyr705
本研究利用封闭群 Wistar大鼠的遗传多态性,筛选出具有肥胖倾向的大鼠,并以此为实验对象,结合长期给与高脂饲料喂养,可使携带肥胖倾向基因的动物最终发展为与人类代谢障碍性肥胖症病因相近,临床表现相似的肥胖大鼠模型。其中,肥胖组大鼠与正常对照组比较,脂肪细胞体积显著增大;内脏脂肪重和体脂含量也显著高于正常对照组大鼠。证明,具有肥胖倾向的大鼠经长期高脂饲料喂养后,会引起大鼠体内脂肪细胞不断增大,细胞内胆固醇合成增加[11],从而导致脂肪进行性堆积,体重持续性增加。
而瘦素(Leptin),这种主要由白色脂肪分泌的肽类物质,其受体激活后,通过JAK-STAT途径来进行生物信息的传递,从而对食物的摄入及能量的消耗做出调控。Western Blot的结果表明:尽管肥胖倾向组大鼠血清 Leptin浓度显著高于正常对照组大鼠,但是两组大鼠在下丘脑LRb蛋白的表达水平上以及由Leptin和 LRb特异性结合后所引起的胞浆内Stat3磷酸化水平方面均不存在统计学差异。这与Shu等[12]对雄性 C57Bl/6J小鼠进行19周高脂喂养研究、Sahu等[13]对雄性Wistar大鼠进行9周高脂喂养研究和 Christian等[14]对雄性 Wistar大鼠进行15周高脂喂养研究后所得到的结果基本一致。通过对上述实验结果进行分析,我们认为:大鼠在长期的高脂饲料喂养过程中,随着血清 Leptin浓度的进行性增加,产生了由持续性高 Leptin浓度刺激所引起的LRb对Leptin作用的进行性脱敏效应,最终导致中枢性 Leptin抵抗。也就是高脂饲料喂养后,大鼠体内能量平衡状态和脂代谢发生异常时,Leptin对食欲、能量消耗及交感神经活性的正常调控作用受到抑制,从而出现了,即使大鼠血清Leptin水平持续增高,仍然表现为进行性的体重增加和体脂含量增加的现象。
此外,将分离得到的脂肪总重量和血清 Leptin水平二者间进行相关性分析发现,全脂肪重量和血清Leptin水平间呈正的直线相关关系(r=0.7791),这与文献报道中“Leptin主要由白色脂肪细胞分泌的”这一结论相吻合。
[1] Labib M.The investigation and management of obesity[J].Clin Pathol,2003,56:17-25.
[2] Philip JS,MichaelM,Eugene WS. Impaired leptin signal transduction with age-related obesity[J].Neuropharmacology,2000,39:1872-1879.
[3] Scarpace PJ,Matheny M,and Tumer N.Hypothalamic leptin resistance is associated with impaired leptin signal transduction in aged obese rats[J].Neuroscience,2001,104(4):1111-1117.
[4] Chinese Academy of Preventive Medicine,INFS.List of food ingredients[S]. Peoples Medical Publishing House,3 (Chinese).
[5] Sam C,Brent Gr,Fatima Y,et al.Metabolic differences between obesity-prone and obesity-resistant rats[J].Physiol Regul Integr Comp Physiol,1990,259:R1103-R1110.
[6] Chen Q.Methodology of Chinese materia medica pharmacology study[M].PeoplesMedicalPublishingHouse,1993,627 (Chinese).
[7] Danielle RR,Maureen PL,Michael GT.Reduced body weight is a common effect of gene knockout in mice[C].BMC Genetics,2008,9:4.doi:10.1186/1471-2156-9-4.
[8] Kalra SP,Dube MG,Pu S. Interacting appetite-regulating pathways in the hypothalamic regulation of body weigh[J]. Endoc Rev,1999,20(1):68-100.
[9] Yuji M,Iichiro S,Shinji K,et al.Importance of adipocytokines in obesity-related diseases[J].Horm Res,2003,60:56-59.
[10] Bruce MS,Jeffrey SF.Obesity and the regulation of energy balance[J].Cell,2001,104:531–543.
[11] Petri TK,Esko AN,Tatu AM.Regulation of cholesterol synthesis and storage in fat cells[J].Lipid Research,1975,16:211-223.
[12] Shu L,Storlien LH,Huang XF.Leptin receptor,NPY and POMC Mrna expression in the diet induced obese mouse brain[J]. Brain Res,2000,875:89-95.
[13] Sahu A,Nguyen L,O'Doherty RM.Nutritional regulation of hypothalamic leptin receptor gene expression is defective in dietinduced obesity[J].Neuroendocrinology,2002,14:887-893.
[14] Christian P,Gerard PMcG,Rudolf E.Leptin receptor expression and suppressor of cytokine signaling transcript levels in high-fatfed rats[J].Life Science,2000,67:2971-2981.
Changes of Leptin Signal Pathway in Rat Obesity Progression
SU Wei,MA Xiao-hong,ZHANG Wen-ming,LIU Hong-xia,ZHANG Lian-feng
(Key Laboratory of Human Disease Comparative Medicine,Ministry of Heath,Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences&Comparative Medical Center,Peking Union Medical College,Beijing 100021,China)
ObjectiveTo screen obesity rat model of metabolic disturbance,and to determine whether Leptin signal transduction pathway in obesity rats are changed or not.Method Male Wistar weaning rats were divided randomly into control group and high-fat fed group.Rats of high-fat fed group were fed high-fat diet for 6 weeks,and then,screened them based on body weight gain(upper quarter for obesity-prone rats).During the dietary period,body weight and serum Leptin level of obesity-prone group rats and control group rats were determined on schedule;Rats were decapitated 12 months later,content of body lipid,size of epididymis fat cell and protein expression level of LRb,Stat3 and p-Stat3 in hypothalamus were determined as well.Result Both body weight and relative added body weight had got significant differences between control group and obesity-susceptible group after the 17thweek feeding;serum Leptin level had significant differences between control group and obesity-susceptible group except for the 16thweek;Percent of body lipidsand the size of epididymis fat cell had got significant differences between control group and obesity-susceptible group after the special diet feeding for 49 weeks;LRb protein expression level and Stat3 phosphorylation level in hypothalamus had no differences between obesity-susceptible group and control group。ConclusionOur study got the first generation of obesity rat model which had the similarly pathogenesis and clinical symptoms successfully.The down-regulation of LRb must be a key factor charged for the disregulation of lipid metabolism.
Obesity rat;High-fat feed;Leptin;Signal pathway
Q495
A
1671-7856(2010)05-0015-06
2009-10-15
卫生部行业基金,实验动物和人类疾病动物模型资源扩展(200802036)和十一五新药专项支持(2009ZX09501-026)。
苏卫(1962-),女,副研究员,研究方向:代谢性疾病比较医学。
张连峰。E-mail:Zhanglf@cnilas.org
