SD大鼠与Wistar大鼠脑胶质瘤动物模型的建立及比较
2010-09-08王晓武李康樗丁桂荣徐胜龙周咏春常英娟郭国祯
王晓武,李康樗,丁桂荣,徐胜龙,周咏春,谭 娟,常英娟,郭国祯
(1.第四军医大学军事预防医学系放射医学教研室,西安 710032; 2.第四军医大学西京医院放射科,西安 710031)
研究报告
SD大鼠与Wistar大鼠脑胶质瘤动物模型的建立及比较
王晓武1,李康樗1,丁桂荣1,徐胜龙1,周咏春1,谭 娟1,常英娟2,郭国祯1
(1.第四军医大学军事预防医学系放射医学教研室,西安 710032; 2.第四军医大学西京医院放射科,西安 710031)
目的 比较利用SD大鼠、Wistar大鼠建立脑胶质瘤动物模型的不同,为研究脑胶质瘤的发病机制及治疗方法提供操作平台。方法利用立体定向仪建立 SD大鼠、Wistar大鼠大脑皮层接种C6细胞(2.5×105个细胞/只),建立脑胶质瘤动物模型,利用组织病理学、免疫组织化学以及核磁共振成像等技术,比较两种动物模型在成瘤率、肿瘤生长状况、死亡率以及动物一般情况等方面的异同。结果SD大鼠组、Wistar大鼠组的成瘤率均为100%,两组均未见转移;但SD大鼠组肿瘤成瘤时间较长,且部分肿瘤有自愈倾向,而Wistar大鼠组则未出现类似情况。结论Wistar大鼠大脑皮层脑胶质瘤动物模型的肿瘤性状更接近于人的脑胶质瘤,因此更适合探索和研究脑胶质瘤的发病机制和治疗方法;而SD大鼠的肿瘤由于性状类似转移瘤,且有自愈倾向,不适合作为上述相关研究的动物模型。
脑胶质瘤;模型,动物;SD大鼠;Wistar大鼠
脑胶质瘤是一种常见的颅内恶性肿瘤,恶性程度高,预后差,临床平均生存期少于一年。目前,各种治疗效果不佳,因此有必要建立合适的胶质瘤动物模型以便进一步研究脑胶质瘤发病机制及治疗方案。本文将大鼠C6脑胶质瘤细胞接种在SD大鼠、Wistar大鼠大脑皮层,建立两种脑胶质瘤动物模型,通过采用病理学及影像学观察,比较两种动物模型的差异,为提供合适的脑胶质瘤动物模型提供依据。
1 材料和方法
1.1 材料
1.1.1 人脑胶质瘤C6和实验动物:C6脑胶质瘤细胞来源于第四军医大学神经生物学教研室。实验动物:Wistar大鼠,雄性,体重150~160 g,共20只,大脑皮层接种 C6细胞。SD大鼠,雄性,体重210~220 g,共20只,大脑皮层接种 C6细胞。SD大鼠、Wistar大鼠均购于第四军医大学实验动物中心[SCXK(军)2007-007,SYXK(军)2007-020]。
1.1.2 仪器和试剂:仪器主要包括CO2孵箱(日本理化工业株式会社),超净工作台(天津市特斯泰仪器有限公司),台式离心机(湘仪离心机仪有限公司),脑立体定向仪(西安西北光电仪器厂),牙科台式电钻车(上海齿科医械厂),25 μL微量注射器(上海济成分析仪器有限公司),简易手术包,显微镜(Nikon),核磁共振仪(西门子公司);试剂主要包括新生牛血清(天津灏洋生物制品科技有限责任公司),DMEM培养液(Gibco公司),兔抗鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)多克隆抗体(博奥森公司),SABC(中杉公司)。
1.2 方法
1.2.1 动物准备:动物于接种细胞前开始进行适应性饲养1周,动物体重增加35±3 g。
1.2.2 C6细胞准备:C6复苏后,在接种前至少传代一次,待细胞长至对数生长期时(2/3培养瓶底长满)收集细胞(于收集细胞前24 h更换培养液)。收集细胞时,先用0.01 mol/L PBS洗涤一次,再用0.25%胰酶消化,并于显微镜下观察细胞状态,待细胞收缩变圆,且有个别细胞脱落时加入少量含10%血清的DMEM培养液终止消化,弃去液体后,加入不含血清的DMEM培养液,收集细胞,800 r/min离心4 min,采用血球计数器计数,制备2.5×107/mL细胞悬液,置于37℃ CO2孵箱中待用。
1.2.3 动物麻醉及准备:大鼠经 10%水合氯醛(0.4 mL/100 g)经腹腔麻醉后,固定于西安西光仪器厂生产大鼠脑立体定向仪。动物头部固定于立体定向架,两耳锤深入外耳道对称固定,剪去头顶部毛发约1.0 cm×1.0 cm,碘酒、75%乙醇消毒皮肤后铺孔巾,无影灯聚焦于种植部位。
1.2.4 颅骨钻孔及颅内C6细胞接种:根据文献报道[1-3],确定接种靶点,在内眦连线与头部矢状中线交汇处纵向切口1.0 cm,分离皮肤暴露颅骨,在前囟位置,向右旁开3.0 mm,冠状缝前0.5 mm坐标定位钻孔至硬膜,孔径1.0 mm。25 μL微量注射器吸入吹打混匀的细胞悬液(密度为2.5×107/mL,2.5×105个细胞/只,体积为10 μL),硬膜下进针3 mm,退1 mm,颅内注射速度为2 μL/min,注射完毕留针 5 min,缓慢拔针。骨孔用骨蜡封闭,术野用0.9%NaCl冲洗后缝合切口。术后单笼饲养。
1.3 实验观察指标
1.3.1 接种后动物处理及一般情况观察:大鼠接种后置笼自然苏醒,常规饲养,连续7 d皮下注射青霉素;每天观察动物的进食、饮水、运动及精神等状态;记录死亡时间;每2天称重1次。
1.3.2 大鼠脑MRI检查:在接种后2周和3周实验动物做核磁共振成像(MRI)检查,活体观察肿瘤的生长情况。用Magnetom Ttio Tim(德国)超导3.0 Tesla成像系统(陕西西安西京医院核磁室),冠状、矢状及横断面T1加权(TR:4500 ms,TE:87 ms)扫描,层厚2 mm,Image matix:259×384。T2W1加权扫描。测量不同瘤龄肿瘤的最大左右径和上下径,计算不同瘤龄的肿瘤体积。
1.3.3 组织病理学检查:大鼠用10%水合氯醛麻醉后,经左心室快速灌注 0.9%NaCl,再灌注 4℃4% 多聚甲醛。取出全脑后,按大鼠脑表面的接种穿刺点为中心做冠状切口,观察肿瘤生长情况。并全面检查有无肺、肝脏及脑内肿瘤转移。肿瘤组织取出后置于4% 多聚甲醛在4℃后固定3~4 d。组织标本经脱水、包埋后取3 μm切片,HE染色。
1.3.4 组织病理学检查:肿瘤石蜡切片经脱蜡后进行胶质酸性纤维蛋白(glial fibrillary acidic protein,GFAP)免疫组织化学染色。一抗为兔抗大鼠GFAP (1∶150),二抗为羊抗兔(即用型)。观察GFAP在C6脑胶质瘤中的表达以确定C6胶质细胞源性肿瘤的特性。
2 结果(图2~7见彩插1)
2.1 一般情况观察
成瘤率:SD大鼠和Wistar大鼠脑内接种C6脑胶质瘤细胞的成功率均为100%(20/20)。两组动物于接种细胞后,第3天自行进食,饮水、饮食较接种细胞前减少,体重下降,反应迟钝。SD大鼠组于接种细胞后约1周情况好转,体重趋于平稳,并于细胞接种约2周时体重出现增加趋势;而Wistar大鼠组体重恢复较慢,在接种后2周时大多出现神经系统症状,有的表现为狂躁,有的出现向上观望的症状。体重结果见图1。
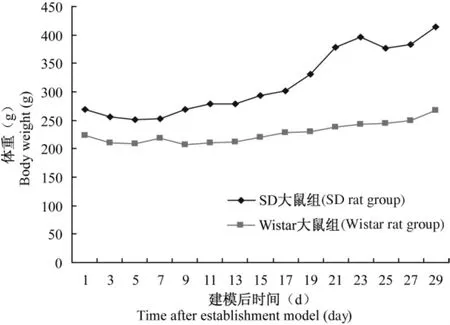
图1 SD大鼠和Wistar大鼠脑胶质瘤模型建立后体重变化Fig.1 Changes of body weight after establishment of SD rats and Wistar rats of cerebral glioma model
死亡率:观察脑内接种 C6脑胶质瘤细胞至30 d,SD大鼠组未出现死亡,Wistar大鼠组有2只死亡(分别于接种细胞第16天、第19天死亡),死亡率为10%。
2.2 大体标本及HE染色
SD大鼠组、Wistar大鼠组大体标本观察,C6细胞以接种点为中心,在大脑皮层处呈团块状生长,肿瘤形状呈不规则形或椭圆形。SD大鼠组有包膜,边界较清楚;Wistar大鼠组无包膜,肿瘤组织向周围脑组织浸润性生长。两组均未发现转移瘤。
HE染色结果显示,两个品系的接种大鼠肿瘤细胞均生长活跃,异型性明显,可见病理性分裂相。SD大鼠组肿瘤组织与正常组织之间虽然可见到肿瘤细胞浸润,但可以看到一个较明显的边界,在瘤组织内可见坏死区及液化空腔(图2),Wistar大鼠组组肿瘤组织与正常组织之间可见到明显的肿瘤细胞浸润,边界不清,瘤组织内可见肿瘤血管和血窦形成(图3)。
2.3 GFAP免疫组织化学、Wistar大鼠脑胶质瘤模
SD大鼠、Wistar大鼠脑胶质瘤模型的瘤组织内均可见散在的GFAP阳性细胞(图4,图5)。表明肿瘤为胶质细胞来源。
2.4 核磁共振影像学检查
核磁共振观察证实,SD大鼠、Wistar大鼠脑内接种C6脑胶质瘤细胞的成功率为100%。且SD大鼠、Wistar大鼠均未见转移(图6,图7)。SD大鼠组的个别动物的肿瘤出现体积显著减小,有自愈倾向。Wistar大鼠的肿瘤未出现体积减小的现象。
3 讨论
建立可靠的动物模型是进行各种实验研究的基础,大鼠C6脑胶质瘤同种移植瘤动物模型是脑胶质瘤实验研究中应用最为广泛的模型之一[4]。C6细胞是经过N-亚硝基甲脲(N-nitosomethylurea)诱发的Wistar大鼠脑胶质瘤细胞系。该细胞经体外和体内传代培养,生长稳定并具有 GFAP和 S-100蛋白等胶质瘤特异性标志。大鼠脑内接种后肿瘤形成较快,种植肿瘤成活率较高,大鼠体内胶质瘤生长特点与人较为接近,所以广泛应用于脑胶质瘤治疗的实验研究[5]。本实验中利用C6脑胶质瘤建立的SD大鼠、Wistar大鼠脑胶质瘤动物模型的成功率均为100%。有研究报道 C6脑胶质瘤动物模型接种悬液的细胞数量影响模型的成功率[6]。本实验在细胞接种方面主要由以下几个方面的改进:1)接种细胞数:本实验接种 C6细胞的密度为2.5×107/mL,细胞总量控制在(2.5~3)×105个细胞/只之间,接种细胞悬液体积控制在10 μL,与国内外报道接种细胞数量在 105~107之间的一致[7,8]。2)消化细胞:为尽量避免细胞受损,在细胞处理方面本实验也稍有改进。将细胞消化后用Hanks液洗涤2次,再以Hanks液制成细胞悬液,改为将细胞消化后,先用含10%血清的 DMEM液终止消化,再用不含血清DMEM液洗涤,最后以DMEM液制成细胞悬液,离心时间也由8 min缩短至4 min,从而尽量减少洗涤细胞、离心等处理细胞的时间,使细胞处于良好的状态,保证接种成功率。接种前充分混匀细胞悬液,避免堆积,保证均匀的单细胞悬液。3)进针深度:硬膜下进针3 mm,退1 mm。这样在靶点处留一空隙,既防止细胞溢出,使细胞充分沉积,又延长了肿瘤细胞与靶组织的接触时间,从而提高成瘤率。4)建立大批量动物模型时C6细胞的代次与模型一致性的关系:本课题组在长期、大量建立大鼠脑胶质瘤动物模型实验中,首先保证每次接种的所有细胞均为同一冻存批次;其次,细胞复苏后均传代2次,第二次传代时,接种细胞数要有一定的梯度,从而保证连续2~3 d接种时均能有满足要求的细胞;细胞接种前24 h换培养液;接种细胞时,各个环节要配合好,尽量缩短动物麻醉、接种部位定位的时间,每消化一次细胞接种2~3只动物;另外,处理细胞条件保持一致,包括培养液、血清、缓冲液、消化液,以及洗涤细胞时间、离心时间等。满足以上要求,我们就能建立均匀一致的脑胶质瘤动物模型。我们根据上述方法建立的脑胶质瘤动物模型肿瘤成瘤率高,SD大鼠组、Wistar大鼠组成瘤率均为100%;肿瘤细胞生长稳定,肿瘤细胞具有分化程度低,微血管丰富,生长迅速,与人胶质瘤的生长特性相似,可作为基础、临床脑胶质瘤病因学、药效学研究的动物模型。
本实验结果显示,SD大鼠组、Wistar大鼠组在脑胶质瘤肿瘤组织内胶质瘤细胞GFAP反应呈弱阳性,周围胶质瘤细胞呈强阳性,且细胞数明显多于远离肿瘤的组织,与相关报道相一致[9]。GFAP与胶质细胞的分化程度有关,由于胶质瘤细胞分化比较幼稚,所以肿瘤内细胞GFAP呈弱阳性,肿瘤周围胶质细胞数量较多且呈强阳性,可能与胶质瘤刺激周围脑组织引起的胶质细胞增生有关。
本实验中发现,SD大鼠组有包膜,边界清楚,与文献报道一致[10]。SD大鼠组的个别动物的肿瘤出现体积减小,接种细胞2周后体重呈上升趋势,提示SD大鼠的C6胶质瘤可能因自身免疫活性较高而有自愈倾向[11],出现自然消亡。此结果表明,SD大鼠的脑胶质瘤动物模型不适合用于脑胶质瘤的病因学、药效学、血脑屏障等相关研究;而Wistar大鼠肿瘤细胞浸润明显,与周围正常脑组织边界不清,肿瘤体积呈进行性增长,这些特性与人恶行脑胶质瘤类似,因此在做此类相关研究时应选用Wistar大鼠制备脑胶质瘤动物模型。
[1] 郭敏,关丽明,戚喜勋.大鼠C6脑胶质瘤模型建立及X刀治疗的护理[J].中国比较医学杂志,2007,17(2):123-124.
[2] Samuel V,Emmanuel L,Barbier,et al.In vivo MRI tracking of exogenous monocytes/macrophages targeting brain tumors in a rat model of glioma[J].Neuroimage,2008,40(2):973-983.
[3] Doblas S,Saunders D, KshirsagarP, etal. Phenyl-tertbutylnitrone induces tumor regression and decreases angiogenesis in a C6 rat glioma model[J].Free Radic Biol Med,2008,44 (1):63-72.
[4] 王煜,牛洪泉,董芳永,等.大鼠树突状细胞疫苗治疗脑胶质瘤的实验研究[J].中国神经外科疾病杂志,2005,10:115-117.
[5] 林健,王伟民,徐如祥.C6大鼠胶质瘤模型及其在脑胶质瘤治疗研究中应用的缺陷[J].中华神经医学杂志,2003;2(2): 154-156.
[6] 高大宽,章翔,吴景文,等.建立大鼠 C6脑胶质瘤模型的有效方法[J].中华实验外科杂志,2000,17(1):93.
[7] 李维方,张光霖,朱诚,等.VEGF反义寡核苷酸抑制荷瘤大鼠胶质瘤血管生成的作用和效果[J].解放军医学杂志,2003,28(2):144-145.
[8] Watanabe K,Sakamoto M,Somiya M,et al.Feasibility and limitation of the rat model by C6 gliomas implanted at the subcutaneous region[J].Neurol Res,2002,24(5):485-490.
[9] Sasaki T,YamazakiK, YamoriT, etal. Inhibition of proliferation and induction of differentiation of glioma cells with Datura stramonium agglutinin[J].Br J Cancer,2002,87(8): 918-923.
[10] Farrell CL,Stewart PA,Del Maestro RF.A new glioma model in rat:the C6 spheroid implantation technique permeability and vascular characterization[J].J Neurooncol,1987,4(4):403-415.
[11] Vince GH,Bendszus M,Schweitzer T,et al.Spontaneous regression of experimental gliomas:an immunohistochemical and MRI study of the C6 glioma spheroid implantation model[J]. Exp Neurol,2004,190(2):478-485.
Establishment and Comparison of Sprague-Dawley Rats and Wistar Rats of Cerebral Glioma Model
WANG Xiao-wu1,LI Kang-chu1,DING Gui-rong1,XU Sheng-long1,ZHOU Yong-chun1,TAN Juan1,CHANG Ying-juan2,GUO Guo-zhen1
(1.Department of Radiation Medicine,Faculty of Preventive Medicine,Xi'an 710032,China; 2.Department of Radiology,The Fourth Military Medical University,Xi'an 710031,China)
ObjectiveTo establish C6(2.5×105cell/rat)glioma model in two different strains rats(Sprague-Dawley rats and Wistar rats)and to compare the growth patterns of intracranial tumors in order to provide a suitable proexperimental model system for the study of neoplastic gliomas。MethodsThe rats were placed on a stereotactic head holder and C6 cells of glioma were stereotaxically implanted into the right cerebral cortext region of Sprague-Dawley(SD) rats and Wistar rats.After C6 cells inoculation,we observed the living state of rats,tumor volumes,tumor histopathology and the expression of GFAP in tumors by pathology,immunohistochemistry and magnetic resonance imaging(MRI). Results The formation rate of brain tumor was 100%in SD rats and Wistar rats,none of them had distant metastasis. However,the tumor formation time of SD rats was longer than that of Wistar rats and some SD rats with intracranial tumorshad the tendency of spontaneous cure。ConclusionThe Wistar rat C6 glioma resembles human glioma in histopathological and morphological features,therefore,it can be used as an ideal model for studying huaman glioma's pathogenesy and therapeutic strategy.Because the brain tumors formed in SD rats is more like metastatic tumors,and these tumors had the tendency of spontaneous cure,it is not suitable as an experimental model for human glioma.
Glioma;Model,animal;Sprague-Dawley rats;Wistar rats
R-739.41
A
1671-7856(2010)05-0008-04
2009-12-15
国家自然科学基金(No.60871068)和全国优秀博士学位论文作者专项基金(No.200465)。
王晓武(1972-),女,博士,高级实验师。E-mail:xiaowu0330@yahoo.con.cn
郭国祯,男,教授,博士导师,研究方向:电磁辐射生物学。E-mail:guozhen@fmmu.edu.cn
丁桂荣,女,教授,硕士导师,研究方向:电磁辐射生物学。E-mail:dingzhao@fmmu.edu.cn
