结核分枝杆菌膜蛋白Rv0849免疫学特性的初步检测
2010-09-07胡志东陈淑丹罗如松王洪海张雪莲
胡志东, 陈淑丹, 罗如松, 刘 伟, 曹 健, 王洪海, 张雪莲
(1.复旦大学生命科学学院遗传工程国家重点实验室 上海200433; 2.河南工业大学生物工程学院 河南郑州450001)
结核分枝杆菌膜蛋白Rv0849免疫学特性的初步检测
胡志东1,2, 陈淑丹1, 罗如松1, 刘 伟1, 曹 健2, 王洪海1, 张雪莲1
(1.复旦大学生命科学学院遗传工程国家重点实验室 上海200433; 2.河南工业大学生物工程学院 河南郑州450001)
探讨了结核分枝杆菌膜蛋白Rv0849作为药泵蛋白的转运功能及其作为外源蛋白免疫诱导C57BL/6小鼠产生免疫应答的能力.从H37Rv基因组中扩增获得Rv0849基因,酶切后连接到分枝杆菌穿梭质粒pMV 261上构建重组质粒pMV 0849,并以耻垢分枝杆菌为载体构建获得重组菌株SM(0849).检测药物对重组菌株SM(0849)的最小抑菌浓度(M IC)变化,用重组菌株免疫C57BL/6小鼠检测其作为外源蛋白免疫诱导小鼠产生的免疫应答反应.结果表明,重组菌株SM(0849)对药物的耐受性没有明显提高,但能够较早、较好地诱导小鼠体液免疫应答水平,并能通过刺激小鼠脾脏淋巴细胞促使其分泌高水平的肿瘤坏死因子-α和干扰素-γ.Rv0849所编码的蛋白具有较弱的药泵功能,但有潜力成为一种新的免疫抗原.
结核分枝杆菌;Rv0849;耻垢分枝杆菌;TNF-α;IFN-γ
0 引言
结核分枝杆菌(M ycobacterium tubercu losis,M TB)是迄今为止发现的最为严重的传染病病原体之一.据估计,全世界有1/3的人口感染此菌.近年来,卡介苗对成人保护效果的下降以及多重耐药结核分枝杆菌的出现给临床治疗带来了很大挑战[1].
膜蛋白和膜相关蛋白在细菌生长繁衍中扮演着至关重要的角色,例如细胞间的相互作用、离子和营养物质的转运、细胞信号以及与致病机制相关[2].其中,药物外排泵是细菌膜蛋白比较重要的功能之一,细菌主动外排是导致其产生多重耐药的重要原因[3].另外,膜蛋白直接暴露在细胞表面,与宿主免疫活性细胞的相应膜受体相互作用,刺激细胞和体液免疫的形成,具有良好的免疫原性[4].因此,膜蛋白被认为是抗结核药物和疫苗开发的主要靶点所在.Rv0849是结核分枝杆菌H37Rv基因组中编码膜蛋白的基因之一,被定义为可能的药物外排泵编码基因[5].进行TM HMM分析表明其含有12个跨膜区,具有较好的免疫原性.目前国内外尚未见到关于此蛋白在药物外排中的作用以及免疫特性的报道,本文针对该基因编码蛋白进行了探索性研究.
1 材料与方法
1.1 材料
结核分枝杆菌H37Rv、大肠杆菌菌株(Escherichia coli)DH5α、耻垢分枝杆菌(M ycobacterium smegm atis,SM)、穿梭载体pMV 261均为本实验室保存;卡那霉素购自Sigma公司;限制性内切酶Eco RI、H indⅢ、DNA M arker以及T4DNA连接酶购自TaKaRa公司;p fu Tag DNA聚合酶、胶回收试剂盒、质粒抽提试剂盒购自全式金生物公司;引物合成和DNA序列测定由上海生工生物工程有限公司完成;M illerbrook 7H9、7H10培养基购自D IFCO公司;C57BL/6(平均25 g,雌性)小鼠购自上海第二军医大学;EL ISA试剂盒购自eBioscience公司;其余化学试剂均为国产分析纯.
1.2 实验方法
1.2.1 重组质粒的构建 根据GenBank中结核分枝杆菌Rv0849的基因序列,使用软件p rimer5设计引物.上游引物:CACA TGGGAGCGCGCGCTA TA TTC,下游引物:CTTCACCGGGGTGCA GCCCA,其中下划线部分分别为Eco RⅠ和H indⅢ限制性酶切位点.PCR反应条件:94℃变性30 s,60℃退火1 min,72℃延伸2 min,如此30个循环.PCR产物纯化回收后,与穿梭载体pMV 261经核酸内切酶酶切后用T4DNA连接酶16℃连接过夜,转化至大肠杆菌DH5α感受态细胞,涂布在含有50 mg/L卡那霉素的LB固体培养基上,筛选阳性克隆.抽提重组质粒,酶切鉴定正确后,提交上海生工生物工程有限公司测序.
1.2.2 耻垢分枝杆菌的感受态制备 耻垢分枝杆菌培养于7H9培养基(含体积分数10%ADC),37℃摇床培养2~3 d后达到对数生长期,菌液先冰浴2 h,然后8 000 r/min离心15 min收集菌体,用无菌预冷的体积分数10%甘油洗涤3次后,重悬于预冷的甘油中过夜,备用.
1.2.3 耻垢分枝杆菌的电转化 采用0.2 cm间距电转杯(Bio-Rad Laboratories,Inc.,Hercules,CA), Gene PulserⅡ电转化系统(Bio-Rad Laboratories,Inc.),感受态耻垢分枝杆菌细胞500μL,重组质粒30μL.电转化条件为:室温,500 V,25μF,1 000Ω.细菌在7H9培养基中37℃活化4 h后,涂布于含有50 mg/L卡那霉素的7H10培养基,37℃培养2 d.挑取可以在卡那霉素抗性平板上生长的单个阳性克隆.经过大量培养后提取阳性克隆的基因组,并利用PCR方法进行目的条带鉴定.同时,从可扩增出目的条带的阳性克隆中提取质粒,酶切鉴定,正确者命名为SM(0849),保存菌种.同样方法将空载体pM V 261电转化到耻垢分枝杆菌中,获得重组菌株并命名为SM(261),在后期实验中作为对照.
1.2.4 重组菌株最小抑菌浓度(M IC)测定 为评价Rv0849是否具有药泵蛋白的功能,特别是对喹诺酮类药物的耐药性,采用测定过表达目的基因的重组耻垢分枝杆菌对各类药物的M IC的方法.将相同菌量(106CFU/m L,100μL)的菌液均匀涂布在含有不同浓度药物的细菌培养板,37℃培养2 d后,观察细菌生长情况,统计不同药物对细菌的生长影响,M IC定义为抑制细菌生长的最小药物浓度.检测的药物包括抗结核一线药物异烟肼(INH)、利福平(RIF)、乙胺丁醇(EMB)和盐酸四环素(Tet)、氯霉素(CAF)、红霉素(ETM)、氧氟沙星(OFL)和青霉素(PC)等,其中氧氟沙星属于喹诺酮类药物,药物浓度梯度和溶剂各有不同.异烟肼、利福平、乙胺丁醇、氧氟沙星以及青霉素的质量浓度从10 mg/L倍比稀释到0.039 mg/L.氯霉素质量浓度从250 mg/L倍比稀释到0.98 mg/L,红霉素与盐酸四环素质量浓度从20 mg/L倍比稀释到0.002 3 mg/ L.异烟肼、乙胺丁醇、盐酸四环素和青霉素采用无菌超纯水稀释;红霉素和氯霉素采用无水乙醇稀释;利福平采用二甲基亚砜(DM SO)稀释;氧氟沙星采用0.4 mo l/L的乙酸稀释.同时分别以相对应的溶剂做阴性对照.测定所使用菌株包括SM(0849),SM(261)以及SM.
1.2.5 小鼠的免疫 将C57BL/6小鼠随机分为4组,每组6只.实验分组包括生理盐水组、SM对照组、SM (261)组以及SM(0849)组.将培养好的细菌用PBS缓冲液冲洗2次,最后悬浮于PBS中,取一部分细菌涂板计数.取计数好的细菌液200μL,含细菌量约为5×106CFU对小鼠腹股部皮下进行注射免疫.
1.2.6 应用酶联免疫吸附试验(EL ISA)测定IgG滴度以及IgG2a/IgG1比值[6]免疫后分别于第3周和第6周处死小鼠,每组每次各3只,眼球取血,分离血清.采用EL ISA方法检测小鼠血清中的IgG含量.以全菌作为抗原,无菌超声后用包被液冲洗3次,用包被液稀释成相同浓度,取100μL菌液包被96孔板过夜,其余步骤参照试剂盒说明书,显色后用分光光度计(Bio Tek,ELx808)在490 nm处读板.
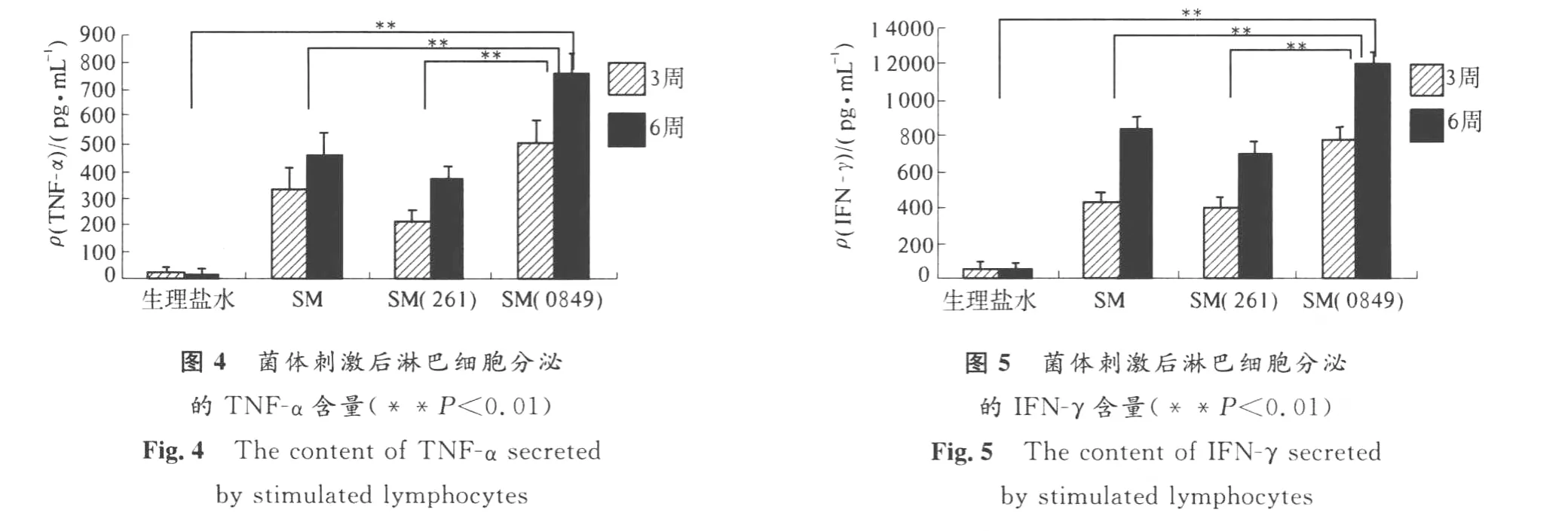
1.2.7 应用EL ISA检测TN F-α和IFN-γ 无菌分离小鼠脾脏,用PBS将压磨后的单个淋巴细胞从尼龙膜上滤过.在无菌离心管中用PBS定容至4 m L,加入等量淋巴分离液,2 500 r/min离心20 min使之分层.吸取中间层云雾状的淋巴细胞到干净离心管中,用PBS洗涤3次,最后用含体积分数10%胎牛血清的RPM I-1640培养基悬浮.取少量计数,将细胞浓度调整为5×105CFU/m L.将计数后的细胞接种于24孔细胞培养板中,接种量为每孔5×105个细胞.然后分别在相对应的细胞孔中加入等量免疫小鼠的耻垢分枝杆菌(5× 106CFU)或生理盐水后,37℃,在体积分数5%CO2培养36 h,每孔做3个重复实验.
应用EL ISA技术检测脾细胞受到细菌刺激后产生的TNF-α和IFN-γ水平,具体步骤参照试剂盒说明书操作,显色后用分光光度计(BioTek,ELx808)在490nm处读板.
1.2.8 数据处理 用Excel自带软件进行分析.根据标准曲线方程式以及标本的OD490nm值,求出相应标本的TNF-α与IFN-γ的浓度.
2 结果
2.1 重组耻垢分枝杆菌的转化鉴定
Rv0849从结核分枝杆菌H37Rv全基因组中成功扩增并克隆入分枝杆菌穿梭质粒pMV261中.重组质粒电转入SM,大量培养后提取基因组进行鉴定.通过生物信息学比较分析,结核分枝杆菌Rv0849基因在SM中的同源性很低,而Rv0849特异性引物可以从阳性克隆SM (0849)中扩增出目的条带,不能从SM(261)和SM菌中扩增出目的条带.另外,重组质粒的酶切结果也证明Rv0849基因成功转入到SM中,如图1所示.

图1 重组耻垢分枝杆菌SM(0849)的鉴定Fig.1 IdentificationoftherecombinantSM(SM(0849))
2.2 重组菌株最小抑菌浓度测定
如表1所示,各类药物对SM(0849)、SM(261)和SM的MIC差异不大,在1~2倍之间.因此,过表达Rv0849的重组耻垢分枝杆菌并没有明显提高对所测药物的耐受性,表明膜蛋白Rv0849在重组菌株中没有发挥对所测药物的外排功能.
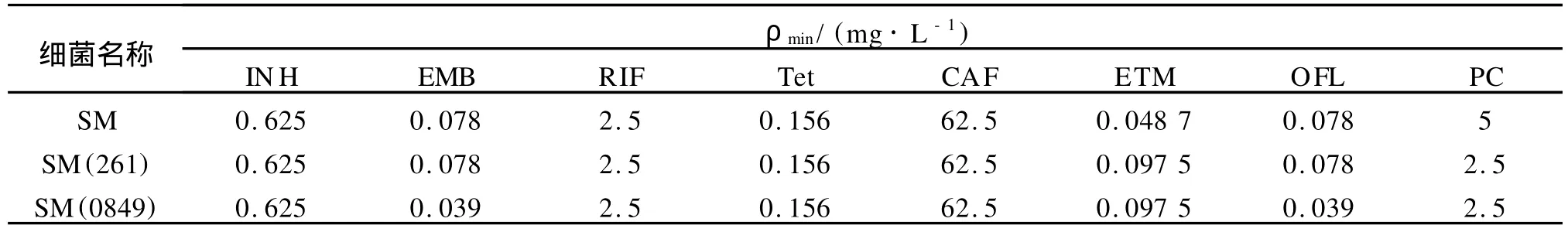
表1 药物对SM(0849)、SM(261)和SM的MIC测定Tab.1 TheMICofdrugsvsSM(0849),SM(261)andSM
2.3 重组耻垢分枝杆菌免疫小鼠血清IgG的分泌
图2显示,免疫后3周和6周,SM(0849)诱导的IgG水平显著高于生理盐水(P<0.01).免疫后3周, SM(0849)组的IgG水平显著高于其他组(P<0.05),而随着免疫时间延长至6周,SM以及SM(261)组的IgG水平和SM(0849)组相近(P>0.05).表明重组SM(0849)较快地诱导了IgG的产生,并可有效刺激机体维持产生的IgG水平,但是其诱导的IgG分泌水平并没有随时间延长而进一步升高.图3显示,SM(0849)组的IgG2a/IgG1比值在3周和6周情况下都比其他组高,且呈现IgG2a升高的趋势,差异极显著(P<0.01),表明随着重组菌株所诱导的免疫应答随时间变化向Th1型转变.

2.4 重组耻垢分枝杆菌对感染小鼠细胞免疫水平的影响
图4和图5显示,与SM和SM(261)相比,SM(0849)免疫小鼠后,较强地刺激了脾淋巴细胞分泌TNF-α和IFN-γ,且分泌水平随着时间的延长(从3周到6周)持续上升,数据差异极显著(P<0.01).表明重组菌株有效诱导了小鼠的细胞免疫应答.
3 讨论
尽管Rv0849在结核分枝杆菌H37Rv基因组中定义为可能的药物外排泵编码基因,但本实验并没有发现重组菌株对所测药物耐受性的增加,提示膜蛋白Rv0849可能并不是一个外排药物的泵蛋白,当然这也不排除膜蛋白Rv0849在转运其他物质或者其他药物的可能性.Vipona等[7]利用DNA微阵列分析技术发现,该蛋白在碳饥饿的条件下上调表达[7],提示Rv0849蛋白可能参与营养物质的转运.本文通过生物信息学对Rv0849基因序列与蛋白结构预测分析发现Rv0849蛋白含有12个跨膜区,具有较好的免疫原性,提示其具有潜在疫苗靶位的可能性.因此,将重组菌株作为抗原免疫小鼠并检测了其引发的免疫应答.
免疫系统分为细胞免疫和体液免疫,细胞免疫主要由Th1细胞介导,体液免疫主要由Th2细胞介导. Th1细胞主要分泌以IFN-γ为主的细胞因子,且IFN-γ可以激活单核巨噬细胞,产生TNF-α、IL-6和IL-1等细胞因子[8],所以IFN-γ和TNF-α的分泌水平可反映小鼠T细胞的活性,是细胞免疫的检测指标[9].而IgG1和IgG2a的检测可以代表Th1/Th2平衡,是一种Th1/Th2功能的粗略检测方法.机体中如Th1占优势,IgG2a将多于IgG1;如Th2占优势,IgG1将多于IgG2a[10].本研究结果表明,Rv0849外源抗原的引入能够快速诱导免疫小鼠产生体液免疫,但随着时间的增加,机体的体液水平不再持续升高;在细胞免疫水平上,重组SM(0849)能够有效地激起免疫小鼠体内IFN-γ和TNF-α的分泌,分泌水平明显高于SM(261)和SM免疫组,初步验证了Rv0849作为免疫抗原的可行性.而IgG2a/IgG1比值的升高,可能预示着体内免疫反应倾向于向Th1型免疫反应转变.研究表明,Th1细胞产生的IFN-γ及其刺激巨噬细胞所产生TNF-α杀死结核分枝杆菌起着至关重要的作用,而Th2反应在抗结核分枝杆菌的过程中不是有利的免疫应答方式[11].因此有必要继续深入研究该重组菌株作为抗原在机体内结核分枝杆菌感染免疫保护中作用.
本实验所用的载体为耻垢分枝杆菌,属于无致病性快速生长的分枝杆菌属成员,2~3 d就可长出典型粗糙型菌落,并且具有和BCG相似的免疫学特性,其用于结核的预防和治疗已显示出良好的效果[12].因此,本实验利用耻垢分枝杆菌作为构建结核疫苗的基因工程载体也是发展新型抗结核疫苗的一个方向.
[1] Andersen P,Doherty T M.TB subunit vaccines-putting the pieces together[J].M icrobes Infect,2005,7(5/6): 911-921.
[2] Malen H,Berven F S,Softeland T,et al.Membrane and membrane-associated p roteins in Triton X-114 extractsof M y-cobacterium bovis BCG identified using a combination of gel-based and gel-free fractionation strategies[J].Proteomics, 2008,8(9):1859-1870.
[3] Li X Z,Nikaido H.Efflux-mediated drug resistance in bacteria[J].D rugs,2004,64(2):159-204.
[4] Ding X Z,Bhattacharjee A,Nikolich M P,et al.Cloning,exp ression,and purification of Brucella suis outer membrane p roteins[J].Protein Exp r Purif,2005,40(1):134-141.
[5] Cole ST,Brosch R,Parkhill J,et al.Deciphering the biology of M ycobacterium tuberculosis from the comp lete genome sequence[J].Nature,1998,393(6685):537-544.
[6] 于成德,宋德贵,吴建国,等.SDS在H IV基因工程抗原包被中的应用研究[J].广西师范大学学报:自然科学版, 2005,23(3):70-73.
[7] Vipond J,Vipond R,A llen-Vercoe EA,et al.Selection of novel TB vaccine candidatesand their evaluation as DNA vaccines against aerosol challenge[J].Vaccine,2006,24(37/38/39):6340-6350.
[8] D reweck C M,Soboslay P T,Schulz-Key H,et al.Cytokine and chemokine secretion by human peripheral blood cells in response to viable Echinococcusmultilocularis metacestode vesicles[J].Parasite Imm unol,1999,21(8):433-438.
[9] Cohn L,Homer R J,Niu N,et al.T helper 1 cells and interferon gamma regulate allergic airway inflammation and mucus p roduction[J].J Exp Med,1999,190(9):1309-1318.
[10] 王钦富,王永奇,郭连英,等.过敏小鼠模型Th1/Th2漂移和纠正[J].中国免疫学杂志,2007,7(23):597-599.
[11] Giacomini E,Iona E,Ferroni L,et al.Infection of humanmacrophagesand dendritic cellsw ith M ycobacterium tuberculosis induces a differential cytokine gene exp ression that modulates T cell response[J].Journal Immunol,2001,166 (12):7033-7041.
[12] Falcone V,Bassey E,Jacobs W J,et al.The immunogenicity of recombinant M ycobacterium smegmatis bearing BCG genes[J].M icrobiology,1995,141(Pt5):1239-1245.
Immunology Characteristics of M ycobacterium tuberculosis Membrane Protein Rv0849
HU Zhi-dong1,2,CHEN Shu-dan1,LUO Ru-song1,L IU Wei1, CAO Jian2, WANG Hong-hai1, ZHANG Xue-lian1
(1.State Key L aboratory of Genetic Engineering,Institute of Genetics,School of L ife Sciences, Fudan University,Shanghai 200433,China;2.College of B ioengineering, Henan University of Technology,Zhengzhou 450001,China)
The function of M ycobacterium tuberculosis membrane p rotein Rv0849 as a drug efflux pump and a p romising vaccine antigen target is characterized.Rv0849 gene is amp lified from M ycobacterium tubercu losis H 37Rv strain genom ic DNA and linked into shuttle p lasmid pMV 261 to construct recombinant plasmid pMV 0849,then using M ycobacterium smegm atis(SM)as a host to construct recombinant strains named SM(0849).The M ICs of recombinant strains against various drugs are analyzed and the effect of immunity response using C57BL/6 mice inoculated by SM(0849)is evaluated.The tolerance of recombinant strains SM(0849)against drugs is not increased obviously compared w ith w ild type.Moreover,it can considerably inducemice’s humoral imm unity earlier and stimulate T lymphocytes to secrete high level of tumo r necrosis facto r-α (TNF-α)and interferon-γ(IFN-γ),w hich participate in cellular immunity.The results indicate that Rv0849 has less ability as a drug efflux,butmight be a novel immune antigen target worthy of further investigation.
M ycobacterium tubercu losis;Rv0849;M ycobacterium smegm atis;TNF-α;IFN-γ
Q 939.93
A
1671-6841(2010)03-0114-05
2009-11-03
国家“863”高技术研究发展计划资助项目,编号2007AA 02Z316;国家“十一五”重大传染病计划资助项目,编号2008ZX10003006-2;国家自然科学基金资助项目,编号30901828.
胡志东(1986-),男,硕士研究生,主要从事抗结核药靶和疫苗研究,E-mail:huzhidong2008@163.com;通讯联系人:张雪莲(1975-),女,讲师,博士,主要从事防治结核病基础研究,E-mail:xuelianzhang@fudan.edu.cn.
