黄渤海松江鲈鱼线粒体控制区结构与序列多态性分析
2010-09-05刘海林章群唐优良余帆洋周佳怡
刘海林,章群,唐优良,余帆洋,周佳怡
(暨南大学水生生物研究所,广东省水体富营养化与赤潮防治重点实验室,广东 广州,510632)
黄渤海松江鲈鱼线粒体控制区结构与序列多态性分析
刘海林,章群,唐优良,余帆洋,周佳怡
(暨南大学水生生物研究所,广东省水体富营养化与赤潮防治重点实验室,广东 广州,510632)
测定了辽宁丹东、盘锦与河北秦皇岛35尾松江鲈鱼线粒体控制区序列977 bp。共检出单倍型30个,多态位点35个,简约信息位点27个,绝大多数变异集中在192-342 bp、594-783 bp区段,同时识别出了线粒体控制区5’端终止序列区、中央保守区和3’端保守序列区的关键序列。3个群体总的单倍型多样性为0.990,核苷酸多样性为0.007 18,丹东群体核苷酸多样性最高(0.009 59)。群体间、群体内平均遗传距离低(分别为0.006 7和0.006 3);在NJ树上不同地理来源的个体混杂分布;Fst分析显示丹东与秦皇岛群体间遗传分化相对较大(0.142 22, p<0.05),其余不明显(0.028 65-0.056 16, p>0.1),表明3个群体有可能隶属同一个种群。核苷酸不配对分布图表明松江鲈鱼可能未经历过大规模的种群扩张。
松江鲈鱼;黄渤海群体;线粒体控制区结构;遗传多样性
松江鲈鱼(Trachidermus fasciatus Heckel)隶属鲉形目(Scorpaeniformes)杜父鱼科(Cottidae)的松江鲈鱼属(Trachidermus),俗名“四鳃鲈”、“花鼓鱼”等,是东亚暖温带沿海的一种降河洄游性鱼类[1]。主要分布在中国东部、日本南部、朝鲜西南及菲律宾等沿海地区,居中国“四大淡水名鱼”之首,具有较高的营养价值和经济价值[2]。但近年来,由于环境污染、气候变化、江河沿海水利设施修建对鱼类洄游通道的阻断以及误捕滥捕等原因,松江鲈鱼种群数量急剧下降,在一些原有分布记录的水域已难觅其踪迹,现已被列为国家二级保护动物。因此,对于松江鲈鱼种质资源的管理保护和开发利用工作显得尤为重要和紧迫[3,4]。
目前对松江鲈鱼的报道多集中在资源调查与保护、繁育及生理生态等方面[3,5-8],遗传多样性的研究相对较少,而遗传多样性的高低是评判物种对环境的适存能力和进化潜力的依据,了解物种遗传多样性是种质资源保护和开发利用的基础[9]。王金秋等(2002)研究了鸭绿江流域松江鲈鱼同工酶的遗传变异[10]。徐建荣等(2008, 2009)开展了丹东和秦皇岛松江鲈鱼遗传多样性的AFLP(Amplified Fragment Length Polymorphism)和ISSR(Inter-simple Sequence Repeat)分析[11,12]。非编码的线粒体控制区(mitochondrial D-Loop)受选择压力较小,进化速率比编码的核基因快,含有更为丰富的遗传变异信息;作为核基因分子标记的有效补充,已广泛应用于种群鉴定、遗传多样性、系统地理学等研究领域[13-15]。目前关于松江鲈鱼线粒体控制区基因的研究报道鲜见,本研究测定了丹东、盘锦、秦皇岛3个松江鲈鱼地理群体的线粒体控制区基因序列并对其进行结构分析,探讨松江鲈鱼种群的遗传结构、遗传多样性和种群动态等,以期为松江鲈鱼相关研究工作的开展提供参考。
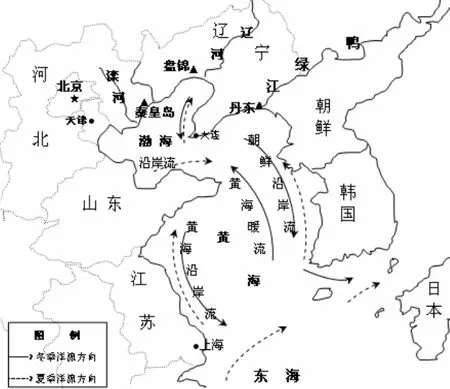
图1 采样地点及洋流Fig. 1 Sampling locations and ocean currents
1 材料和方法
1.1 样品采集、DNA提取及PCR扩增
采集到松江鲈鱼共35尾,体长50.6-149.1mm,平均为91.78 mm,标准差28.05,其中辽宁丹东15尾(编号:DD1-15),盘锦6尾(编号:PJ1-6),河北秦皇岛14尾(编号:QHD1-14)。所有样品肌肉用95%乙醇保存,采样地点见图1。DNA的提取及PCR扩增参考陈艺燕等(2006)[16]。PCR扩增引物为CrF:5′-tcggtcttgtaatccgaagatcggaggtt-3’和CrR: 5’-agtcaggaccaagcctttgtgc-3’。PCR产物经1%琼脂糖凝胶电泳检测合格后,送至北京六合华大基因公司进行测序,测序引物与PCR扩增引物相同。
1.2 序列测定及数据处理
序列经人工校对后,利用ClustaX1.83作序列比对。MEGA4.0软件分析序列碱基组成、遗传距离及序列相似性。以Genbank下载的西刺杜父鱼Cottus Kazika(登录号:AB188157)为外类群,利用MEGA4.0 的Kimura 2-parameter模型构建邻接(Neighbor-Joining, NJ)树。进化树评估采用Bootstrap 1000次重复抽样检验。DnaSP5.10软件分析群体单倍型多样性(Hd)、核苷酸多态性(π),并作Tajima’s、Fu & Li’s检验计算群体间Fst、Nm值。TCS1.21软件分析单倍型分布情况。Arlequin3.11软件作核苷酸不配对分布和AMOVA分析。
2 结果与分析
2.1 松江鲈鱼D-Loop序列特征
松江鲈鱼D-Loop序列比对长度为977bp,其中保守位点941个,多态位点35个(占3.58%),简约信息位点27个,符合线粒体控制区序列变异大的特点。多数变异位点集中在192-342 bp、594-783 bp区段内;丹东DD5、8、10、12、13在742bp处插入一个碱基T,DD1、2、6、11、14在747-755位置缺失9个碱基,其余序列均无上述插入与缺失情况。序列T、C、A、G平均含量为29.7%、21.8%、30.9%、17.6%;(A+T)%>(G+C)%。序列存在转换、颠换、插入和缺失4种类型,转换数5,颠换数3,转换/颠换比为1.8。
线粒体控制区序列可分为5’端终止序列区(terminal associated sequences,TAS)、中央保守区(central conserved sequence block)、3’端保守序列区(conserved sequence block)。其中中央保守区可依次分为CSB-F、CSB-E、CSB-D、CSB-B、CSB-C区,3’端保守序列区可分为CSB1、CSB2、CSB3区[17]。在图2中,松江鲈鱼线粒体控制区5’端TAS普遍形式 为(---表示发生转换、颠换或缺失的碱基;……表示序列省略;下划线表示相似关键序列;下同),其中TACAT与ATGTA互为反向互补序列,可形成发夹结构,与鲤科鱼类TAS关键序列相似[18,19],但在前半段出现了一对位置交换的TACAT…ATGTA互补序列重复。中央保守区CSB-F普遍形式为ATGT T……ACCAGCTAGAACCTCATT……ACCAT……AGAACC,鲤科(ATGTAG----GAGACCACC)、鲿科鱼类(ATGTAGTAAGA-ACCA-CAACC)略有不同[18-20]。CSB-E普遍形式为TGAGGGACAAGT-ATT CGTGGGGGT,与鲿科鱼类结构相似[20]。CSB-D普遍形式为TATTCTTA……AAT(T/C)TGTA,与鲤科鱼类相似[18,19]。CSB1普遍形式为TGATTTATT ACTCGAAACT……ATTTACCCCCC,与鳑鲏CSB1(TT-ATTATTGAA-GAC ATA,其后有1个TATGCCCCC序列)结构相近,并未发现较为保守的GACATA序列,但在CSB1之后发现有1个多C碱基的TTTACCCCCC序列[18]。CSB2 和CSB3的普遍形式为TAAACCCCCCTACCCCCCTAAA和CTGTAAACCCCCCGGAAACA G,与鳑鲏、大口胭脂鱼、雅罗鱼、溪鳉、鲿科、沙鳅亚科等鱼类相似[18-24],但与溪鳉CSB3(CATTACAAACT-TAAACCA) 略有不同[23]。
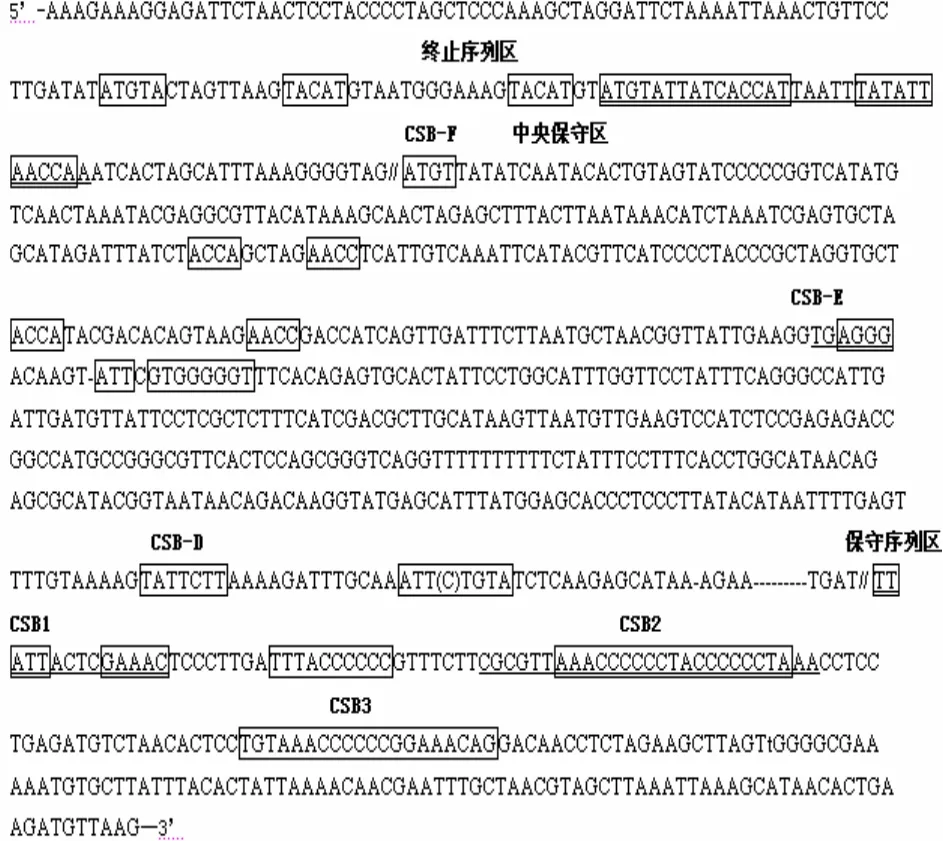
图2 松江鲈鱼线粒体控制区各部分序列结构Fig. 2 Structure of D-Loop sequence of Trachidermus fasciatus
2.2 系统发育和遗传分化
松江鲈鱼地理群体内遗传距离分别为:丹东0-0.016;盘锦0.001-0.008;秦皇岛0-0.009,其中丹东DD2与DD6、秦皇岛QHD12与QHD14间遗传距离均为0。群体间的遗传距离范围为0.005-0.008,平均值为0.006 7,小于花鲈群体间的平均遗传距离(0.008)和鲚属群体间平均遗传距离(0.017-0.098)[25,26]。不同地理来源的个体PJ1与QHD2及PJ3、QHD13与DD13间遗传距离均为0。在以西刺杜父鱼AB188157为外类群构建的NJ系统树中,丹东、盘锦、秦皇岛群体均未单独聚类;虽然少数同一地理来源的个体聚在同一分支内,但节点的支持率并不高;不同地理来源的个体大部分混杂在一起,未发现明显的地理结构(图3)。
在表1中,盘锦与丹东、秦皇岛群体间的Fst值远低于丹东与秦皇岛群体间Fst值,丹东与秦皇岛群体间遗传分化程度相对大些。丹东与秦皇岛群体间1<Nm<4,表现出一定程度的基因交流;丹东、秦皇岛与盘锦群体间Nm值均大于4,基因交流频繁。AMOVA分析结果显示,群体间遗传变异约占17.034 82%,遗传变异主要来自群体内部。
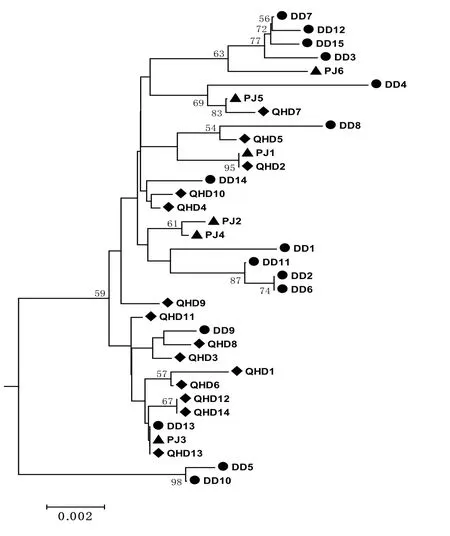
图3 基于线粒体控制区基因序列的NJ系统树Fig. 3 NJ tree based on D-Loop sequences of Trachidermus fasciatus

表1 群体间遗传分化指数 (Fst) 和基因流 (Nm)Tab. 1 Genetic differentiation index (Fst) and gene flow (Nm) between populations
2.3 遗传多样性和种群动态
35 尾松江鲈鱼共检出30个单倍型(haplotype)(表2)。TCS1.21分析单倍型分布情况显示,DD2与DD6、QHD12与QHD14、PJ1与QHD2分别共享同一单倍型;PJ3、QHD13与DD13共享同一单倍型,其余每个个体独享一种单倍型。各群体的单倍型多样性(Hd)维持在一个较高水平(0.989-1.000):盘锦>丹东>秦皇岛。核苷酸多样性 (π)丹东>盘锦>秦皇岛。总体显现单倍型多样性高(0.990)而核苷酸多样性低(0.007 18)。各群体和整体的Tajima’s D均为负值且未达显著水平(P >0.1)。Fu&Li′s检验亦为负值,未达显著水平(P >0.1),表明我国黄渤海松江鲈鱼可能未经历种群快速扩张。核苷酸不配对分布呈不规则的多峰曲线,不符合种群扩张的单峰曲线模式,也说明松江鲈鱼可能未经历大规模的种群扩张过程(图4)。
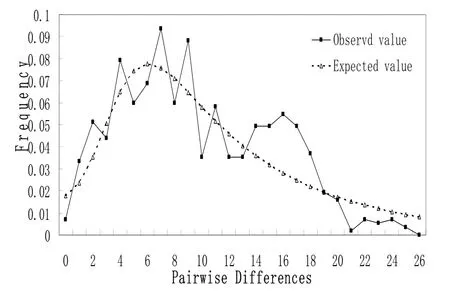
图4 松江鲈鱼D-Loop序列核苷酸不配对分布图Fig. 4 Mismatch distribution for the D-Loop sequences

表2 基于松江鲈鱼线粒体D-Loop序列的群体遗传变异Tab. 2 Genetic variation based on mitochondrial D-Loop sequences in Trachidermus fasciatus populations
3 讨 论
3.1 松江鲈鱼种群遗传多样性分析
松江鲈鱼3个地理群体表现单倍型多样性高(0.989-1.000)而核苷酸多样性低(0.004 51-0.009 59)的特点,这种现象在鳀鱼(Engraulis japonicus)、凤鲚(Coilia mystus)、鳓鱼(Ilisha elongata)等多种鱼类中也存在[27-29]。这可能与松江鲈鱼种群起源较晚有关,在一个较短的历史时期内,群体内部因少量的碱基突变即可使单倍型多样性得到快速积累,而对于核苷酸多样性的累积贡献却不明显[14]。
盘锦、秦皇岛群体遗传多样性低而丹东群体遗传多样性相对较高,可能有历史和现实两方面的原因:在第三纪至晚更新世时期,大规模的造山运动和火山活动,使原渤海区域基底构造变化,导致整体下沉,引发海侵。此后多次大范围的海侵和洋面的回升使渤海海面进一步扩大,冀鲁平原与下辽河平原也随之分离开[30]。可能在此时期,生活在鸭绿江水域及邻近水域(辽东半岛东海岸、海侵前的黄渤海交界处的原海岸区域及山东半岛东北海岸区)、在遗传多样性和亲缘上较近的松江鲈鱼原始种群中的一部分随着海侵过程或者沿岸流迁入渤海,在不同的河口海岸栖息并繁衍至今,逐渐形成了新的地理群体,如盘锦和秦皇岛群体,在经历过了奠基者效应之后,遗传多样性有所降低。而未发生迁移的其它原始群体继续留栖生活在鸭绿江及邻近水域,如丹东群体,由于未经历过瓶颈效应或受影响较小,故而遗传多样性相对高些[31];盘锦、秦皇岛群体遗传多样性低的现实原因可能与环渤海经济圈建设造成的水环境污染及产卵场地的破坏等原因致使种群数量锐减有关;而丹东群体遗传多样性较高可能与鸭绿江沿岸及河口附近污染源较少、当地渔民无捕食该鱼的习惯、市场需求少等有关,此外,在松江鲈鱼降海洄游和产卵时期天气已冷,渔业捕捞基本停止,无意中也保护了有限的种群资源[10]。
3.2 种群遗传分化分析
王金秋等(2008)从形态角度对辽宁、山东、浙江3个松江鲈鱼群体分析指出群体间存在向亚种分化的趋势[32]。王金秋等(2002)对鸭绿江松江鲈鱼种群的同工酶分析以及徐建荣等(2008, 2009)对丹东和秦皇岛松江鲈鱼群体的AFLP和ISSR分析,均得出种群内的遗传差异小,遗传分化不明显的结论[10-12]。本研究以松江鲈鱼线粒体基因的控制区序列作为分子标记,对不同群体进行遗传分析。Fst值显示,丹东与秦皇岛群体间基因交流最少,遗传分化相对较大;丹东和盘锦间基因交流和遗传分化程度居中,盘锦与秦皇岛群体间基因交流最频繁,遗传分化最小。这可能与黄渤海海域间连通、季节性海洋沿岸流传播频繁、地理位置又比较接近、松江鲈鱼在产卵期和幼年期近海岸短暂生活的习性等因素有关,使得不同地理群体间混杂和基因交流的机会增加,遗传分化程度降低[2,30,33]。此外,还可能与松江鲈鱼种群的历史分化时期较短等原因有关。AMOVA分析结果也显示3个群体间遗传分化不明显,遗传变异主要来自群体内部(82.965 18%),与徐建荣等 (2008,2009)研究的结论一致[11,12]。
3个松江鲈鱼群体间遗传差异较小,在NJ树显示各地理群体混杂分布,未表现一定的地理结构;群体间遗传分化不明显,彼此间基因交流频繁;核苷酸不配对分布显示种群未经历过大规模的迅速扩张;推测这3个群体可能属于同一个种群。但由于采样范围和数量的局限,上述推测并不排除中国近海松江鲈鱼存在着不同地理种群的可能性,对松江鲈鱼种群间遗传分化、遗传多样性、种群动态等研究仍有待深入。
3.3 松江鲈鱼管理保护措施
松江鲈鱼种群遗传多样性已处在较低的水平,种群的生存与繁衍正遭受着生态环境的破坏等威胁。鉴于丹东群体的遗传多样性相对较高,建议将丹东群体作为优先保护群体,建立种质资源保护区,并通过人工引种和放流来扩大盘锦和秦皇岛群体的遗传变异和数量。同时,加强对松江鲈鱼繁殖栖息地的管理,增强群众的保护意识,减少环境污染,进而实现松江鲈鱼种质资源的快速恢复和合理开发利用。
[1] 邵炳绪. 松江鲈的生态初步研究 [J]. 复旦学报, 1959, 2: 213-218.
[2] 王金秋. 松江鲈的生态学和繁殖生物学的研究进展 [J]. 水生生物学报, 1999, 23(6): 729-734.
[3] 王金秋, 成功. 鸭绿江流域中国境内松江鲈的分布 [J]. 复旦学报(自然科学版), 2001, 40(5): 471-475.
[4] 乐佩琦, 陈宜瑜. 中国濒危动物红皮书(鱼类) [M]. 北京: 科学出版社, 1998: 240-243.
[5] Takeshita N, Onikura N, Matsui S, et al. Embryonic, larval and juvenile development of the roughskin sculpin ,Trachidermus fasciatus (Scorpaeniformes, Cottidae) [J]. Ichthyological Reasarch ,1997, 44(3): 257-265.
[6] 王金秋, 潘连德, 梁天红, 等. 松江鲈鱼(Trachidermus fasciatus)胚胎发育的初步观察 [J]. 复旦学报(自然科学版), 2004, 43(2):250-254.
[7] Norio O, Naohiko T, Seiichi M, et al.Estimation of the frequency of maturity and sexual differences in the maturation period of the roughskin sculpin Trachidermus fasciatus [J]. Fisheries Science,2007, 73: 735–737.
[8] 张婷, 祝茜, 赵琦, 等. 松江鲈的研究和保护 [J]. 河北渔业,2008, 8: 29-30.
[9] 施立明. 遗传多样性及其保护层 [J]. 生命科学信息, 1990, 2:158-164.
[10] 王金秋, 石椿, 成功. 鸭绿江流域中国境内松江鲈鱼(Trachidermus fasciatus)天然种群的同工酶分析 [J]. 复旦学报(自然科学版), 2002, 41(6): 688-693.
[11] 徐建荣, 韩晓磊, 李宁, 等. 松江鲈群体遗传多样性的AFLP分析 [J]. 大连水产学院学报, 2008, 23(6): 437-441.
[12] 徐建荣, 韩晓磊, 郁建锋, 等. 松江鲈群体遗传多样性的ISSR分析 [J]. 淡水渔业, 2009, 139(11): 21-24.
[13] Grant W S, Bowen B W.Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation [J]. Journal of Heredity,1998, 89: 415-426.
[14] Avise J C. Phylogeography the History and Formation of Species[M]. Cambridge, Massachusetts London, England: Harvard University Press, 2000: 447-448.
[15] 肖武汉, 张亚平. 鱼类线粒体DNA的遗传与进化 [J]. 水生生物学报, 2000, 24(4): 384-391.
[16] 陈艺燕, 章群, 任岗, 等. 10种石斑鱼系统发育的线粒体细胞色素b 基因序列分析 [J]. 海洋科学, 2006, 30(6): 12-15.
[17] 刘红艳, 余来宁, 张繁荣. 鱼类线粒体DNA控制区的分子结构及应用进展 [J]. 水利渔业, 2008, 28(2): 4-8.
[18] 刘焕章. 鱼类线粒体DNA控制区的结构与进化:以鳑鲏鱼类为例 [J]. 自然科学进展, 2002, 12(3): 266-270.
[19] Guo X H, Liu S J, Liu Y. Comparative analysis of the mitochondrial DNA control region in cyprinids with different ploidy level [J].Aquaculture, 2003, 224(1-4): 5-38.
[20] 张燕, 张鹗, 何舜平. 中国鲿科鱼类线粒体DNA控制区结构及其系统发育分析 [J]. 水生生物学报, 2003, 27(5): 463-467.
[21] 曾青兰, 刘焕章. 大口胭脂鱼线粒体DNA控制区序列的研究 [J].湖北大学学报(自然科学版), 2001, 23(3): 261-264.
[22] Broughton R E, Dowling T E. Length variation inmitochondrial DNA of the minnow Cyprinella spilloptera [J]. Genetics, 1994,138(1): 179-190.
[23] Lee J S, Miya M, Lee Y S, et al. The complete DNA sequence of the mitochondrial genome of the self-fertilizing fishRivulus marmoratus(Cyprinodontiformes, Rivulidae) and the first description of duplication of a control region in fish [J]. Gene, 2001, 280(1-2):1-7.
[24] 唐琼英, 刘焕章, 杨秀平, 等. 沙鳅亚科鱼类线粒体DNA控制区结构分析及系统发育关系的研究 [J]. 水生生物学报, 2005,29(6): 645-653.
[25] Gao T X, Lou D, Liu J X , et al. Genetic variation among sea bass populations [J]. Acta Hydrobioogica Sinica, 2004, 28(1): 69-76.
[26] 唐文乔, 胡雪莲, 杨金权. 从线粒体控制区全序列变异看短颌鲚和湖鲚的物种有效性 [J]. 生物多样性, 2007, 15(3): 224-231.
[27] Yu Z N, Kong X Y, Guo T H, et al.Mitochondrial DNA sequence variation of Japanese anchovy Engraulis japonicus from the Yellow Sea and East China Sea [J]. Fisheries Science, 2005, 71: 299–307.
[28] 阎雪岚, 唐文乔, 杨金权. 基于线粒体控制区的序列变异分析中国东南部沿海凤鲚种群遗传结构 [J]. 生物多样性, 2009, 17(2):143-150.
[29] 吴常文, 许逸天, 吕振明, 等. 基于D-Loop基因的中国沿海鳓鱼(Ilisha elongata) 种群遗传结构研究 [J]. 海洋与湖沼, 2009,40(3): 330-337.
[30] 段永侯. 渤海海岸带变迁及其环境地质效应 [J]. 水文地质工程地质, 2000, 3: 1-5.
[31] 段永侯. 渤海海岸带变迁及其环境地质效应 [J]. 水文地质工程地质, 2000, 3: 1-5.
[32] 王金秋, 梁鸿子. 基于形态性状的松江鲈鱼(Trachidermus fasciatus) 种群鉴别 [J]. 海洋与湖沼, 2008, 39(4): 348-353.
[33] 苏纪兰.中国近海的环流动力机制研究 [J]. 海洋学报, 2001,23(4): 1-16.
Structure and genetic diversity of mtDNA D-Loop sequences among Trachidermus fasciatus stocks in Yellow Sea and Bohai Sea of China
LIU Hai-lin, ZHANG Qun, TANG You-liang, YU Fan-yang, ZHOU Jia-yi
(Institute of Hydrobiology, Jinan University; Key Laboratory for Water Eutrophication and Red-tide Control in Guangdong Province,Guangzhou 510632 , China)
977 bp mtDNA control region sequences of 35 individuals of Trachidermus fasciatus from Dandong, Panjin in Liaoning Province and Qinhuangdao in Hebei Province were surveyed,of which 35 polymorphic loci and 27 parsimony-informative sites were found in 30 haplotypes. The majority of variation was concentrated in two segments(192-342 bp, 594-783 bp). Key sequence characteristics of the central conserved region, 5’-termination region and 3’-conserved region of the mitochondrial control region were determined. The total haplotype diversity and nucleotide diversity in 3 stocks were 0.990 and 0.007 18 respectively, of which the Dandong stock had the highest nucleotide diversity (0.009 59). The average genetic distances within and among stocks were both low (0.006 7, 0.006 3),excepting the Dandong stock (0-0.016). Individuals from different sampling localities were intertwined in the NJ tree;Fst analyses revealed that certain gene flow existed among stocks, and genetic differentiation was significant between Dandong stock and Qinhuangdao stock, but that was inconspicuous in the rest stocks, indicating that the 3 stocks might belong to the same population. The mismatch distribution of the control region sequences suggested that Trachidermus fasciatus in the Yellow sea and Bohai sea might not have experienced a large-scale expansion.
Trachidermus fasciatus; stocks of Yellow Sea and Bohai Sea; mitochondrial control region structure;genetic diversity
Q244; Q959.483
A
1001-6932(2010)03-0283-06
2009-11-20 ;
2010-02-01
国家自然科学基金(30770415、40106014);留学归国人员科研启动基金(2005)资助项目
刘海林(1980-),男,山东滨州人,硕士,主要研究方向:分子生态学。电子邮箱:liuhailin2006@163.com
章群,电子邮箱:tqzhang@jnu.edu.cn
