ROCK-Ⅱ基因 shRNA质粒表达载体的构建与鉴定
2010-09-05李晓江白云深杨有庚吉林大学第二医院骨科吉林长春130041
李晓江 白云深 杨有庚 (吉林大学第二医院骨科,吉林 长春 130041)
ROCK-Ⅱ基因 shRNA质粒表达载体的构建与鉴定
李晓江 白云深 杨有庚 (吉林大学第二医院骨科,吉林 长春 130041)
目的 构建表达Rho激酶(ROCK)-Ⅱ特异性 siRNA的重组质粒。方法 按照 Elbashir等设计原则和 siRNA表达载体的要求,利用Am bion公司在线 siRNA Tatget finder软件,设计带有BamH I、Bbs I酶切黏性末端、终止识别序列和LOOP环的 shRNA,并将其克隆入载体 pGPU 6/ GFP/Neo,构建成ROCK-Ⅱ特异 siRNA重组质粒,然后进行酶切鉴定及基因测序。结果 设计的 shRNA成功克隆入载体 pGPU 6/GFP/Neo,构建成ROCK-Ⅱ特异 siRNA重组质粒,酶切鉴定及基因测序表明设计序列完全相符,目的基因序列准确无误。结论 重组质粒构建成功,为今后体外或体内研究 ROCK基因在脊髓损伤后的功能修复提供了一种有效的方法。
载体构建;RNA干扰;ROCK(Rho激酶)
RNA干扰(RNA i)是由双链 RNA介导的、在转录后mRNA水平关闭相应基因表达的过程。将与靶基因转录产物 mRNA存在同源互补序列的双链 RNA(dsRNA)导入细胞后,生成的小干扰RNA(siRNA)与RNA i特异性酶结合,形成RNA诱导的沉默复合物,具有序列特异性核酸内切酶活性,能特异性降解该mRNA,从而产生相应的功能表型缺失。本研究采用含 H 1启动子的载体 pGPU6/GFP/Neo,针对 ras基因超家族中 Rho激酶(ROCK)基因的短发夹结构 RNA(shRNA)构建靶向 ROCK-Ⅱ特异性 shRNA真核表达载体,为今后体外或体内研究 ROCK基因在脊髓损伤后的功能修复提供一种有效方法。
1 材料与方法
1.1 材料、试剂与仪器 生化培养箱、震荡培养箱(金坛仪器厂),荧光显微镜(OLYMPUS公司)。连接试剂盒、小量抽提试剂盒、凝胶回收试剂盒(Q IAGEN公司),限制性内切酶(TaKaRa公司)。
1.2 shRNA序列设计及合成 根据pGPU 6/GFP/Neo中H 1启动子启动表达 siRNA对序列的要求,利用Am bion公司在线 siRNA Tatget finder软件 (http://www.am bion.com/tech lib/m isc/ siRNA finder.htm l)设计合成 4条针对大鼠 ROCK序列的 siRNA DNA片段,分析获得的序列,选择 GC含量在 40%~55%之间的靶基因序列作为潜在优选,并在 GenBank表达序列标签(EST)数据库中用BLAST检索,将选定的序列和相应的基因组数据库进行比较,排除和其他编码序列同源的序列,以确定其为特异性序列。为了提高序列正确退火成为双链DNA分子的效率,将包含目的 siRNA序列的DNA设计为用DNA聚合酶合成的(PCR策略分别设计)包含目的基因 siRNA序列的正义链和反义链寡核苷酸序列,在正义链和反义链序列加入间隔序列TTCAAGAGA,以避免形成终止信号,使其能形成发夹结构, shRNA的转录终止序列采用 T6结构。正义链模板的 5′端添加了CACC,与Bbs I酶切后形成的黏端互补;反义链模板的 5′端添加了 GATC,与BamH I酶切后形成的黏端互补;如果 siRNA的第 1个碱基不是 G,则在 CACC后补加 1个 G。随机选取排列序列作为无干扰效果对照序列。编码 siRNA的DNA序列由上海生工合成。4条寡核苷酸链及反义链见表 1。

表1 设计、合成的4对 ROCK特异性 siRNA位点、寡核苷酸链序列及 GC含量
1.3 shRNA模板的退火 将DNA o ligo分别用 TE(pH 8.0)溶解,浓度为 100μmo l/L。取相应的正义链和反义链 oligo溶液,按照如下配比配置退火反应体系:10×shDNA退火缓冲液5μl,正义链 (100μmo l/L)5μl,反义链 (100μmo l/L)5μl, ddH2O 35μl,总体积 50μl。在 PCR仪上按照如下程序进行退火处理:95℃5m in,85℃5m in,75℃5m in,70℃5m in,4℃保存。退火处理后得到浓度为 10μmo l/L的 shRNA模板。将所得模板溶液稀释 500倍,终浓度为 20 nmo l/L,用于连接反应。
1.4 pGPU 6/GFP/Neo载体的线性化 取 2μg pGPU 6/GFP/ Neo载体,按照如下体系进行酶切处理:10×缓冲液 G 5μl, Bbs I2μl,BamH I2μl,pGPU 6/GFP/Neo 2μg,ddH2O 41μl,总体积50μl。37℃酶切 1 h,琼脂糖电泳,使用 Agarose GelDNA Purification KitVer2.0(TaKaRa)回收,电泳检测估算浓度,稀释浓度至 50 ng/μl。
1.5 pGPU 6/GFP/Neo-shRNA载体的构建 按照如下体系进行载体的连接反应:10×T4连接缓冲液 2μl,pGPU 6/GFP/Neo (Bbs I+BamH I)1μl,shRNA模板 (20 nmo l/L)1μl,T4 DNA连接酶 (5 weissU/μl)1μl,ddH2O 15μl,总体积 20μl。22℃1 h,转染到 JM 109 competent细胞。每个连接反应挑取 5个菌落,接种到含 50μg/m l Kanam ycin的 LB培养集中。使用碱裂解法抽提质粒,所得质粒用BamH I、Pst I分别酶切鉴定。阳性重组载体应该可以被BamH I切开,而不能被 Pst I切开。
2 结 果
重组载体的确切鉴定 见图 1。酶切结果表明,所有质粒均为阳性重组载体,每组选择两个克隆进行测序鉴定。测序结果见图2。

图1 重组载体的酶切鉴定
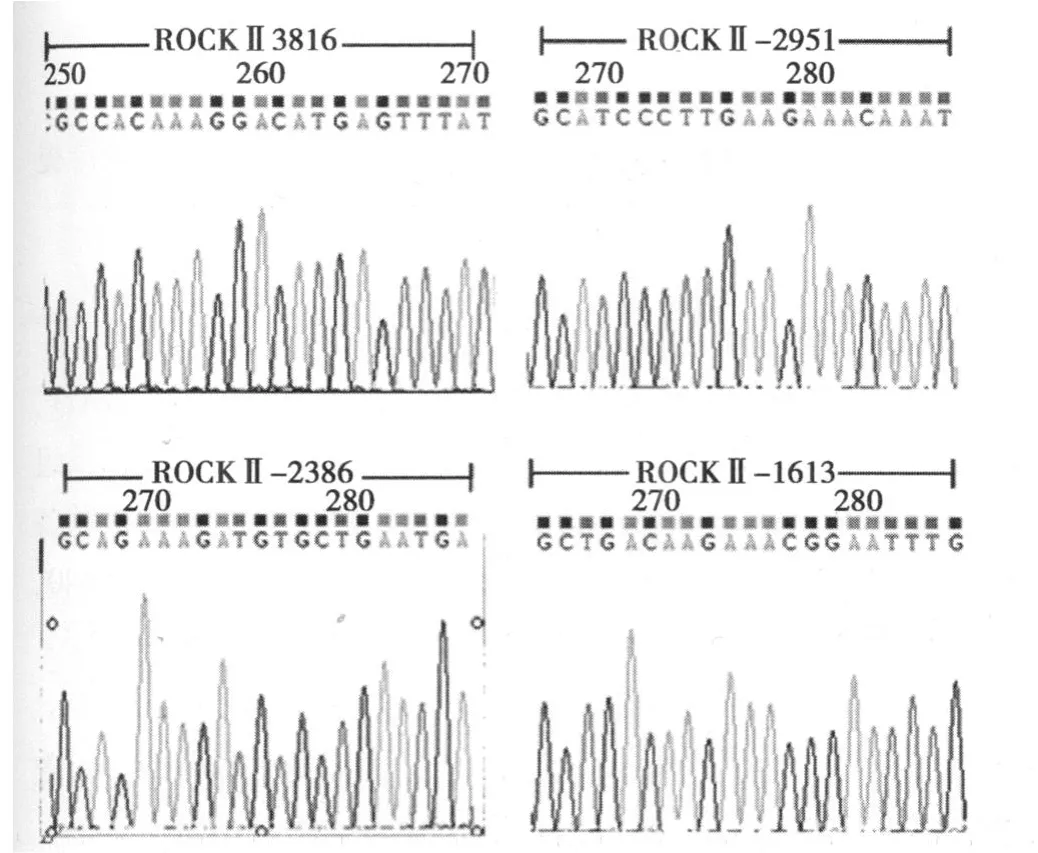
图2 克隆测序结果
3 讨 论
成年哺乳动物脊髓损伤后轴突难以再生的一个重要原因是在局部环境中存在一些可以抑制轴突再生的生长抑制因子,主要包括 3种来源于髓鞘的抑制蛋白:髓鞘相关糖蛋白(MAG)、Nogo、少突胶质细胞髓鞘糖蛋白 (OMGP)〔1〕。这些抑制因子有共同的信号传导通路,均可与 Nog的受体 NgR结合,在 P75的参与下激活其下游的 Rho-ROCK通路而引起生长锥塌陷,抑制轴突的再生。在信号转导过程中,ROCK是该通道的主要成分。ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员之一,以两种同源性极高的异构体存在:ROCK-Ⅱ和 ROCK-I,是目前研究最为清楚的 Rho下游效应分子。ROCKⅡ主要表达在脑内,而ROCK-I则主要表达在非神经组织如肺、肾和骨骼肌。脊髓损伤 ROCK被激活后能够使肌球蛋白磷酸酶磷酸化而失活,使得肌球蛋白磷酸化程度增高,从而影响肌动-球蛋白系统而导致轴突生长锥的塌陷,抑制轴突生长。因此,阻断 Rho-ROCK信号传导通路,即可达到轴突修复与再生的目的。
抑制基因表达的方法有很多,目前研究使用较多的主要有基因敲除、反义RNA技术、RNA i技术等,其中 RNA i是最近几年发现和发展起来的一门新兴的在转录水平上的基因阻断技术,是一种双链RNA分子在mRNA水平上关闭相应序列基因的表达或使其沉默的过程,也就是序列特异性的转录后基因沉默。与传统的基因治疗方法相比,RNA i技术有着无可比拟的优势〔2~5〕。首先,RNA i基因抑制效果确切,微量的 siRNA即可使其编码致病基因产物的含量下降 90%以上,这样可减少传统基因治疗方法大剂量用药带来的毒副作用及免疫效应。其次, RNA i抑制具有严格的序列特异性,将一段与基因同源的 siRNA注入细胞,可以特异地干扰相应基因的表达,而其他基因不会受到干扰,因此,RNA i治疗的针对性强,副作用小。RNA i已经成为研究基因功能的重要工具,并将在病毒性疾病、遗传性疾病、肿瘤和脊髓损伤的治疗方面发挥重要作用〔6〕。
脊髓损伤的 RNA i是在对脊髓损伤后基因表达及产物研究的基础上,通过选择恰当的基因转移途径,在转录后沉默目的基因的表达,阻断抑制因子的作用,进而促进脊髓损伤的修复,达到在分子水平治疗的目的〔7~10〕。选择 RNA i沉默 ROCK-Ⅱ的基因表达,人为阻断 Rho-ROCK传导通路,有效抑制靶基因表达,使其丧失活性,达到基因控制和基因治疗的目的。因此,本实验筛选出高沉默效率的 ROCK-Ⅱ特异性 siRNA,并构建其表达载体,为下一步通过 RNA i技术直接抑制脊髓损伤后ROCK-Ⅱ的表达做准备。
本研究所构建的 ROCK特异性 siRNA重组质粒 pGPU6/ GFP/Neo-shRNA,经酶切鉴定、基因测序,结果与设计序列完全相符,目的基因序列准确无误,重组质粒构建成功,为进一步研究体内外脊髓损伤的治疗奠定了实验基础。
1 BartonWA,Liu BP,TzvetkovaD,et a l.Structure and axon out-grow th inhibitor binding of the Nogo-66 recep tor and related p roteins〔J〕.EMBO J,2003;22:3291-302.
2 王延洲,梁志清,刘晓芳,等 .Sm ad3基因 RNA i慢病毒载体的构建与鉴定〔J〕.第三军医大学学报,2009;4(31):701-2.
3 康慧聪,唐洲平.RNA i及其基因治疗研究进展〔J〕.卒中与神经疾病,2005;12(3):191-3.
4 陈 煜,谢小芳.RNA i的作用机制及抗病毒研究进展〔J〕.世界华人消化杂志,2006;14(22):2123-9.
5 王 玮,朱痪章,薛京伦.RNA干涉在基因治疗中的应用〔J〕.生物化学与生物物理进展,2004;31(7):590-4.
6 W alm sley AR,M ir AK.Targeting the Nogo-A signaling pathw ay to p romo te recovery fo llow ing acute CNS in ju ry〔J〕.Curr Pharm Des(S1381-6128),2007;13(24):2470-84.
7 N ishio Y,KodaM,Kitajo K,et a l.Delayed treatmentw ith Rho-kinase inhibior dose not enhance axonal regeneration or functional recovery after sp inal cord in jury in rats〔J〕.Exp Neuro l(S0014-4086),2006;200:392-7.
8 Fu Q,Hue JS,L i SX.Nonsteroidal anti-inflamm atory d rugs p romote axon regeneration via RhoA inhibition〔J〕.JNeurosci(S0270-6474),2007;27 (15):4154-64.
9 Chen H,Firestein BL.RhoA regu lates dend rite b ranching in hippocampal neurons by decreasing cyp in p rotein levels〔J〕.J Neurosci(S0270-6474),2007;27(31):8378-86.
10 L ingor P,Teusch N,Schw arz K,et a l.Inhibition of Rho kinase(ROCK) increases neurite outgrow th on chond roitin su lphate p ro teoglycan in vitro and axonal regeneration in the zdu lt op tic nerve in vivo〔J〕.JNeurochem(S0022-3042),2007;103(1):181-9.
〔2009-11-05收稿 2009-12-30修回〕
(编辑 曲 莉)
book=30,ebook=29
Q782
A
1005-9202(2010)04-0502-03
杨有庚(1945-),男,教授,博士生导师,主要从事脊柱外科疾病的诊断与治疗。
李晓江(1977-),男,在读博士,主要从事脊柱外科疾病的诊断与治疗。
