EDTA差减滴定法测定钼精矿中的钼
2010-09-02刘海波郑玉霞
张 宁,刘海波,江 泓,郑玉霞
(厦门紫金矿冶技术有限公司,福建 厦门 361101)
EDTA差减滴定法测定钼精矿中的钼
张 宁,刘海波,江 泓,郑玉霞
(厦门紫金矿冶技术有限公司,福建 厦门 361101)
采用EDTA差减滴定法测定钼精矿中的钼。用盐酸羟胺作还原剂,将钼(Ⅵ)还原到钼(V),钼(V)与其他干扰元素一起与EDTA络合,过量的EDTA用锌盐反滴定。然后在另一份相同的试样中,不加盐酸羟胺还原,使干扰元素与EDTA络合,利用二者之差计算钼的含量。试验表明,该测定方法缩短了分析周期,具有准确性和重现性均好的优点。
钼;钼精矿;差减滴定法
0 前 言
目前,钼精矿中的钼大都采用重量法测定,如钼酸铅重量法[1~2],但是重量法步骤繁琐,分析时间长,不能快速配合选冶的研究。钼在盐酸羟胺存在下,与EDTA形成稳定配合物进行络合滴定,已应用于钨钼合金、钼铁合金中钼的测定[3~4],本文在此基础上做了改进,采用碱法熔样,消除Cu、Fe、Ni等干扰元素,用盐酸羟胺作还原剂,加入过量的EDTA与钼形成稳定配合物,用锌盐反滴定过量的EDTA,其他干扰元素的消除采用吸取2份平行溶液,1份用盐酸羟胺还原使钼和干扰元素一起与EDTA络合,另1份不还原,使干扰元素与EDTA络合,2份结果相减,差值即为钼的含量。采用对硝基酚为酸碱指示剂,二甲酚橙为螯合指示剂,终点清晰。本法能够准确、快速地测定钼精矿样品中的钼。
1 实验部分
1.1 主要试剂
15%盐酸羟胺溶液,0.1%对硝基酚,0.2%二甲酚橙,0.01 mol/L硫酸锌溶液,0.01 mol/L乙二胺四乙酸二钠(EDTA)标准溶液。
乙酸-乙酸钠缓冲溶液(pH 5.5):称取204 g无水乙酸钠与9.3 mL冰乙酸溶于水中,稀释至1 000 mL。
钼标准溶液:称取预先于500℃灼烧1 h并冷却至室温的三氧化钼1.500 3 g于250 mL烧杯中,加入氢氧化钠5 g,水50 mL,加热溶解后,移人1 L容量瓶中,以水稀释至刻度,摇匀,此溶液每毫升含钼1.00 mg。
1.2 分析方法
称取试样0.200 0~0.500 0 g于银坩埚中,加入3~5 g氢氧化钠覆盖,再加0.5 g左右的过氧化钠,然后放入已升温至680℃的高温炉中,熔融15 min,取出,冷却,将银坩埚置于250 mL烧杯,用热水提取,洗净坩埚,加几滴无水乙醇,加热煮沸数分钟,冷却至室温,移入100 mL容量瓶中,用水稀至标线,摇匀。
干过滤,移取滤液10.00~20.00 mL 2份于250 mL烧杯中,准确加入EDTA标准溶液25 mL,加水50 mL,滴加一滴对硝基酚指示剂,用1∶3的盐酸调成无色,并过量2滴,其中1份加10 mL 15%的盐酸羟胺溶液,另1份不加盐酸羟胺,盖上表面皿,同时加热煮沸10 min,用热水冲洗表面皿,加入20 mL乙酸-乙酸钠缓冲溶液,滴加3滴二甲酚橙指示剂,趁热用锌标准溶液滴定至溶液由黄色变为粉红色为终点,随同作样品空白。2份溶液的滴定数差值即为溶液中钼消耗的锌标准溶液的量。
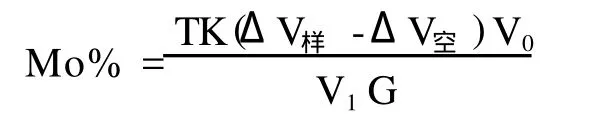
式中:T—EDTA标准溶液对钼的滴定度(g/mL);
V0—试液稀释总体积(mL);
ΔV样—不加盐酸羟胺还原和加入盐酸羟胺还原的2份样品溶液,滴定消耗锌标准溶液的差值(mL);
ΔV空—不加盐酸羟胺和加入盐酸羟胺还原的2份空白溶液,滴定消耗锌标准溶液的差值(mL);
V1—分取试液量(mL);
K—1 mL锌标准溶液相当于EDTA标准溶液的量(mL);
G—称取试样量(g);
2 结果与讨论
2.1 酸度的影响
盐酸羟胺还原钼在pH 3~4的溶液中进行[4],以二甲酚橙作指示剂的EDTA滴定法中,溶液的酸度值应控制在pH 5~6[5]。其酸度过高或过低会影响指示剂的显色。
2.2 盐酸羟胺的加入量对配合物的影响
在酸度pH 5.5,EDTA(0.01 mol/L)加入量为25 mL条件下,保持其他实验条件不变,进行了盐酸羟胺加入量条件实验,盐酸羟胺浓度为15%。结果见表1。

表1 盐酸羟胺加人量选择
由表1可以看出,随着盐酸羟胺用量的增加,测定值逐渐增大,用量为10~15 mL时,测定结果稳定,与标准值一致,所以选择盐酸羟胺用量为10 mL。
2.3 煮沸时间的选择
保持以上实验条件不变,进行煮沸时间条件实验,结果见表2。
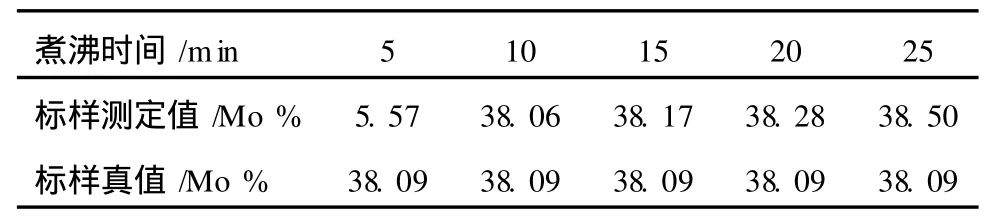
表2 煮沸时间的选择
由表2可以看出,测定结果随煮沸时间的延长而增大,其原因可能是煮沸时间过短,EDTA与钼尚未形成稳定的络合物,而时间过长络合物的稳定性降低,煮沸10~15 min时,结果与标准值的误差最小。实验选择煮沸时间为10~15 min。
2.4 指示剂的选择
曾用甲基橙作为酸碱指示剂调节钼还原时的酸度,滴定终点不易观察。本实验选用对硝基酚调节酸度,以减少酸碱指示剂底色对螯合滴定的终点干扰,实验表明终点清晰易判断。
2.5 钼的回收率
试液中含有5~25 mgMo6+时,分别进行实验,回收率在98.0%~102.6%,结果比较满意,见表3。
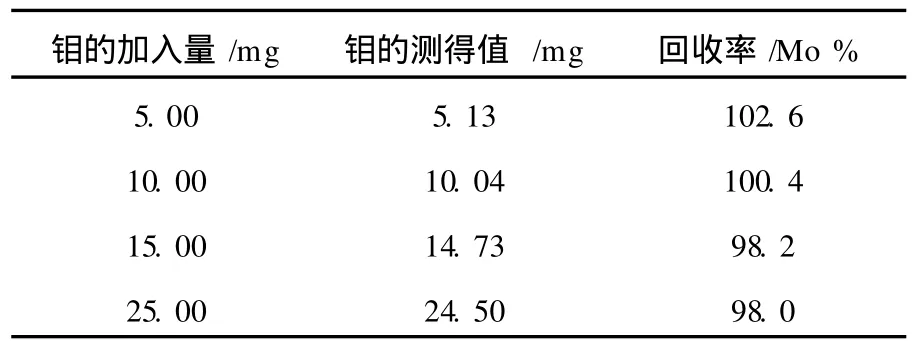
表3 钼的回收实验
2.6 方法对比
本方法对我公司矿冶研究院的选矿样品编号为0109、0110、0111的钼精矿样品进行重量法和本法的对比试验,结果见表4。
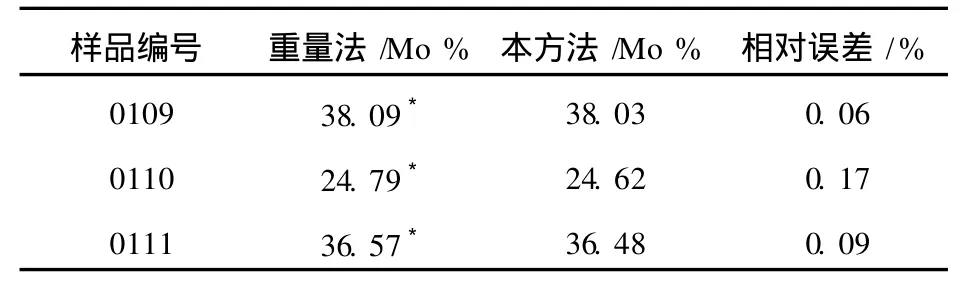
表4 本方法和重量法数据对比
2.7 精密度

表5 精密度实验
3 结 论
通过以上实验可以看出,用本方法提出的采用锌盐反滴定,平行差减消除干扰元素对滴定的影响,能够准确测定钼精矿的钼,此方法准确,方便、快捷,已成功应用于我公司钼矿湿法冶金项目。
[1] 北京矿冶研究总院分析室.矿石及有色金属分析手册[M].北京:冶金工业出版,1990.
[2] GB/T 15079.1-94.钼精矿化学分析方法-钼量的测定[S].
[3] 赖冬梅,李直,韦君.钼铁中钼的配位滴定法测定[J].四川有色金属,2003,4:36-38.
[4] 王艳红,张颖.铜钼矿中钼的滴定法测定[J].有色矿冶,2006,22(5):66-67.
[5] 王瑞斌,张成孝.EDTA差减滴定法测定汞污染土壤中汞[J].冶金分析,2007,27(12):54-56.
DETERM INATI ON OFMOLYBDENUM INMOLYBDENUM CONCENTRATES BY EDTA D IFFERENCE TITRATI ON
ZHANGNing,L IU Hai-bo,J IANG Hong,ZHENG Yu-xia
(Xiamen ZijinMining andMetallurgy Technology Co.,Ltd.,Xiamen 361101,Fujian,China)
A method for the deter mination ofmolybdenum in molybdenum concentrates by EDTA difference titration was proposed.Mo(Ⅵ)was reduced toMo(V)because of the hydroxylamine hydrochloride,Mo(V)and other ionswith EDTA could form complex compound.The surplus EDTA was titrated with zinc standard solution.While in another solution without hydroxylamine hydrochloride,Mo(Ⅵ)with EDTA could not form complex compound. The amount ofmolybdenum was calculated through the volume difference of zinc solution expended in titration of two solutions.The method was simple and convenient.It costs less time than grav imetric method.The analytical resultswere satisfactory.
molybdenum;molybdenum concentrates;difference titration
TQ207+.4
A
1006-2602(2010)04-0028-03
2010-04-06
张 宁(1980-),女,硕士,工程师,研究方向:矿物分析和纳米材料的制备。
