潜流人工湿地理化性质及不同形态氮素的空间分布
2010-08-29张涛宋新山
张涛,宋新山
东华大学环境科学与工程学院,上海 201620
在水体氮污染形势日趋严峻的背景下,人工湿地因其比传统的污水处理技术具有更高的脱氮效率、更低的运行维护成本、更好的生态属性成为人们关注的热点[1]。出于对建造成本、运行管理、异味控制等的考虑,目前国际上对潜流人工湿地有较多研究和应用。
潜流人工湿地去除进水中的氮主要依靠基质、微生物、植物根系之间的物理、化学和生物反应的协同作用[2-3]。较之植物和基质,微生物在潜流湿地脱氮过程中发挥着更重要的主导作用,如氨化、硝化、反硝化等过程均是以微生物为主体而发生的。许多研究表明,湿地中的主要去氮机理是微生物硝化、反硝化作用[4-7]。因此,溶解氧、氧化还原状况、温度、pH、碳源供给情况等能直接对微生物活性造成影响的因素也决定着湿地的整体脱氮效果。
目前,大部分研究主要集中在人工湿地对含氮废水的去除效率上[8-9],对于湿地系统的理化性质及其含氮污染物在整个床体中的空间变化的研究还不够全面。为此,本研究在长期监测试验的基础上结合MATLAB软件的插值模拟系统地分析了湿地床层内溶解氧、pH、氧化还原电位(ORP)、水温等理化性质和不同形态氮素的沿程及垂向变化,有利于直观揭示各出水指标的空间分布特征,从而为氮的强化去除提供必要的理论基础。
1 材料与方法
1.1 试验装置
潜流人工湿地尺寸为1.8 m×0.5 m×0.6 m,处理区填料由下至上依次为沸石、细砂,土壤,系统中栽种多年生草本植物芦苇。在湿地床的上层、中层、下层依次沿程设置 16处取样点,研究湿地各出水指标的沿程及垂向变化(图1)。

图1 潜流人工湿地沿程布设Fig.1 Structure of wetland and distribution of sampling spots
1.2 试验方法
试验进水采用人工模拟污水,以自来水配制,有机物(以CODCr计)、氨氮和磷酸盐分别采用葡萄糖、氯化铵和磷酸二氢钾模拟,具体水质条件见表1。

表1 潜流人工湿地进水水质Table 1 Inflow water quality of wetlands
人工湿地系统从2008年10月开始进自配污水,12月初开始出水水质稳定在较低水平,定期监测各项指标,直到2009年8月31日止。湿地运行采用间歇进水方式,水力学停留时间为1 d,每日进水总量55 L。
测定范围包括进出水的理化参数、N等水质指标。水温、溶氧(HI 9143溶解氧测定仪),pH(HI8424 NEW pH测定仪),ORP(德国WTW Multi 340i便携式电位测试仪),COD(快速消解紫外分光光度法),硝态氮、亚硝态氮(HJ/T84-2001离子色谱法),氨氮(ASTM D1426纳氏比色法),总氮(碱性过硫酸钾消解—紫外分光光度法),各种指标的测试方法均按国家环保局编制的《水和废水监测分析方法》进行[10]。
2 结果与讨论
2.1 潜流湿地系统水质理化参数
每次采集水样后,现场测定系统进出水的理化参数,包括溶解氧、pH、氧化还原电位以及水温等指标。将采样分析得到的数据编排好后,按照对应的坐标位置输入到MATLAB程序中,使用griddata和contour函数绘制湿地装置侧面的等值线图。
2.1.1 溶解氧分布
氧是硝化过程中的电子受体,湿地内溶解氧高低必将影响到硝化反应的进程。如图2所示,潜流人工湿地溶解氧空间变化规律在冬夏两季表现得基本一致,上部明显比下部高,这可能是因为湿地内部为多层基质覆盖,虽有表层水相的复氧作用和植物根系的泌氧作用,但是污水中的有机质和氨氮的氧化需要消耗大量的氧,所以下部溶解氧往往难以得到补充。整个湿地从上至下,夏季溶解氧的变化速率相对冬季变慢,这可能与夏季植物光合作用旺盛导致根系泌氧作用加强有关,旺盛的泌氧作用在一定程度上延缓了溶解氧的降低。
2.1.2 pH的空间变化
一般当pH<8.5时,氨氮的挥发可以忽略[11]。本试验中水力停留时间较短,植物对氮元素的摄取也应当较少,所以pH变化的主要原因是硝化与反硝化作用。文献指出,一般人工湿地的pH在7.2~8.0之间,比较有利于硝化过程的进行,反之,硝化过程将会受到抑制 。由图3可知,湿地下部pH较小,主要在6.9~7.2之间,这说明湿地下部是适宜于反硝化反应进行的,是厌氧微生物聚集的场所;同理,湿地上部则适合硝化过程进行。文献[13]指出:湿地下部pH的改变主要是因为在厌氧环境下有机质降解后形成的一些有机的酸性物质所造成的,同时,植物生产,死亡和分解也产生一定的天然酸度,pH因此下降。
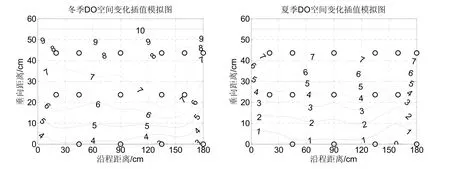
图2 潜流人工湿地冬季(12月)、夏季(6月)出水溶解氧(DO)空间变化Fig.2 The spatial distribution of dissolved oxygen in December and June in the SSFCW system
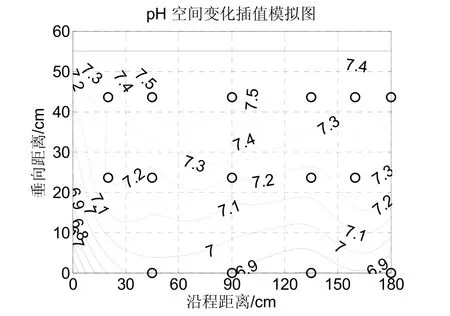
图3 潜流人工湿地出水pH空间变化Fig.3 The changes of pH in the SSFCW system
2.1.3 氧化还原电位分布
通过梳理改革开放以来各个历史阶段的党中央的意识形态方针,可以进一步把握中国共产党领导意识形态建设的基本逻辑和内在理路,为新时代背景下中国共产党深入推进意识形态工作、不断巩固意识形态阵地、进一步增强意识形态凝聚力和吸引力提供了丰富的实践经验。新时代背景下开展意识形态领导工作,要从思想引领、传播手段和阶级基础等多个维度齐抓并举。
从湿地稳定运行期的监测值(图4)可以直观看出,ORP数值上高下低,下部区域的ORP数值范围为50~100 mV,呈现出明显的还原性。此外,越往湿地后部延伸,这种特点越明显,显示还原性的区域越大。此外,还可以明显地发现湿地中部前端 ORP较高,而中部后部 ORP较低。综合分析认为,这一结果是溶解氧,有机质和含氮污染物(以有机氮和氨氮为主)三者氧化还原性的综合体现。

图4 湿地出水氧化还原电位(ORP)空间变化Fig.4 The distribution of ORP in the SSFCW system
2.1.4 水温空间变化
如图5所示,湿地装置内部下层温度总体比上层温度要高,这一点在湿地前端表现得尤其明显。除了湿地本身具有一定的保温作用外,湿地前端好氧菌的作用,使有机质和氨氮等污染物被氧化,同时释放出一定的热量,导致了湿地前端的温度较高。文献[14]认为,人工湿地对水温有缓冲作用。本文所进行的实验同样存在了该现象,即:当短期内气温升高时,系统内部温度低于外界温度;气温突然下降时,湿地系统对水流又有一定的升温作用。

图5 湿地春季3、4月出水温度空间变化Fig.5 The changes of temperature in SSFCW
2.1.5 碳源变化(COD)
碳源主要对反硝化过程产生影响,而系统中碳源的分布并不与反硝化作用活跃的区域同步,人工湿地对有机物的去除效果较好,反硝化过程中便可能造成碳源不足。从图6可知,湿地下部厌氧区域的出水 COD始终保持在较高水平,平均值在 100 mg·L-1左右,后端比前端高出10 mg·L-1。这是由于湿地下部没有充足的氧的供给,而湿地上部溶解氧较充足,因此相对应的 COD普遍较低,大致都在50~60 mg·L-1左右。另外,湿地前端上部有一个COD较低的区域,平均值在50 mg·L-1左右。该结果基本可以证明:湿地前端上部是 COD降解的主要场所。潜流人工湿地的化学需氧量(COD)沿程变化趋势和前述的溶解氧变化趋势具有一定的对应性。

图6 湿地出水化学需氧量(COD)空间变化Fig.6 The distribution of COD in SSFCW
2.2 湿地系统氮含量的空间变化
2.2.1 出水总氮的空间分布
潜流人工湿地沿程出水中,总氮的变化情况如图7所示。总氮主要是由氨氮、硝氮、亚硝氮和有机氮组成的。在本试验所运行的湿地系统中,氨氮和硝氮是主体;亚硝氮在湿地系统中不易积累;而有机氮主要是由植物根系分泌或者由腐枝落叶分解而产生的。
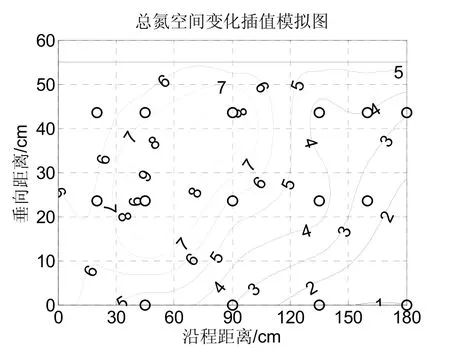
图7 湿地出水总氮(TN)空间分布Fig.7 The changes of TN in SSFCW
总氮浓度在湿地前端较高,而在湿地后端较低。水力学停留时间为1 d时,湿地前端的总氮,受入水中氨氮和硝氮总和的影响,一般情况下总氮浓度较高。在湿地中部,氨氮大部分被降解,硝氮成为主要形态,此时总氮会有一定程度的下降。在湿地后部,硝氮经反硝化作用被去除,表现为总氮浓度的进一步下降。如图中数据,总氮浓度在2.0~9.0 mg·L(以N计)范围内,各点的出水总氮去除率在55%~80%之间。
2.2.2 出水氨氮的空间变化
如图8所示,湿地沿程出水氨氮浓度上低下高,并在左下角浓度最高,随着湿地的水流方向而减少。在湿地上部表层的复氧区域,出水氨氮水平最低,平均在1.0 mg·L-1左右。在模拟图中的右半部分(包含出水口),出水氨氮浓度大致处于1.0~2.0 mg·L-1范围内。说明潜流人工湿地对脱除氨氮是很有效的,当进水氨氮浓度较低时(10.0 mg·L-1),去除率可达80%~90%,甚至更高。而在人工湿地的左下角,氨氮浓度高达4.0~6.0 mg·L-1,这主要是因为其处于湿地的最前端,水体死角,溶解氧缺乏,有限的溶解氧也被用来降解有机物,硝化过程难以进行,受植物和微生物的影响亦较小。

图8 湿地出水氨氮(NH4+-N)空间变化Fig.8 The changes of NH4+-N in SSFCW
2.2.3 出水硝态氮的空间分布
图9显示的是湿地内部硝氮(NO3--N,以N计)的沿程变化情况。在湿地下端,由于反硝化作用,出水的硝氮浓度小,范围约为0~3.0 mg·L-1;湿地上端浓度则相对较大,约4.0~7.0 mg·L-1。在该实验条件下,进水的C/N为3.33,对于反硝化来说,湿地下部的碳源还算是比较充足的,因此反应进行得比较充分,导致底部硝氮浓度低。而在湿地上部,COD含量相对较小,碳源缺乏,便导致出水硝氮浓度偏高。此外,结合氨氮的插值模拟结果,在湿地装置的左下角,硝氮的浓度很低而氨氮的浓度很高。
2.2.4 出水亚硝态氮的空间变化
湿地内部亚硝氮(NO2--N,以N计)的沿程变化情况如图 10所示,总体而言,亚硝氮在湿地内部的浓度很低,范围大致为 0~0.08 mg·L-1。此外可以明显发现:在湿地中下部亚硝氮的浓度相对较高,并且随湿地长度的增加而减小。一般来说,亚硝氮不易在自然生态系统中积累,其是由氨氧化菌在氧化氨氮的中间反应过程中产生的,所以,产生亚硝氮的量很少。

图9 湿地出水硝态氮(NO3--N)空间变化Fig.9 The spatial distribution of NO3—N in SSFCW

图10 湿地出水亚硝态氮(NO2--N)空间变化Fig.10 The spatial distribution of NO2--N in system
就本人工湿地系统而言,湿地中下部亚硝氮浓度高,而上部、后端的出水中,亚硝氮的浓度低,这很明显地是与湿地硝化-反硝化的过程对应的。因为污水中的氨氮降解的主要场所是湿地前端,所以在反应过程中产生的亚硝氮便积聚于此。其后,亚硝氮很快地被硝化细菌转化为硝氮(NO3--N),并在湿地后端的反硝化反应中进一步转化为 N2或者少量的N2O。
3 结论
(1)潜流人工湿地溶解氧空间分布规律在冬夏两季表现得基本一致,即湿地的上部高下部低。该趋势在冬季表现地更加明显,这可能与冬季微生物、植物的活性被抑制有关。人工湿地对水温有明显的缓冲作用,这种缓冲作用是湿地作为生态系统的一种生态功能,即维持系统温度稳定。
(2)湿地下部pH的改变主要是在厌氧环境下,有机质降解后形成的一些有机的酸性物质所造成的,同时,植物生产、死亡和分解也产生一定的天然酸度,pH值因此下降。因此,适当提高湿地床体的碱度对人工湿地脱氮具有积极意义。
(3)人工湿地ORP的变化是溶解氧、有机质、含氮污染物和微生物等相关因素综合性的体现,外在表现为上部氧化下部还原,前部氧化后部还原。湿地下部是适宜于反硝化反应进行的,是厌氧微生物聚集的场所;湿地上部则是适合硝化过程进行的。
(4)湿地前端上部是COD、氨氮降解的主要场所,在前端下部区域硝氮的浓度低而亚硝氮、氨氮的浓度相对较高。湿地系统中亚硝氮总体水平不高,仅在前段中下部有所积累。总氮浓度在湿地前端较高,而在湿地后端较低,其去除率在根本上依赖于反硝化作用的强度。
[1] 周琪. 人工湿地技术在污水处理及水环境保护中的应用与展望[J].给水排水, 2009, 35(7): 1-3.ZHOU Qi. Application and prospect of artificial wetland technology in wastewater treatment and aquatic environmental protection[J]. Water& Wastewater Engineering, 2009, 35(7): 1-3.
[2] 王世和, 王薇, 俞燕. 水力条件对人工湿地处理效果的影响[J]. 东南大学学报, 2003, 33(3): 359-362.WANG Shihe, WANG Wei, YU Yan. Influence of hydraulic condition on treatment effect of constructed wetland[J]. Journal of southeast university(natural science edition), 2003, 33(3): 359-362.
[3] Giraldi D, Vitturi M M, Zaramella M, et al. Hydrodynamics of vertical subsurface flow constructed wetlands: Tracer tests with rhodamine WT and numerical modeling[J]. Ecological Engineering, 2009, 35(2):265-273.
[4] Stottmeister U, Wießner A, Kuschk P, et al. Effects of plants and microorganisms in constructed wetlands for wastewater treatment[J].Biotechnology Advances, 2003, 22 (1-2): 93-117.
[5] 白军红, 欧阳华, 邓伟, 等. 湿地氮素传输过程研究进展[J]. 生态学报, 2005, 25 (2): 326-333.BAI Junhong, OUYANG Hua, DENG Wei, et al. A review on nitrogen transmission process in natural wetlands[J]. Acta Ecologica Sinica,2005, 25 (2): 326-333.
[6] 梁威, 吴振斌. 人工湿地对污水中氮磷的去除机制研究进展[J]. 环境科学动态, 2000, (3): 32-37.LIANG Wei, WU Zhenbin. Review of removal mechanism in constructed wetland treating nitrogen and phosphorus from wastewater[J].Environmental Science Trends, 2000, (3): 32-37.
[7] Green M, Friedler E, Safrai I. Enhancing nitrification in vertical flow constructed wetland utilizing a passive air pump [J] . Water Research,1998, 32 (12): 3513-3520.
[8] Steer D, Fraser L, Boddy J, et al. Efficiency of small constructed wetlands for subsurface treatment of singlefamily domestic effluent [J].Ecological Engineering, 2002, 18(4): 429-440.
[9] 宋志文, 王仁卿, 席俊秀, 等. 人工湿地对氮﹑磷的去除效率与动态特征[J]. 生态学杂志, 2005, 24(6): 648-651.SONG Zhiwen, WANG Renqing, XI Junxiu, et al. Nitrogen and phosphorous removal efficiency and dynamic feature of constructed wetlands for sewage treatment. Chinese Journal of Ecology, 2005, 24(6):648-651.
[10] 国家环保局. 水和废水监测分析方法[M]. (第4版). 北京: 中国环境科学出版社, 2002: 200-284.
[11] 尹连庆, 谷瑞华. 人工湿地去除氨氮机理及影响因素研究[J]. 环境工程, 2008, 26(S1): 151-155.YIN Lianqing, GU Ruihua. Ammonia nitrogen removal mechanism and affecting factors of constructed wetland[J]. Environmental Engineering, 2008, 26(S1): 151-155.
[12] 邓春光, 蔡明凯. 人工湿地脱氮性能优化分析及研究建议[J]. 节水灌溉, 2007, (4): 10-12.DENG Chunguang, CAI Mingkai. Optimization analysis of nitrogen removal performance of artificial wetland and research suggestions[J].Water Saving Irrigation, 2007, (4): 10-12.
[13] 王世和. 人工湿地污水处理理论与技术[M]. 科学出版社,2007:1-180.
[14] 付融冰, 朱宜平, 杨海真, 等. 连续流湿地中DO、ORP状况及与植物根系分布的关系[J]. 环境科学学报, 2008, 28(10): 2036-2041.FU Rongbing, ZHU Yiping, YANG Haizhen, et al. DO and ORP conditions and their correlation with plant root distribution in a continuous-flow constructed wetland treating eutrophic water[J]. Acta Scientiae Circumstantiae, 2008, 28(10): 2036-2041.
