阳离子树脂填充EVAL中空纤维膜吸附剂对牛血清/牛血红蛋白质混合物的分离性能
2010-08-28校迎军张玉忠
校迎军,张玉忠,李 泓
(天津工业大学 中空纤维膜材料与膜过程教育部重点实验室,天津 300160)
阳离子树脂填充EVAL中空纤维膜吸附剂对牛血清/牛血红蛋白质混合物的分离性能
校迎军,张玉忠,李 泓
(天津工业大学 中空纤维膜材料与膜过程教育部重点实验室,天津 300160)
以亲水性乙烯-乙烯醇共聚物(EVAL)为膜吸附剂基质材料,阳离子树脂D061为功能树脂,采用相转换法制备树脂填充EVAL中空纤维膜吸附剂.采用连续循环膜吸附工艺研究了这种膜吸附剂对蛋白质混合物的吸附性能.结果表明:D061树脂填充EVAL中空纤维膜吸附剂对牛血清蛋白(BSA)、牛血红蛋白(Hb)均具有较好的吸附性能,且随着树脂填充量的增加膜吸附剂对蛋白质的吸附容量增加,当树脂填充量为65%时,膜吸附剂对BSA的最大吸附容量达到69.26 mg/g,Hb的最大吸附容量达到45.29 mg/g;pH值对蛋白质的吸附性能影响很大,pH=7.0时,分离系数在3.8左右,能够将BSA、Hb蛋白质混合物进行有效分离.
膜吸附剂;吸附;中空纤维膜;EVAL;蛋白质分离
膜分离技术在生物产品的纯化分离方面起着关键的作用,它的应用包括蛋白质的生产和纯化、蛋白质-病毒的分离等[1].现有工业对蛋白质进行膜分离一般是利用膜的孔径大小和蛋白质分子质量的差异进行,存在分离产物纯度相对较低、膜在使用过程中易被污染等缺点.大规模制备蛋白质的分离纯化技术已成为生物技术发展的一个瓶颈[2].膜色谱技术结合了膜过滤和固定床吸附的双重作用,把树脂的高选择性和膜过滤技术的高效性相结合,完成对特定蛋白质的吸附,从而达到对蛋白质分离纯化的目的[3-4].膜色谱技术在分离纯化蛋白质方面有很多优点:可测定性强、处理量大、适用性强、通量高、能耗低以及环境依赖性小等[5].研究人员已在这一领域做了一些研究[6-11].由于蛋白质BSA和Hb的分子质量相近,用传统的膜分离方法很难将其分开.本课题利用在不同pH值时蛋白质电性不同的特点,通过在亲水性膜材料中加入具有电荷定向吸附功能的离子交换树脂,采用合适的工艺,对其中一种蛋白质进行吸附,而另一种蛋白质则透过膜,然后再将被吸附的蛋白质从膜吸附剂上洗脱下来,从而达到将2种分子质量接近的蛋白质分离的目的.为此,前期实验制备了亲水性阳离子树脂填充EVAL中空纤维膜吸附剂组件,采用连续循环膜过滤工艺对单种目标蛋白质进行了吸附及脱附性能表征,以确定较佳的操作条件.本文是在前期实验的基础上,进一步对BSA/Hb蛋白质混合物进行吸附性能表征,以期实现目标蛋白质混合物的分离.
1 实验部分
1.1 原材料及仪器
实验所用原材料包括:基质材料为乙烯—乙烯醇共聚物(EVAL),乙烯基质量分数为44%,日本可乐丽公司产品;功能树脂为D061强酸性阳离子交换树脂,天津市南开大学化工厂产品;溶剂为二甲基亚砜(DMSO),天津市赢达稀贵化学试剂厂产品;添加剂为正辛醇(CP),天津市科密欧化学试剂厂产品;模型蛋白为牛血清白蛋白(BSA)和牛血红蛋白(Hb),天津联星生物技术有限公司产品.
实验所用仪器包括:HMB-701型超微粉碎机,北京环亚天元机械技术公司产品;HORIBA LA-300粒度分布仪,日本掘场公司产品;QUANTA200型扫描电子显微镜,荷兰FEI公司产品;UV2450型紫外可见分光光度计,日本岛津公司产品;pH标准缓冲溶液均采用pH标准缓冲物质配制.
1.2 中空纤维膜吸附剂的制备
1.2.1 微米级阳离子交换树脂的制备
初出厂的树脂含水量较高、颗粒较大且含有杂质,不适合直接纺丝.对初出厂的阳离子交换树脂进行水洗、焙烘和粉碎(粉碎在HMB-701型超微粉碎机中进行),以增大树脂的比表面积,保证树脂在纤维膜中均匀分散,并采用HORIBA LA-300型粒度分布仪测定粉碎之后树脂样品的粒度分布,结果如图1所示.
由图1可以看出,粉碎后的树脂粒径约18 μm,颗粒分布较为均匀.

1.2.2 树脂填充EVAL中空纤维膜吸附剂的制备
在搅拌速度300 r/min、加热温度为60℃作用下,将质量分数分别为15%的EVAL颗粒和9%的正辛醇溶解在DMSO溶剂中;待EVAL完全溶解后加入一定量的D061树脂,制成均匀稳定的铸膜液,倒入纺丝罐中静置并加热(加热温度为50℃)脱泡以备纺丝.
纺丝时,在氮气压力下,纺丝液细流从插入管式喷丝头的环隙挤出,同时中心孔通入与凝固浴相同的芯液,用于调控纤维的内表面结构.挤出的纺丝液细流经10 cm左右的空气浴后,进入凝固浴进行相分离.所制备的阳离子D061树脂填充EVAL中空纤维膜丝经水洗、醇洗后,在30%油溶液中浸泡24 h后晾干,保存备用.纺丝工艺条件为:纺丝液温度60℃;纺丝液压力0.15 MPa;凝固浴温度40℃;芯液温度30℃;芯液流量20 mL/min;室温25℃,室内相对湿度40%.
1.3 中空纤维膜吸附剂的表征
1.3.1 中空纤维膜吸附剂的形态结构
采用QUANTA200型扫描电子显微镜观察膜丝的形态结构.观测膜丝的断面结构时须将湿态纤维在液氮中进行脆断,以确保膜丝的结构保持完好.
1.3.2 对蛋白质的吸附性能
树脂填充EVAL中空纤维膜吸附剂的吸附性能采用连续膜过滤工艺确定,实验装置如图2所示.
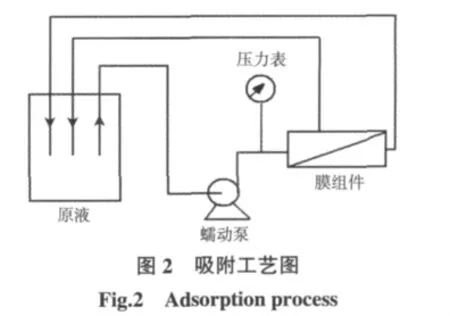
蛋白质混合液经过蠕动泵加压(实验压力为0.03MPa)之后进入阳离子树脂填充EVAL中空纤维膜吸附剂组件,控制蛋白质渗透通量约为100 L/(m2·h),经膜吸附剂吸附之后的蛋白质滤过液回到原液池中.已知量的中空纤维膜吸附剂通过对目标蛋白溶液进行连续循环过滤直至蛋白质吸附平衡,通过原液池中蛋白质浓度的变化计算树脂填充EVAL中空纤维膜吸附剂对蛋白质的吸附容量.实验配制了质量浓度为1.5 mg/mL的蛋白质混合液,其中BSA、Hb的浓度比为2∶1.蛋白质浓度的测定采用UV2450型紫外可见分光光度计进行,蛋白质BSA的浓度在278 nm波长下测定,Hb的浓度在406 nm波长下测定.阳离子树脂填充EVAL中空纤维膜吸附剂的蛋白质吸附容量为:
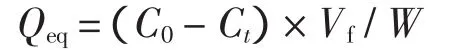
式中:Qeq为蛋白质的吸附容量(mg/g);C0为原液池中蛋白质的起始质量浓度(mg/mL);Ct为料液蛋白质在时间t的质量浓度(mg/mL);Vf为料液的体积(mL);W为干膜的质量(g).
1.3.3 对BSA和Hb混合物的分离效率
蛋白质的分离效率可通过分离系数来体现:
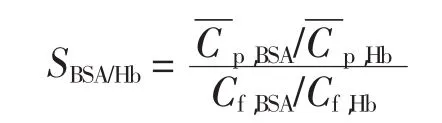
式中:SBSA/Hb为分离系数;Cf,BSA和Cf,Hb分别为BSA和Hb的起始质量浓度(mg/mL);和分别为BSA和Hb吸附平衡之后的质量浓度(mg/mL).
2 结果与讨论
2.1 中空纤维膜吸附剂的形态结构
为了研究膜吸附剂对蛋白质的吸附性能,实验制备了表面开孔且基膜为多孔结构的D061树脂填充EVAL中空纤维膜吸附剂.将树脂填充EVAL膜吸附剂结构与纯的EVAL膜做比较,结果如图3所示.

由图3可见,添加了D061树脂的膜吸附剂内部孔腔率明显提高,为蛋白质分子的自由扩散提供了传输通道,有利于蛋白质顺利的穿过膜而不被膜吸附剂截留,从而达到被树脂吸附的目的;而未添加树脂的纯EVAL中空纤维基膜结构致密,孔分布更为均匀.
2.2 对蛋白质的吸附性能
不同pH值、不同树脂含量时膜吸附剂对蛋白质混合液的吸附性能如表1所示.
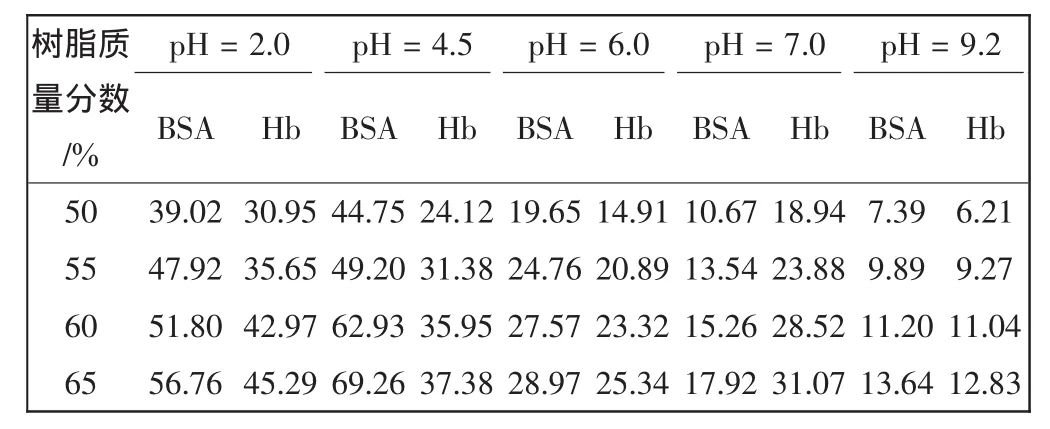
表1 D061树脂填充中空纤维膜吸附剂对BSA和Hb吸附性能Tab.1 Adsorption properties of resin filled EVAL hollowfiber membrane adsorbents for BSA and Hb mg/g
从表1中数据可以看出,随着树脂含量的增加,膜吸附剂对蛋白质BSA和Hb的吸附容量均有所增加.这是由于随着树脂含量的增加,能够与蛋白质结合的吸附点增多,从而吸附容量有所增加.在缓冲溶液pH值为2.0时,膜吸附剂对BSA和Hb的吸附容量都较大,因此在此条件下很难把二者分离;pH值为7.0时膜吸附剂对Hb的吸附容量相对较大,而对BSA的吸附容量较小,因此有望在pH值为7.0时对BSA、Hb混合蛋白质进行有效的分离.具体分离条件将根据分离效率做进一步研究.
2.3 膜吸附剂对蛋白质的吸附动力学
树脂填充质量分数为65%、pH=4.5时,阳离子树脂填充EVAL中空纤维膜吸附剂对蛋白质的吸附量与时间的关系如图4所示,这种关系可以用来描述蛋白质的吸附动力学.
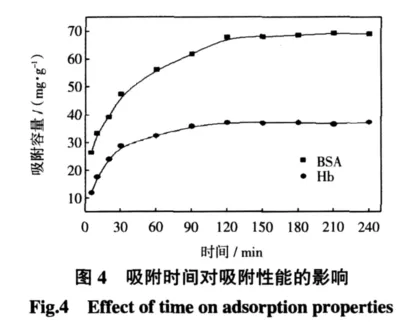
由图4可见,初始阶段吸附量随吸附时间而增加,之后随着时间的延长,吸附逐渐趋于饱和.实验进行到120 min左右时,膜吸附剂对蛋白质混合物的吸附性能达到动力学平衡.BSA的最大吸附容量为69.26 mg/g,Hb的最大吸附容量为37.38 mg/g.这是由于在实验初始阶段,膜吸附剂对蛋白质的吸附主要发生在树脂表面及膜基体内,这个阶段蛋白质从膜机体内逐渐向树脂表面扩散,因此初始阶段膜吸附剂对蛋白质的吸附量随时间增加很快;而中后期蛋白质从树脂表面扩散到树脂内部的吸附点是控制步骤,因而吸附量增加缓慢并且最终达到吸附动力学平衡.
2.4 缓冲溶液pH值对膜吸附剂吸附容量的影响
缓冲溶液的pH值是影响蛋白质吸附性能的一个重要因素,它决定了蛋白质混合物能否被有效的分离.在树脂质量分数为65%、吸附时间为3 h的条件下,缓冲溶液pH值对膜吸附剂吸附性能的影响如图5所示.
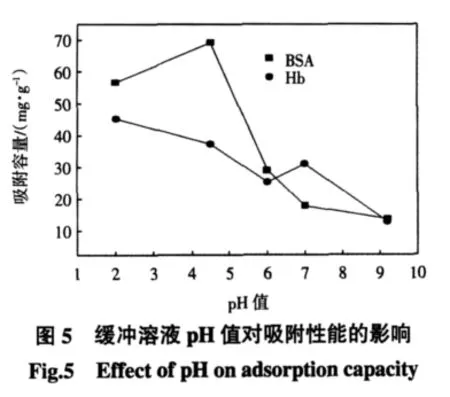
由图5可见,在蛋白质BSA等电点(4.8~5.2)附近,膜吸附剂对BSA的吸附容量较高.有报道称BSA的等电点为4.5~5.2,蛋白质在等电点时不带电,通常在等电点时能观察到最大吸附容量[12].从图5也可以看出,pH=4.5时,膜吸附剂对BSA的吸附容量最大.这是由于蛋白质分子由氨基酸组成,是两性电解质,随着pH值的变化,蛋白质所带的电性、结构发生相应变化.当缓冲溶液pH值低于BSA等电点时,BSA带正电荷,而阳离子交换树脂本身带负电荷,通过静电吸引作用对带正电荷的蛋白质进行吸附.而在BSA等电点附近,氨基和羧基所带电荷总量相等,BSA净电荷为零,此时BSA不带电,分子间作用力很弱,疏水性和氢键作用更加明显,BSA与膜吸附剂作用力增加,膜吸附剂对BSA的吸附量增大.当缓冲溶液pH值高于BSA等电点时,BSA带负电荷,pH值越高,BSA电负性越强,与带负电荷的阳离子交换树脂形成很强的同种电荷相斥现象,吸附性能越来越差.
缓冲溶液pH值低于BSA等电点时,树脂填充EVAL中空纤维膜吸附剂对BSA的吸附容量低于等电点附近的吸附容量.这可能是由于BSA是两性高分子,溶液的pH值对其静电荷数和立体结构有较大影响,随着溶液酸性的增强,BSA分子尺寸变小[13-14],可能导致吸附能力减弱.
由图5还可看出,pH=2.0时,膜吸附剂对蛋白质Hb的吸附容量出现最大值.随着缓冲溶液pH值的增加,阳离子树脂填充膜吸附剂对蛋白质Hb的吸附容量总体趋势是降低的.pH值越大,蛋白质的吸附容量越小.这是由于缓冲溶液pH值为2.0时,远离蛋白质Hb等电点(6.8~7.0),蛋白质Hb显正电荷,很容易被阳离子树脂填充膜吸附剂吸附,从而蛋白质吸附容量较大.随着pH值的继续增大,H+浓度降低,能够与离子交换树脂结合的吸附点有所减少,膜吸附剂的吸附容量有所减少.当缓冲溶液pH值为7.0时,位于Hb的等电点附近,吸附情况较为复杂.此时Hb的净电荷为零,蛋白质不带电,蛋白质与膜吸附剂之间的分子间作用力减弱,疏水性和氢键作用变得突出,蛋白质被紧紧地包裹在树脂的表面.与pH=6.0时的吸附情况相比较,D061阳离子树脂填充EVAL膜吸附剂对蛋白质Hb的吸附容量反而有所增加.当缓冲溶液的pH值高于Hb的等电点时,蛋白质呈负电,与阳离子交换树脂发生同种电荷相斥现象,蛋白质的吸附容量明显降低.
2.5 膜吸附剂对混合蛋白BSA/Hb的分离效率
不同pH值时蛋白质所带的电荷不同,进而膜吸附剂对蛋白质的吸附性能有所不同.利用D061树脂填充膜吸附剂对于2种蛋白质吸附性能的差异,可以将2种分子质量相近的蛋白质进行有效的分离.为此,实验研究了吸附时间为3 h时D061阳离子树脂填充EVAL膜吸附剂对混合蛋白BSA、Hb的分离效率,结果如图6所示.
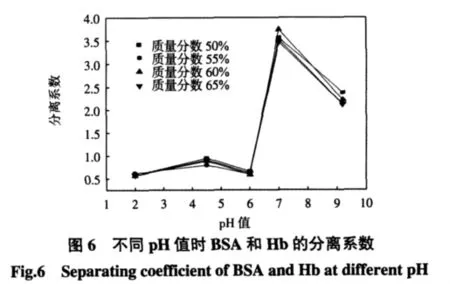
从图6中可以看出缓冲溶液的pH值为7.0时分离系数较大,说明膜吸附剂在pH值为7.0时可以有效地将蛋白质混合物进行分离.
由表1数据可知,在pH值为2.0和4.5时,D061阳离子树脂填充EVAL膜吸附剂对2种蛋白质吸附容量较高,但是由于2种蛋白质都被膜吸附剂大量吸附,反而很难将其分离.从图6也能看出,pH值为2.0和4.5时的分离效率并不高.pH为9.2时,平均分离系数在2.3左右,此时D061阳离子树脂填充EVAL膜吸附剂对BSA、Hb蛋白质混合液的分离效率相对较好,但此条件下膜吸附剂对蛋白质的吸附容量很低,也不能对蛋白质混合物进行有效分离.
pH=7.0位于蛋白质Hb的等电点,从表1中可以看出,此时膜吸附剂对蛋白质Hb的吸附容量有所增加,而蛋白质BSA的等电点在4.8~5.2附近,pH=7.0时,BSA此时带负电荷,D061阳离子树脂填充EVAL膜吸附剂本身带负电荷,由于静电相斥作用,膜吸附剂对蛋白质BSA的吸附容量很小,因而分离效率较高.因此,选择缓冲溶液的pH值为7.0时,分离系数在3.8左右,有望将BSA、Hb蛋白质混合物进行有效的分离.与Saiful[8]、Avramescu M E[11]等制备的Lewatit型离子交换树脂填充膜吸附剂相比较,本实验制备的D061阳离子树脂填充EVAL膜吸附剂对蛋白质混合物的分离系数有所降低,这主要是由于 Saiful、Avramescu M E等[8,11]采用多级膜组件串联吸附工艺,有效吸附点增加,而本实验仅仅研究了一支膜组件的吸附行为.另外实验条件和所选用离子交换树脂的不同也可能引起吸附性能的差异.
3 结论
(1)随着EVAL基膜中树脂填充量的增加,蛋白质的吸附容量增大,并且在2 h左右达到动力学吸附平衡.当树脂填充质量分数为65%时,BSA在缓冲溶液pH=4.5时达到最大吸附容量69.26 mg/g,Hb在缓冲溶液pH=2.0达到最大吸附容量45.29 mg/g.
(2)pH值对吸附容量影响很大,蛋白质BSA的最大吸附容量在其等电点附近达到最大,而蛋白质Hb的最大吸附容量在pH=2.0时达到最大.
(3)pH=7.0时,膜吸附剂对BSA的吸附容量很小,而对Hb的吸附容量较大,分离系数为3.8左右.因此,选择缓冲溶液pH值为7.0时,有望将BSA、Hb的蛋白质混合物进行有效地分离.
[1]SAXENA A,TRIPATHI B P,KUMAR M,et al.Membranebased techniques for the separation and purification of proteins:an overview[J].Advances in Colloid and Interface Science,2009,145:1-22.
[2]蒋福龙.生物技术产品分离纯化技木研究进展[J].化工纵横,2000,12:13-16.
[3] KLEIN E.Affinity membranes:a 10-year review[J].Journal of Membrane Science,2000,179:1-27.
[4]ROPER D K,LIGHTFOOT E N.Separation of biomolecules using adsorptive membranes[J].Chromatogr J,1995,A 702(1/ 2):3-26.
[5]VICENTE T,SOUSA M F Q,PEIXOTO C,et al.Anion-exchange membrane chromatography for purification of rotaviruslike particles[J].Journal of Membrane Science,2008,311:270-283.
[6]AVRAMESCU M E,BORNEMAN Z,WESSLING M.Particle-loaded hollow-fiber membrane adsorbers for lysozyme separation[J].Journal of Membrane Science,2008,322:306-313.
[7]SAXENA A,KUMAR M,TRIPATHI B P,et al.Organic-inorganic hybrid charged membranes for proteins separation:isoelectric separation of proteins under coupled driving forces[J]. Separation and Purification Technology,2010,70:280-290.
[8] SAIFUL E.Mixed matrix membrane adsorbers for protein and bloodpurification[D].Enschede:UniversityofTwente,2007.
[9]AVRAMESCU M E,GIRONÈSM,BORNEMAN Z,et al. Preparation of mixed matrix adsorber membranes for protein recovery[J].Journal of Membrane Science,2003,218:219-233.
[10]AVRAMESCU M E,SAGER W F C,MULDER M H V,et al. Preparation of ethylene-vinyl alcohol copolymer membranes suitable for ligand coupling in affinity separation[J].Journal of Membrane Science,2002,210:155-173.
[11]AVRAMESCU M E,GIRONÈS M,BORNEMAN Z,et al. Mixed-matrix membrane adsorbents for protein separation[J]. Journal of Chromatography A,2003,1006:171-183.
[12]ETHEVE J,DEJARDIN P,BOISSIERE M.Influence of pH on the adsorption of lysozyme on a sulfonated membrane with and without poly(ethyleneimine)[J].Desalination,2002,146(1/2/3):111-113.
[13]陈卫东,董晓燕,孙 彦.阴离子交换剂DEAE—Spherodex M的蛋白质吸附性能[J].化学工程,2004,32(6):57-61.
[14]陈卫东,孙 彦.蛋白质离子交换的空间质量作用模型分析[J].化工学报,2002,53(1):88-91.
Separation of BSA/Hb protein mixture by cation resin filled EVAL hollow-fiber membrane adsorbents
XIAO Ying-jun,ZHANG Yu-zhong,LI Hong
(Key Laboratory of Hollow Fiber Membrane Materials and Membrane Process of Ministry of Education,Tianjin Polytechnic University,Tianjin 300160,China)
Using ethylene-vinyl alcohol copolymer(EVAL)as membrane matrix material,cation resin D061 as functional particles,resin filled EVAL hollow-fiber membrane adsorbents are prepared by phase inversion method.The adsorption capacities of the membrane adsorbents for protein mixture are studied by continuous cycle adsorption process.The results show that EVAL hollow-fiber membrane adsorbents filled with cation exchange resins D061 have good adsorption capacity to protein BSA and Hb.The adsorption capacity is enhanced with the increase of resin content in the membrane adsorbents.The maximum adsorption capacity of membrane adsorbents is 69.26 mg/g(BSA)and 45.29 mg/g(Hb)when D061 resin loading content is 65%. The pH value of buffer solution has significant influence on protein adsorption performance.The mixture of BSA and Hb can be effectively separated with the separation factor 3.8 at pH=7.0.
membrane adsorbents;adsorption;hollow-fiber membrane;EVAL;protein separation
book=4,ebook=129
TS102.528.1
A
1671-024X(2010)04-0005-05
2010-01-11
国家自然科学基金(50473025;50973083;20874073);天津市应用基础重点项目(04380391I);重质油国家重点实验室开放课题;高等学校博士学科点专项科研基金资助项目(20091201120002)
校迎军(1980—),女,硕士研究生.
张玉忠(1963—),男,研究员,博士生导师.E-mail:zhangyz2004cn@163.com
