阿托伐他汀对脑缺血大鼠认知功能的影响
2010-08-25刘福中龙建庭朱云龙
刘福中, 龙建庭, 朱云龙, 游 咏
随着人口老年化,血管性痴呆(Vascular Dementia,VD)的发病率日益增高。据 WHO统计,在欧美等发达国家,血管性痴呆占全部痴呆的 10%~20%,而我国的一些研究资料显示,血管性痴呆约占全部痴呆的 60%左右,这可能与资料的人口构成、诊断方法和剔除标准的不同有关,但在一定程度上提示血管性痴呆是我国老年性痴呆的主要组成部分,也是目前老年期痴呆中可预防和有希望治疗的痴呆之一。他汀类药物是作为降脂药物被研发的,但在临床实践中发现它们还有许多降脂以外的作用,如拮抗动脉粥样硬化、预防心脑血管事件、痴呆和骨质疏松等[1]。大规模的临床研究表明,使用他汀对预防血管性痴呆和改善认知功能有益[2,3],其具体机制不祥。本研究通过观察阿托伐他汀对 SD大鼠学习记忆能力及其对海马超微结构的影响,以探讨阿托伐他汀对血管性性痴呆大鼠的保护作用机制。
1 材料和方法
1.1 实验动物 实验动物选用雄性 SD大鼠30只,鼠龄 3~ 4月,体重(252.6±24.5)g,均由南华大学动物部提供,许可证号为 SCXK(湘)2005-0010。全部大鼠在正常温控、自然光照及自由摄食条件下饲养。30只大鼠随机分为 3组:假手术组(10只 ),模型组 (10只),治疗组(10只 )。
1.2 模型制作及给药方法 采用双侧颈总动脉永久结扎法[4]:用 6%的水合氯醛(5ml/kg)麻醉大鼠;成功后仰卧固定在手术台上,常规消毒,颈正中切口,分离双侧颈总动脉,4号丝线双重结扎;术中大鼠体温保持在 36.5℃;缝合切口,放回笼中饲养。术后加强护理,可以有效避免大鼠死亡。假手术组大鼠只分离不结扎颈总动脉,其余操作过程同模型组。模型建立后1w开始,治疗组给予阿托伐他汀 5mg·kg-1·d-1(1ml)药物。由辉瑞公司生产,规格为:20mg/片(立普妥,lipitor,生产批号:75837005)灌胃,假手术组及模型组予以 1ml生理盐水灌胃 4w。
1.3 行为学检测方法 灌胃 4w后,采用水迷宫试验分别检测 3组大鼠学习和记忆能力。Morris水迷宫包括一个盛水的圆形不锈钢水池、隐藏在水面下的平台以及带有一套图像自动采集和处理的计算机系统。水池直径 150cm,池深 60cm。水池按方位平均分为 4个假想的象限。将其中一个象限设置为目标象限(target quadrant),即第 4象限。第四象限中间放置一个大小为 10×10cm2、高 29cm平台,平台没于水面下 1.5cm。水面布满黑色浮动的树脂珠以隐蔽平台。池四周的黄色幕壁上有视觉标志(矩形、三角形、圆形及菱形)等距离分布作为远端线索,供游泳时的SD大鼠用来定位平台。在整个实验期间平台、水池及周围环境保持不变。训练时水温保持在(25℃±1℃)左右,室内温度保持在 20℃~25℃。迷宫上方安置带有显示系统的摄像机(Cap7130Capture视频组合),摄像头对准桶中心,与之相连的计算机系统同步记录小鼠运动轨迹,采集并分析 Morris水迷宫数据和图像结果。灌胃 4w后,通过定位航行实验检测动物的学习能力,24h后用空间探索实验检测动物的记忆能力,每天上午、下午各训练 1次,每次记录 120s,连续 5d,计算各组 2次训练时间的平均值。大鼠在水迷宫中找到平台的时间越短,游过的距离越短,表明动物学习记忆能力越强。
1.4 标本选择与保存 行为学检测后,每组随机选取 5只大鼠电镜检查,剩余的 5只进行 HE染色。大鼠麻醉成功后,以生理盐水及 4%多聚甲醛快速灌注,在冰台上,迅速离断脑组织,按照海马分区图谱,取小鼠左侧海马 CA1区(平外侧膝状体水平)1×2×2mm3左右大小海马(及左额叶组织块)组织块 2~3块,放入 2.5%戊二醛磷酸缓冲液中冲洗后,保存在戊二醛溶液中,HE染色大鼠脑组织放在 4%多聚甲醛中保存备用。
1.5 电镜标本的体视学分析 采用日立 H-7500透射电子显微镜,在 40,000倍数下,选择神经毡部位,双盲情况下每组随机拍照 40张。按 Gundersen法则[5]计数每张相片中 Gray1型突触的数目;采用德国 Soft Imaging System GmbH图像分析软件测量 Gray1型突触截面积及周长,采用魔棒自动测量突触小泡的总面积。体视学方法为:δ=4/π×Bx/Ax;Na=Nx/Ar;Vv=Ax/Ar(δ为比表面;Bx为粒子周长;Ax为粒子截面积;π取 3.14;Ar为参照系截面积,Nx为参照系中颗粒截面数目)。
1.6 统计学处理 所有数据采用 SPSS13.0软件进行分析。计量资料以均数 ±标准差±s)表示,采用单因素方差分析进行比较,两两之间比较采用 LSD法。P<0.05认为差异有统计学意义。
2 结 果
2.1 Morris水迷宫实验 治疗组与模型组相比较,逃避潜伏期缩短,游泳时间百分比增高,穿过平台次数增多,表明学习和记忆成绩均显著升高(P<0.05)。模型组与假手术组相比较,学习和记忆成绩均显著降低(P<0.05),表明模型建立成功(见表1)。
2.2 大鼠海马区 HE染色结果 假手术组海马神经细胞细胞膜及核仁明显,细胞排列整齐紧密,染色均一(见图 1A)。模型组海马神经细胞数量明显减少,细胞排列稀疏,细胞核深染、固缩,大量胶质细胞增生,细胞退行性变明显,可见空泡样改变,组织间水肿较明显(见图 1B)。治疗组海马神经细胞排列较模型组整齐,细胞呈圆形或椭圆形,核仁清晰,细胞脱失较少见,反应性胶质细胞减少,水肿较轻(见图 1C)。
2.3 大鼠海马区超微结构结果 假手术组大鼠海马组织神经元双层核膜结构清晰,核膜平行,细胞质内细胞器结构清楚,未见明显肿胀及组织空泡样变性,高尔基体结构清楚,分布规律(图 2A);模型组大鼠海马组织中存在较大面积水肿,可见部分空泡样变性;突触数量较少,部分突触中可见水肿,突触中的突触小泡数量明显较少甚至基本消失,突触间隙不清,突触后膜厚度薄,突触界面曲度不大(图2B);治疗组大鼠海马组织中水肿、空泡样变性面积较模型组明显减少,基本消失。突触结构清楚,形态完整,数量明显增多,突触界面较长,曲率较大,突触间隙较狭,突触后膜厚度较厚(图 2C)。
2.3.1 突触的面数密度 设定 100μm2为参照系截面积。各组突触的面数密度结果:治疗组突触面数密度较模型组明显增多,比假手术组明显减少,各组之间的差异有统计学意义(P<0.05,见表2)。
2.3.2 截面积和比表面 结果显示(见表3):模型组中突触截面积最大,其突触截面积与治疗组比较有统计学意义(P<0.01)。模型组中突触比表面最小,其突触比表面与治疗组比较有统计学意义(P<0.05),假手术组与治疗组突触比表面比较尚不认为有统计学意义。
表 13组大鼠行为学比较结果(±s,n=10)
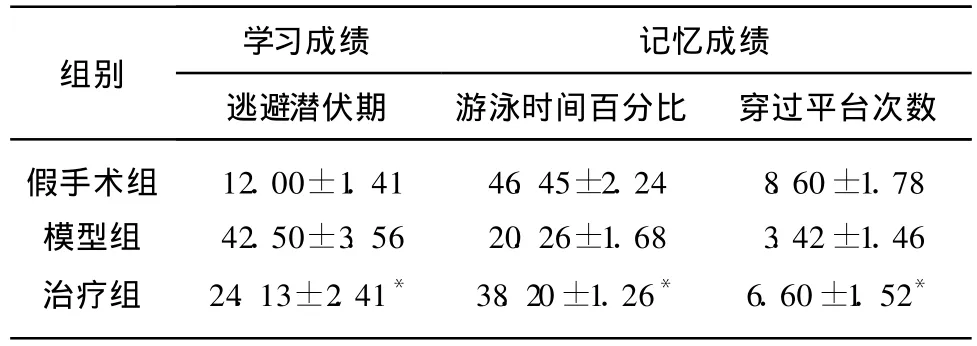
表 13组大鼠行为学比较结果(±s,n=10)
与模型组相比,*F=4.58、6.24、4.12,P均 <0.05
假手术组模型组治疗组12.00±1.4142.50±3.5624.13±2.41*46.45±2.2420.26±1.6838.20±1.26*8.60±1.783.42±1.466.60±1.52*
表2 海马 CA1区突触面数密度参数定量分析结果±s,n=5)

表2 海马 CA1区突触面数密度参数定量分析结果±s,n=5)
与假手术组相比*P<0.05;与模型组相比 △P<0.05
假手术组模型组治疗组32.86±6.3215.25±4.20△30.51±7.26*
表3 海马CA1区突触截面积及比表面定量分析结果±s,n=5)

表3 海马CA1区突触截面积及比表面定量分析结果±s,n=5)
与模型组比较*P<0.05,**P<0.01
模型组假手术组治疗组0.44±0.150.32±0.10**0.31±0.09*0.0078±0.00300.0087±0.0025*0.0083±0.0022△
3 讨 论
突触是神经元之间及神经元与效应器之间相互接触并实现信息传递和功能联系的部位,突触的可塑性是学习记忆能力改善的物质基础,改善海马突触可塑性可以增强学习记忆能力。阿托伐他汀是第3代他汀类调脂药,具有亲脂性,可竞争性抑制胆固醇合成酶系中的关键酶羟甲基戊二酰辅酶 A(HMGCOA)还原酶,使胆固醇合成受到限制,临床中主要通过调节血脂,达到预防脑卒中、冠心病、痴呆等的目的。阿托伐他汀可以通过调脂及调脂外作用预防血管性痴呆的发生和发展,已得到大量的大规模临床研究证实。目前,阿托伐他汀调节血脂防治痴呆的具体机制尚不清楚,大多数研究者认为可能是与稳定血管内皮功能、抗炎、抗血小板聚集、抗氧化等多重作用有关。2008年 Kurinami等[6]运用注射 β淀粉样肽(Aβ)的小鼠模型评估他汀对于 Aβ介导的认知功能损害的作用,认为他汀类药物可以减少Aβ的形成,这也可能是其预防痴呆的机制之一。他汀类药物还可以通过抑制甲羟戊酸合成来减少apoE分泌,降低脑内细胞外 apoE水平,从而阻止老年斑的形成,改善认知功能[7]。Daimon等[8]研究发现,预防性使用普伐他汀 14d,短暂性前脑缺血大鼠海马区迟发性死亡神经元数量明显减少,而与血浆中胆固醇水平无明显相关。
本研究观察到大鼠的学习和记忆能力有较明显的提高,这与大多数学者的研究结果一致[1]。研究表明阿托伐他汀治疗组血管性痴呆海马 CA1区Gray1型突触数量及突触小泡的含量显著增加;突触截面积减小、比表面增大;突触结构肿胀变性减轻。阿托伐他汀可能增强大鼠的神经元之间或神经元与效应器细胞之间的信息传递和功能联系,促进血管性痴呆大鼠的突触中神经递质的产生和储备,使突触处于更活化状态,神经信息传递能力增强,从而具有保护突触结构、减轻突触变性的作用。
轴突漏(axonal leakage)使轴突中神经递质等多种成分从轴突漏出,使远端轴突突触营养不良和末梢神经递质减少。本研究发现治疗组突触数量明显增多、变性减轻、突触小泡含量增多,分布较均匀,推测阿托伐他汀有改善轴突漏的功能。另外,我们推测其可能的机制主要是:(1)抗炎、抗氧化作用。炎症反应和氧化应激在血管性痴呆发病机制中的作用越来越受到学者的重视,也被大量的临床和基础研究所证实,在使用阿托伐他汀治疗后能降低血浆中 MMP-9、CRP等炎症因子及 8-羟基脱氧鸟苷酸(8-OhdG)、MDA的水平[9]。(2)保护脑血管、增加脑血流量。阿托伐他汀可以稳定血管斑块、上调扩血管因子的含量和脑源性神经营养因子、增加血管样结构的形成,特别是促进损伤区边缘和海马 CA1区的新生血管发生,这能明显减轻神经血管功能的损伤,增强受损神经元细胞的存活能力和恢复[10]。本研究发现阿托伐他汀治疗组突触肿胀变性明显减轻,这可能与抗炎、抗氧化作用及保护脑血管、增加脑血流量有关。
综上所述,阿托伐他汀可通过多种不同的靶点治疗血管性痴呆,其安全、疗效较好,具有重要的应用价值。其保护机制可能涉及多途径、多环节、多靶位的作用,有待深入研究及探讨。
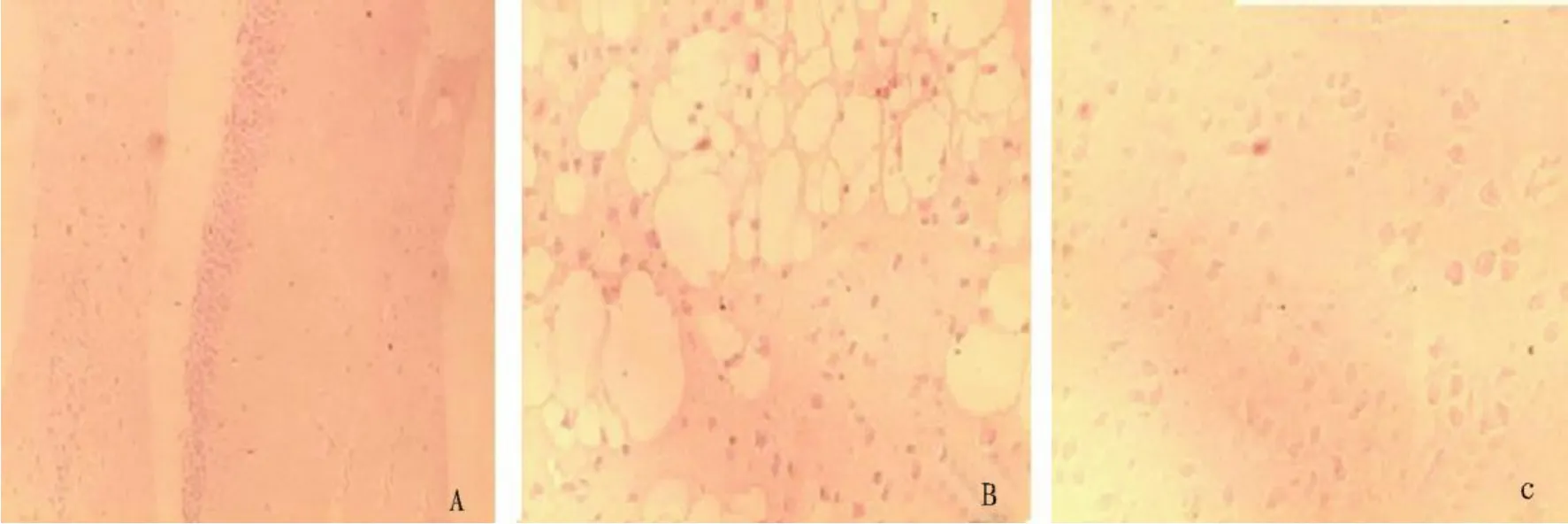
图1 大鼠海马区 HE染色

图2 大鼠海马区电镜超微结构
[1] Koladiya RU,Jaggi AS,Singh N,et al.Ameliorative role of Atrovastatin and Pitavastatin in L-Methionine induced vascular dementia in rats[J].BMCPharmacology,2008,8(14):1-12.
[2] Cramer C,Haan MN,Galea S,et al.Use of statins and incidence of dementia and cognitive impairment without dementia in a cohort study SYMBOL[J].Neurology,2008,71:344-350.
[3] Horsdal HT,Olesen AV,Gasse C,et al.Use of statins and risk of hospitalization with dementia:a danish population-based case-control study[J].Alzheimer Dis Assoc Disord,2009,23:18-22.
[4] Ni J,Ohta H,Matsumoto K,et al.Progressive cognitive impairment following chronic cerebral hypoperfusion induced by permanent occlusion of bilateral carotid arteries in rats[J].Brain Res,1994,653(1):231-234.
[5] Gundersen HJG.Notes on estimation of the numerical density of arbitrary profiles:the edge effect[J].Micros,1997,111(2):219.
[6] Kurinami H,Sato N,Shinohara M,et al.Prevention of amyloid betainduced memory impairment by fluvastatin,associated with the decrease in amyloid beta accumulation and oxidative stress in amyloid beta injection mouse model[J].Cleve Clin J Med,2008,75:87-93.
[7] Szwast SJ,Hendrie HC,Lane KA,et al.Association of statin use with cognitive decline in elderly African Americans[J].Neurology,2007,69:1873-1880.
[8] Daimon M,Aomi S,Kawamata T,et al.Pravastatin,a 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor,reduces delayed neuronal death following transient forebrain ischemia in the adult rat hippocampus[J].Neurosci Lett,2004,362:122-126.
[9] Wass mann S,Faul A,Hennen B.Rapid effect of 3-hydroxy 3-methylglutaryl coenzyme,a reduetase inhibitions[J].Circ Res,2003,93(9):98-103.
[10] Dulak J,Loboda A,Jazwa A,et al.Atorvastatin affects several angiogenic mediators in human endothelial cells[J].Endothelium,2005,12:233-241.
