铁合金中钼、镍、锰、硅、磷量的快速测定研究
2010-08-23刘青山
刘青山
(包头轻工职业技术学院,内蒙古 包头 014000)
1 前言
铁合金和铸件生产中,材料元素成分的分析对生产有重要的指导意义。以往工厂化验室分析方法上采取的都是分取样独立测定,方法陈旧、繁琐,分析流程长,化验成本高,不利于指导生产。本文根据笔者从事分析测试20多年的经验总结,结合相关的国家技术标准,采用分光光度计这一应用普及的分析设备,对铁合金、生铁、铸铁、球铁等材料中钼、镍、锰、硅、磷的测定进行方法改进:一次称样酸溶制成母液,再分取试液对上述元素分别测定。方法具有简单、快速、准确的特点,完全适用于工矿企业的快速分析需要。
2 实验部分
仪器及试剂:
(1)721或其他型号分光光度计。
(2)硫酸、硝酸、高氯酸。
(3)过硫酸铵、过氧化氢、钼酸铵、草酸、硫酸亚铁铵、抗坏血酸、硝酸银、硫脲。
(4)钼标准溶液(10 μg/mL)、镍标准溶液(10 μg/mL)、锰标准溶液(10 μg/mL)、硅标准溶液(10 μg/mL)、磷标准溶液(10 μg/mL)。
3 分析操作
3.1 母液制备
称取0.2000 g~0.5000 g试样于250 mL烧杯中,加入5 mL过硫酸铵溶液(15 %)、50 mL硫硝混酸溶液(50+10+940)低温加热使试样溶解后,再加入2 mL过硫酸铵溶液(15 %)煮沸2 min,滴加过氧化氢(3 %)使溶液变清亮,煮沸1 min~2 min,冷却后移入250 mL容量瓶以水定容备用。
3.2 钼的测定
3.2.1 原理
样品经硫硝混酸溶解后,经硫酸冒烟赶尽硝酸,再以氢氧化钠沉淀分离铁、铝等干扰元素,在硫酸介质中 Mo5+被硫脲还原为Mo4+,Mo4+与硫氰酸钾作用生成与钼含量成正比的琥珀色的络合物。
3.2.2 样品测定
干过滤25 mL母液于250 mL烧杯,加入1 mL硫酸、1 mL高氯酸,在电热板加热蒸干至冒尽SO3白烟,稍冷,加入10 mL氢氧化钠溶液(15 %),加热煮沸2 min,冷后移入100 mL容量瓶以水定容,放置澄清。吸清液10 mL于50 mL比色管,滴加1滴0.5 %酚酞指示剂,用(1+1)硫酸溶液滴至无色,加入10 mL硫酸——硫酸铜混合溶液(0.06 %),4 mL硫脲溶液(5 %)摇匀,10 min后加4 mL硫氰酸钾溶液(25 %),以水定容,室温下显色20 min,以工作曲线的“零”标准为参比,在λ=460 nm处用721分光光度计测定吸光度并根据工作曲线计算钼的百分含量。
3.3 镍的测定
3.3.1 原理
样品经硫硝混酸溶解后,经硫酸冒烟赶尽硝酸,再以氢氧化钠沉淀分离铁、铝等干扰元素,在硫酸介质中 Mo5+被硫脲还原为Mo4+,Mo4+与硫氰酸钾作用生成与钼含量成正比的琥珀色的络合物[MoO(CNS)5]2-,借以进行比色。反应如下:
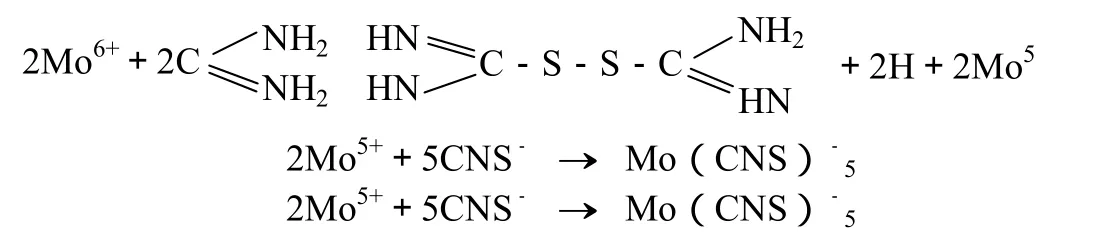
3.3.2 样品测定
分别吸取两份2.2.2的清液10 mL于100 mL容量瓶中,一份为显色液,另一份为参比液(参比液不加丁二酮肟溶液,改加无水乙醇2 mL)。加10 mL酒石酸钾钠(30 %),10 mL氢氧化钠(10 %),2 mL丁二酮肟(1 %),5 mL过硫酸铵溶液(4 %),以水定容,放置10 min后,在λ=530 nm处用721分光光度计测定吸光度,根据工作曲线计算镍的百分含量。
3.4 锰的测定
3.4.1 原理
以硝酸银作催化剂,用过硫酸铵定量将Mn2+氧化为Mn6+,有色溶液24 h很稳定,以此测定Mn的含量。其主要反应式如下:
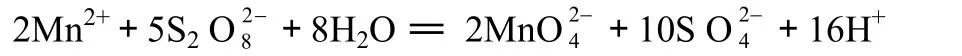
3.4.2 样品测定
吸取母液10 mL于100 mL容量瓶中,加10 mL过硫酸铵(15 %),5 mL硝酸银溶液(1 %),摇匀,水浴加热几分钟,冷却后以水定容,在λ=530 nm用721分光光度计测定吸光度,并根据工作曲线计算百分含量。
3.5 硅的测定
3.5.1 原理
钢铁试样经稀硝酸分解,其中的硅转化为可溶性硅酸。在弱酸性条件下,硅酸与钼酸铵作用生成硅钼杂多酸(硅钼黄)。在草酸存在的条件下用硫酸亚铁铵还原硅钼黄为硅钼蓝。硅钼蓝与硅含量成正比,由此,可用光度法测定钢铁中硅含量。反应方程如下:
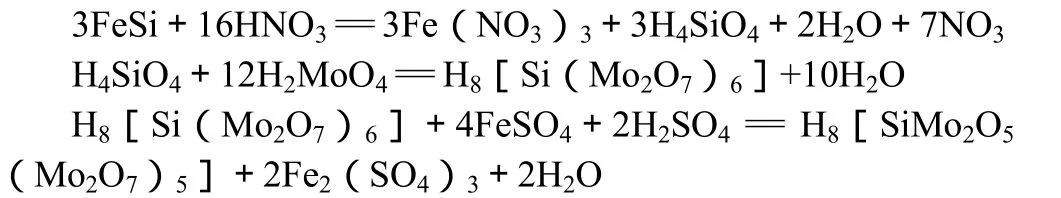
3.5.2 样品测定
吸取母液5 mL~10 mL于预先装水50 mL,硫硝混酸2 mL的100 mL容量瓶中,加2 mL钼酸铵溶液(5 %),放入沸水浴加热1 min,加5 mL草酸溶液(5 %)后立即加入5 mL硫酸亚铁铵(6 %)溶液,冷却,以水定容摇匀,在λ=650 nm用721分光光度计测定吸光度后根据工作曲线计算硅的百分含量。
3.6 磷的测定
3.6.1 原理
在铁中磷主要以金属磷化物的形式存在,经硫硝酸分解后,大部分转化为磷酸,少部分转化为亚磷酸,用过硫酸铵处理后全部转化为磷酸,在1/100 H2SO4的酸度下,加入钼酸铵、抗坏血酸等组成的显色剂,抗坏血酸还原Mo(Ⅵ)为Mo(Ⅳ)即可生成与磷成正比的蓝色的络合物磷钼蓝。借此,可利用光度法测定磷含量。主要反应方程式如下:
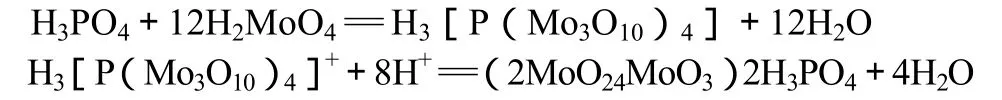
3.6.2 样品测定
吸取母液10 mL于50 mL比色管中,加2 mL H2SO4(1+5),25 mL水,加10 mL显色剂[显色剂:(1+5)H2SO410 mL,抗坏血酸(2.5 %)15 mL,钼酸铵(2.5 %)10 mL三者混合稀释至100 mL],以水定容,水浴加热2 min,冷却后,在λ=680 nm用721分光光度计测定吸光度并由工作曲线计算待测样品中磷的百分含量。
3.7 工作曲线的绘制
分别吸取与样品测定相对应元素的标准溶液0 μg、5 μg、10 μg、15 μg、20 μg、25 μg、30 μg、35 μg、40 μg、50 μg 于与样品测定的相同容器中,按照样品测定相同步骤进行显色后,以“零”标准为参比,测定吸光度并以浓度C为纵坐标,吸光度A为横坐标作出对应元素的工作曲线,此工作曲线每月校正一次。
4 实验结论
(1)用本方法对BH0719-1(冶金工业部钢铁研究所)标样进行了分析,分析结果与参考值比较见表1。
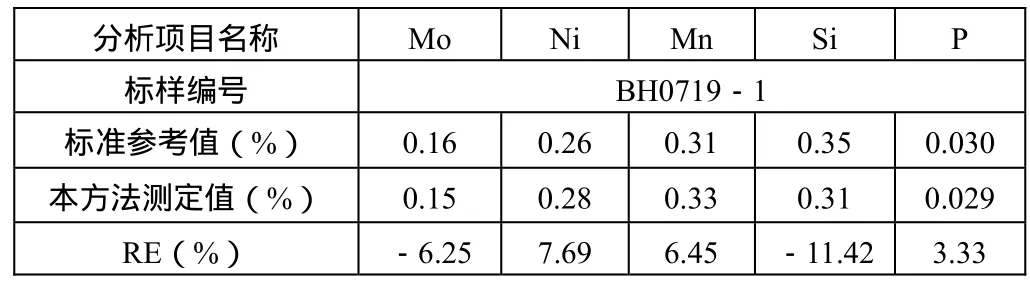
表1 BH0719-1分析结果与参考值
(2)大量实践发现:当样品中钼:0.10 μg/mL~10.00 μg/mL;镍:0.020 μg/mL~10.00 μg/mL;锰:0.010 μg/mL~20.00 μg/mL;硅:0.050 μg/mL~50.00 μg/mL;磷:0.050 μg/mL~10.00 μg/mL范围内符合比尔定理,样品分析中,其浓度超出上述范围时,可采用增、减称样量或改变分液体积等,使其符合比尔定理的适用范围。

