慢性阻塞性肺疾病急性加重期痰热证模型的建立与评价*
2010-08-22李建生周红艳乔翠霞张艳霞李素云余海滨
李建生,周红艳,乔翠霞,张艳霞,李素云,余海滨
(1.河南中医学院 老年医学研究所,河南 郑州 450008;2.河南中医药研究院 中药研究所,河南 郑州 450004)
慢性阻塞性肺疾病急性加重期痰热证模型的建立与评价*
李建生1,周红艳2,乔翠霞1,张艳霞1,李素云1,余海滨1
(1.河南中医学院 老年医学研究所,河南 郑州 450008;2.河南中医药研究院 中药研究所,河南 郑州 450004)
目的:建立、评价与临床证候相吻合的慢性阻塞性肺疾病急性加重期(AECOPD)痰热证大鼠模型。方法:基于COPD稳定期模型,通过滴入肺炎克雷伯杆菌结合风热刺激的方法,建立COPD急性加重期痰热证大鼠模型。结果:模型组大鼠出现呼吸急促,拱背蜷缩,便干,饮水量增加,尿量减少,体温升高等征象;与正常组比较,模型组大鼠血清中肾上腺素(E)、去甲肾上腺素(NE)、皮质醇(Cor)、肿瘤坏死因子-α(TNF-α)、白介素-8(IL-8)、C反应蛋白(CRP)及BALF中TNF-α、IL-8、细胞间黏附因子-1(ICAM-1)水平明显升高(P<0.05,P<0.01),呼吸频率(f)加快(P<0.01),潮气量(VT)、每分通气量(MV)和呼气峰流值(PEF)显著下降(P<0.01),吸气阻力(Ri)明显升高(P<0.01)。结论:采用中医传统病因结合疾病模型的方法建立COPD急性加重期痰热证模型是成功的。
慢性阻塞性肺疾病;痰热证;病证结合
COPD是一种以气流受限为特征的慢性炎症性呼吸系统疾病,COPD急性加重会加速肺功能的恶化,缩短其自然病程,严重影响生活质量[1]。中医药治疗COPD具有明显优势[2-4],但由于缺乏合适的中医证候动物模型,使中医药治疗COPD疗效机制的深入探讨受到局限。AECOPD以邪实为主,多见痰、瘀、热证,其中痰热证为其主要证候。因此,本研究基于COPD稳定期模型,通过滴入肺炎克雷伯杆菌并给予风热刺激的方法,建立AECOPD痰热证大鼠模型,为探明COPD的发病机制和中医药治疗机制提供方法和依据。
1 材料与方法
1.1 材料
Wistar大鼠,清洁级,70只,雌雄各半,体重220g±20g,由河南省实验动物中心提供(豫SCXK2005-0001)。肺炎克雷伯杆菌由中国生物制品检验鉴定所提供,批号46114,使用前将细菌浓度调整为 6 ×108CFU/ml、6 ×1014CFU/ml;烟熏箱:容积为300L,自制;101-2型鼓风干燥箱由上海市仪器厂生产。Hema-Screen18全自动血细胞分析仪:意大利产;BUXCO肺功能仪:美国;HH6003型r免疫计数器:北京核海高技术有限公司;TNF-α、IL-8、CRP、ICAM-1放免试剂盒由解放军总医院科技开发中心放免所提供,批号20080430;医用净化工作台由吴江雄峰净化设备有限公司生产。
葶贝胶囊由南风集团垣曲制药有限责任公司提供,批 号 070801,大 鼠 用 量 0.48g·kg-1·d-1,用0.5%羧甲基纤维素钠配成4.8%浓度备用;二陈汤出自《太平惠民和剂局方》:半夏、橘红各15g、白茯苓9g、甘草4.5g;三子养亲汤出自《韩氏医通》:苏子、白芥子、莱菔子各9g;以上药物皆由河南中医学院第一附属医院制剂室提供并鉴定。二陈汤合三子养亲汤方中所用生药材去除杂质,切制后按组方剂量配比,加入生药材10倍量的水,浸泡60min后加热煎煮,沸腾 30min,滤取煎液;药渣加水煎煮20min,滤取煎液;合并2次煎液,浓缩至药液含生药0.61g/ml,4℃ 保存备用。
1.2 分组与给药
大鼠随机分为正常组、热证组、COPD稳定期组(简称稳定期组)、AECOPD组、AECOPD痰热证组(简称模型组)、方证对应组、方证非对应组7组。方证对应组第13周的第6天开始灌胃葶贝胶囊0.48g·kg-1·d-1,每日 1 次,连续 7d;方证非对应组给予二陈汤合三子养亲汤水煎剂灌胃,每鼠6.12g·kg-1·d-1,每日 1 次,连续 7d;其余各组给予相同体积的生理盐水。
1.3 模型制备
参照许浒[5]制备 COPD模型的方法,以烟熏加滴菌的方法制备COPD稳定期大鼠模型:吸取培养液或肺炎克雷伯杆菌菌液0.1ml(6×108CFU/ml),趁大鼠吸气时滴入鼻腔内,每5d 1次,持续12周。点燃香烟,使烟熏箱烟雾浓度达到5%(v/v)左右,2次/d,30min/次,2次烟熏间隔 3h,持续 12周。12周结束时,随即抽取大鼠进行检验,评价是否符合COPD病理特征。于第13周开始,建立慢性阻塞性肺疾病急性加重期痰热证大鼠模型:将大鼠置于鼓风干燥箱中(温度39℃ ±1℃,湿度50%,风速1m/s),30min/次,2 次/d,2 次间隔 3h,连续 9d。于第13周的第6天经鼻腔滴入大剂量肺炎克雷伯杆菌(6 ×1014CFU/ml),2 次/d,每次 0.3ml,连续 4d,并进行有关指标的测定。
1.4 观察及指标测定
1.4.1 一般状态 包括神色、活动状况、分泌物、被毛、呼吸、体温、自主活动等症状。
1.4.2 白细胞计数和中性粒细胞比率测定外周血白细胞计数单位以×109/L表示,BALF中白细胞计数单位以×108/L表示,中性粒细胞比率单位以百分比(%)表示。
1.4.3 血清中 E、NE、Cor、TNF-α、IL-8、CRP 测定 采用放射免疫法测定,TNF-α、IL-8、E、NE、Cor单位以ng/ml表示,CRP单位以ug/ml表示。
1.4.4 支气管肺泡灌洗液(BALF)中 TNF-α、IL-8、ICAM-1测定 采用放射免疫法测定,TNF-α、IL-8、ICAM-1单位以 ng/ml表示。
1.4.5 肺功能测定 于取材前1d采用整体体积描记法测定各组 f、VT、MV、PEF 及 Rin。
1.4.6 肺组织病理 常规HE染色,光镜下观察肺组织病理形态学改变。
1.5 统计学方法
所有数据采用SPSS 13.0统计分析软件处理。符合正态分布的计量资料用均数()±标准差(s)表示,各组间比较用单因素方差分析。
虽然在课堂上对多媒体技术进行有效地利用能够在一定程度上激发学生学习兴趣,但是多媒体教学却使传统课堂上老师与学生之间的表情或者手势的互动环节变得少之又少,不利于老师和学生之间感情的培养。
2 结果
2.1 一般状态 正常组大鼠皮毛光泽,肌肉丰满,呼吸平稳,体温正常,活动能力强,饮食正常,体重增加;模型组大鼠呼吸急促,口鼻有分泌物,可闻及痰鸣音,拱背蜷缩,皮毛无光泽,便干,饮水量增加,尿量减少,体温升高。
2.2 各组大鼠外周血白细胞计数及中性粒细胞比率的变化
表1显示,与正常组比较,模型组WBC和N升高(P<0.05,P<0.01);模型组 WBC和 N较热证组显著升高(P<0.01);方证对应组WBC和N均较模型组明显下降(P均<0.05)。
表1 各组大鼠外周血白细胞计数及中性粒细胞比率的变化(n=10±s)

表1 各组大鼠外周血白细胞计数及中性粒细胞比率的变化(n=10±s)
注:与正常组比较:*P<0.05, P<0.01;与热证组比较:★P<0.05,★★P<0.01;与稳定期组比较:◆P<0.05,◆◆P<0.01;与急性加重组比较:#P<0.05,##P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01
组别 WBC(×109/L) N(%)正 常 组10.06±1.65 11.74±3.63热 证 组 12.71±1.08 14.83±2.33*稳 定 期 组 11.91±1.22* 14.72±1.72*AECOPD 组 13.32 ±1.13 ◆ 16.64 ±3.97 模 型 组 14.54 ±1.89 ★★ 18.23 ±3.40 ★★方 证 对 应 组 13.08±1.41▲ 14.70±1.80▲方证非对应组13.74±1.67 15.49±3.85
2.3 各组大鼠BALF中白细胞计数及中性粒细胞比率的变化
表2 各组大鼠BALF中白细胞计数及中性粒细胞比率的变化(n=10,±s)
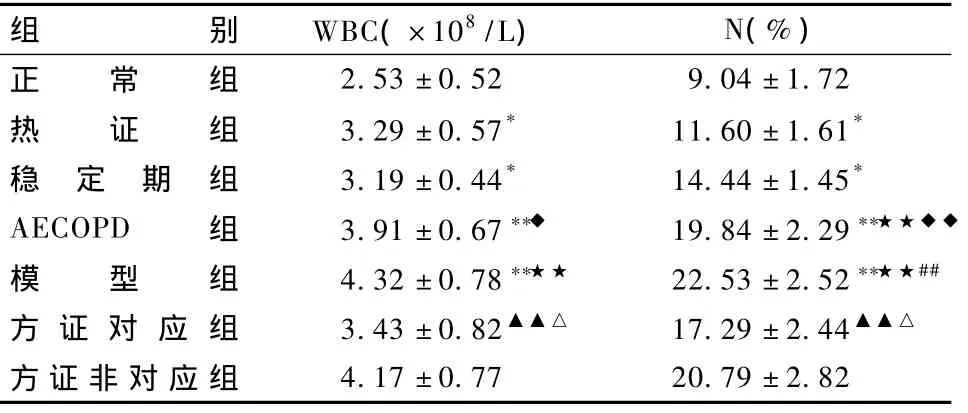
表2 各组大鼠BALF中白细胞计数及中性粒细胞比率的变化(n=10,±s)
注:与正常组比较:*P<0.05, P<0.01;与热证组比较:★P<0.05,★★P<0.01;与稳定期组比较:◆P<0.05,◆◆P<0.01.;与急性加重组比较:#P<0.05,##P<0.01;与模型组比较:▲P<0.05,▲▲P<0.01;与方证非对应组比较:△P<0.05,△△P<0.01(下同)
组别 WBC(×108/L) N(%)正 常 组2.53±0.52 9.04±1.72热 证 组 3.29±0.57* 11.60±1.61*稳 定 期 组 3.19±0.44* 14.44±1.45*AECOPD 组 3.91 ±0.67 ◆ 19.84 ±2.29 ★★◆◆模 型 组 4.32 ±0.78 ★★ 22.53 ±2.52 ★★##方 证 对 应 组 3.43±0.82▲▲△ 17.29±2.44▲▲△方证非对应组4.17±0.77 20.79±2.82
表2显示,与正常组比较,模型组WBC和N均升高(P<0.05,P<0.01);模型组 WBC和 N较热证组显著升高(P<0.01);与AECOPD组比较,模型组N显著升高(P<0.01);方证对应组 WBC和 N均较模型组明显下降(P<0.05)。
2.4 各组大鼠血清中E、NE、Cor的变化
表3显示,热证组、稳定期组、AECOPD组、模型组E、NE、Cor均较正常组升高,尤以模型组和热证组升高明显(P<0.05);模型组Cor较AECOPD组升高(P<0.05);与模型组比较,方证对应组 E、NE和Cor均降低(P<0.05,P<0.01),方证非对应组有降低趋势(P>0.05)。

正 常 组39.21±10.33 27.81± 8.17 22.87± 8.32热 证 组53.52±13.96*40.88±11.33* 31.61± 9.37*稳 定 期 组42.45±12.34 29.67±11.24 28.07± 7.09 AECOPD 组 44.98±14.71 35.32± 7.82 26.84±14.09模 型 组54.04±17.78*39.54±11.13* 39.64±13.16*#方 证 对 应 组 40.85±10.20▲28.86± 6.76▲ 23.74± 5.62▲▲方证 非 对 应 组 46.20±14.48 31.22± 9.31 28.87± 9.34▲
表4显示,与正常组比较,AECOPD和模型组TNF-α、IL-8、CRP 均显著升高(P<0.01);模型组CRP较热证组升高明显(P<0.01);AECOPD TNF-α、IL-8、CRP 较稳定期组明显升高(P<0.05,P<0.01);与模型组比较,方证对应组 TNF-α、IL-8、CRP均降低(P<0.05,P<0.01),方证非对应组 TNF-α、IL-8、CRP有降低趋势(P>0.05)。
2.6 各组大鼠肺泡灌洗液中 TNF-α、IL-8、ICAM-1的变化
表5显示,与正常组比较,稳定期组、AECOPD组、模型组 TNF-α、IL-8、ICAM-1 均升高(P<0.05,P<0.01);AECOPD组 TNF-α、ICAM-1及 IL-8较稳定期组升高(P<0.05,P<0.01);与模型组比较,方证对应组TNF-α、IL-8明显降低(P<0.05),方证非对应组 TNF-α、IL-8、ICAM-1有下降趋势(P>0.05)。
表4 各组大鼠血清中 TNF-α、IL-8、CRP的变化(n=9,±s)

表4 各组大鼠血清中 TNF-α、IL-8、CRP的变化(n=9,±s)
组别 TNF-α(ng/ml) IL-8(ng/ml) CRP(ug/ml)正 常 组39.98± 9.81 0.77±0.34 1.14±0.32热 证 组 46.16±10.09 1.17±0.22* 1.45±0.14稳 定 组 45.92±11.83 0.96±0.36 1.47±0.12*AECOPD 组 55.87 ± 8.37 ◆ 1.35 ±0.45 ◆ 1.89 ±0.43 ◆◆模 型 组 60.12± 8.48 1.66±0.56 2.04±0.44 ★★方 证 对 应 组 50.57± 8.87▲ 1.31±0.34▲ 1.59±0.19▲▲方证非对应组55.81±12.10 1.45±0.18 1.85±0.44
表5 各组大鼠肺泡灌洗液中TNF-α、IL-8、ICAM-1的变化(n=10,±s)

表5 各组大鼠肺泡灌洗液中TNF-α、IL-8、ICAM-1的变化(n=10,±s)
组别 TNF-α(ng/ml) IL-8(ng/ml) ICAM-1(ng/ml)正 常 组19.89±3.10 0.65±0.15 106.04±4.35热 证 组 25.28±3.84 0.92±0.12* 112.31±8.98稳 定 组 29.13±6.21 0.88±0.17* 129.23±9.29 AECOPD 组 38.11 ±6.06 ◆ 1.18 ±0.25 ◆◆ 137.63 ±7.46 ◆模 型 组 40.49 ±5.68 ★★ 1.22 ±0.33 ★ 146.25 ±5.61 ★★方 证 对 应 组 33.90±5.74▲ 0.97±0.14▲ 140.42±6.26方证非对应组38.35±6.67 1.03±0.36 144.40±8.19
2.7 各组大鼠肺功能变化
表6显示,与正常组比较,热证组、稳定期组及AECOPD组、模型组大鼠 f加快(P<0.05,P<0.01),稳定期组、AECOPD 组、模型组 VT、MV 和PEF显著下降(P<0.01),Ri明显升高(P<0.01);与稳定期组比,AECOPD组 PEF、VT、MV均下降(P<0.05,P<0.01),Ri升高(P<0.01);模型组较AECOPD组PEF明显下降(P<0.05),Ri显著升高(P<0.01);与热证组比,模型组 VT、MV、PEF明显下降(P<0.01),Ri显著升高(P<0.01);与模型组比较,方证对应组和方证非对应组呼吸频率、VT、MV、PEF均下降,但无明显差异(P>0.05)。
表6 各组大鼠肺功能变化(n=10,±s)
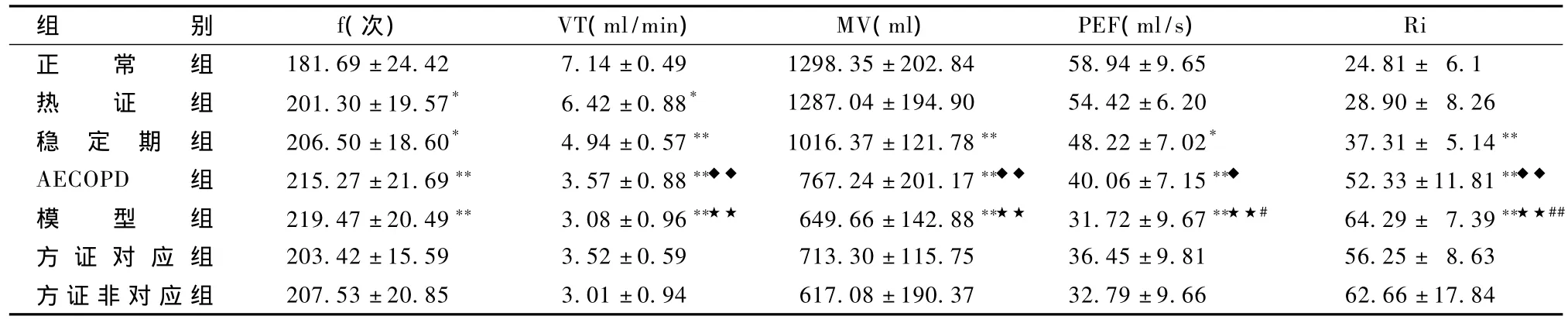
表6 各组大鼠肺功能变化(n=10,±s)
组别f(次) VT(ml/min) MV(ml) PEF(ml/s)Ri正 常 组 181.69±24.42 7.14±0.49 1298.35±202.84 58.94±9.65 24.81± 6.1热 证 组 201.30±19.57* 6.42±0.88* 1287.04±194.90 54.42±6.20 28.90± 8.26稳 定 期 组 206.50±18.60* 4.94±0.57 1016.37±121.78 48.22±7.02* 37.31± 5.14 AECOPD 组 215.27 ±21.69 3.57 ±0.88 ◆◆ 767.24 ±201.17 ◆◆ 40.06 ±7.15 ◆ 52.33 ±11.81 ◆◆模 型 组 219.47 ±20.49 3.08 ±0.96 ★★ 649.66 ±142.88 ★★ 31.72 ±9.67 ★★# 64.29 ± 7.39 ★★##方 证 对 应 组 203.42±15.59 3.52±0.59 713.30±115.75 36.45±9.81 56.25± 8.63方证非对应组 207.53±20.85 3.01±0.94 617.08±190.37 32.79±9.66 62.66±17.84
2.8 各组大鼠肺组织病理形态学改变
正常组大鼠肺组织无明显病理变化。肉眼可见COPD稳定期组、AECOPD组、模型组大鼠两肺体积增大,呈膨胀状态,表面苍白不平,多处棕褐色烟尘斑。光镜下正常组气管及各级支气管仅见少量炎性细胞浸润,肺泡结构正常;热证组各级支气管有轻度炎症,肺间质内少量炎性细胞浸润,肺泡间隔增厚,血管扩张;稳定期组可见气管周围炎性细胞浸润,气管腔内上皮细胞脱落,有分泌物,肺泡间隔充血增厚,肺泡壁变薄破裂形成肺大泡,气管上皮大量杯状细胞增生;AECOPD组可见气管周围有大量中性粒细胞浸润,气管上皮杯状细胞增生,纤毛细胞倒伏、脱落、变性坏死,肺泡管、肺泡囊明显扩大,肺泡壁变薄破裂形成肺大泡;模型组气管壁内大量炎性细胞浸润,气管腔内可见尘细胞,肺间质增宽,血管扩张充血,杯状细胞增生,肺泡管、肺泡囊明显扩大,间隔变薄、断裂,肺泡扩大融合;方证对应组可见炎性细胞浸润,肺泡壁充血,肺间质增厚,支气管纤毛柱状上皮层增厚,杯状细胞增生,病理损伤较模型组有所减轻;方证非对应组气管周围大量炎性细胞浸润,呈灶状分布,气管内上皮细胞脱落,肺泡壁充血水肿,杯状细胞增生,肺泡扩大融合。
3 讨论
吸烟和下呼吸道细菌感染是COPD发生和急性加重的主要原因。本研究采用烟熏和滴菌等复合因素制备COPD稳定期模型,以短期、多次、高剂量经鼻腔滴入肺炎克雷伯杆菌并结合热环境风热刺激,建立AECOPD痰热证模型。通过对大鼠外观表现、肺功能及肺组织病理观察,认为在温度39±1℃,湿度50%,风速1m/s的环境比较符合 AECOPD痰热证模型的要求。COPD属于中医学“喘证”、“哮证”、“肺胀”等范畴。感受风热之邪是AECOPD形成痰热证的主要病因,外邪袭肺,肺气不宣则咳喘,邪热入里,蒸液成痰,缠喉难出,壅塞气道而加重咳喘诸症。本研究显示,模型组大鼠呼吸急促,咳嗽频作,口鼻有分泌物,可闻及痰鸣音,拱背蜷缩,皮毛无光泽,便干,饮水量增加,尿量减少,体温升高,与AECOPD痰热证的临床表现相似。通过对热证本质的研究发现,热证的产生在神经中枢具有相应的物质基础[6]。梁月华[7]认为,实热证早期交感神经和垂体-肾上腺系统机能增强,随后垂体-甲状腺机能也提高。本研究显示,模型组 E、NE、Cor均较正常组升高,提示模型大鼠垂体-肾上腺机能增强,皮质醇分泌增加,具有热证本质表现,属于热证范畴。
COPD是由多种炎症细胞参与的气道炎症,白细胞渗出是炎症反应最重要的特征,细胞因子IL-8、TNF-α、ICAM-1 等介导了 COPD 的炎症反应[8-9]。本组资料显示,稳定期组、急性加重组、模型组血清中 TNF-α、IL-8、CRP 及 BALF 中 TNF-α、IL-8、ICAM-1水平均较正常组升高,尤以模型组升高明显,说明细胞因子TNF-α、IL-8、ICAM-1参与了COPD模型大鼠稳定期和急性加重期气道重塑,表现为大量炎症细胞浸润、炎性介质释放,肺泡血管充血水肿、渗出,致肺组织损伤明显。CRP由肝脏大量合成和分泌,机体在急性感染状态下,血CRP可成倍增长,参与机体应激。研究证实,CRP是急性感染的敏感指标之一[10]。以上结果提示,肺炎克雷伯杆菌诱导的COPD急性加重期模型是成功的。
肺功能检查是COPD诊断、疗效评价的一项重要指标。本实验采用整体体积描记法测定大鼠肺功能,结果显示模型组大鼠 f加快,VT、MV和 PEF显著下降,Ri明显升高。肺脏病理形态学肉眼可见,模型组大鼠两肺体积增大,呈膨胀状态,表面苍白不平,可见多处棕褐色烟尘斑。光镜下模型组气管壁内大量炎性细胞浸润,肺间质增宽,血管扩张充血,杯状细胞增生,肺泡管、肺泡囊明显扩大,间隔变薄、断裂,肺泡扩大融合形成肺大疱。结果提示,模型组大鼠肺功能和肺脏病理改变符合AECOPD临床特征。
采用药物的反证治疗,根据其疗效及相关实验指标变化,有助于评价病证结合模型是否成功。本研究显示,方证对应治疗组大鼠外周血和BALF中白细胞数量和中性粒细胞比率,血清中 E、NE、Cor、TNF-α、IL-8、CRP 和 BALF 中 TNF-α、IL-8 水平较模型组明显降低,提示方证对应治疗能拮抗中性粒细胞聚集和炎性细胞因子的释放,抑制炎症反应,减轻肺损伤,使大鼠痰热症状得到显著改善。方证非对应药物治疗对模型大鼠一般症状、体征有所改善,对炎症反应和肺功能无明显改善,其治疗效果不及方证对应组。从药物治疗角度证实所建模型符合中医痰热证。
综上所述,采用中医传统病因结合现代疾病模型的方法,建立COPD急性加重期痰热证大鼠模型,并从大鼠症状、实验室指标及药物反证等进行评价,表明COPD急性加重期痰热证大鼠模型成功建立,可为COPD急性加重期痰热证研究提供依据。
[1]唐昊,修清玉.慢性阻塞性肺疾病急性加重的研究[J].国际呼吸杂志,2007,27(3):225-229.
[2]李建生,李素云,马利军,等.通塞颗粒治疗老年慢性阻塞性肺疾病急性加重期的临床疗效评价[J].河南中医学院学报,2003,18(5):35-38.
[3]李素云,程现宽,李建生,等.通塞颗粒对老年人 COPD急性加重期炎性细胞因子的影响[J].辽宁中医杂志,2003,30(8):624-626.
[4]郑文龙,楼正家,李廷谦,等.黄芪和川芎嗪对慢性阻塞性肺疾病血瘀证血浆内皮素-1及内毒素水平的影响[J].中国中西医结合急救杂志,2008,15(3):142-144.
[5]许浒,熊密,黄庆华,等.细菌感染导致慢性阻塞性肺疾病大鼠模型的探讨.中华结核和呼吸杂志,1999,12(22):739-742.
[6]梁月华.中医寒热本质的初步研究[J].中华医学杂志,1979,59:705.
[7]梁月华.寒热本质研究的10年回顾.陈可冀主编.迈向21世纪的中西医结合—中国中西医结合学会成立10周年学术发展研讨会论文集,中国医药科技出版社,1991.228-229.
[8]颜雪琴,金玲湘,戴元荣.慢性阻塞性肺疾病急性加重期细胞因子测定的意义[J].临床肺科杂志,2007,12(3):224-225.
[9]Aaron SD,Angel JB,Lunau M.et al.Granulocytes inflammatory markers and airway infection during acute exacerbation of chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2001,163(2):349-55.
[10]王勇.C-反应蛋白对慢性阻塞性肺疾病急性加重期的诊断价值探讨[J].临床医药实践杂志,2008,17(7):581-582.
Establishment and Evaluation of Model of Chronic Obstructive Pulmonary Diseases with Phlegm Syndrome during Acute Exacerbation Period
LI Jian-sheng1,ZHOU Hong-yan2,QIAO Cui-xia1,ZHANG Yan-xia1,LI Su-yun1,YU Hai-bin1
(1.Institute of Geriatrics Henan College of Traditional Chinese Medicine,Zhengzhou450003,China;2.Henan Academy of Chinese Medicine,Zhengzhou450004,China)
Objective:Establish and evaluate the rat model of acute exacerbation COPD with phlegm-heat syndrome according to clinical symptom.Methods:Based on the model of stable COPD,the acute exacerbation of phlegm-heat model was made by the nasal instillation of Klebsiella pneumoniae with stimulating of heat and wind evil.Results:The rats in model group manifested tachypnea,frequent cough,extradosing and shrinking,the increase of drinking,dry stool,yellow urine,increasing temperature and so on.the contents of E,NE,Cor,IL-8,TNF-α,CRP in serum and IL-8,TNF-α,ICAM-1 in BALF in model group evidently increased(P<0.05,P<0.01),the rats breathing frequency(f)was more frequent(P<0.01),The tidal volume(VT),minute ventilation(MV)and the value of peak expiratory flow(PEF)decreased significantly(P<0.05,P<0.01),airway resistance(Rin)was significantly increased compared with those in normal group(P<0.01).Conclusions:By combining the TCM pathogens with modern disease model to establish the rat model of acute exacerbation COPD with phlegm-heat syndrome was successful.
chronic obstructive pulmonary diseases;phlegm-heat symptom of TCM;combination of disease and syndrome
R563
B
1006-3250(2010)07-0553-04
国家自然科学基金资助项目(30772797);河南省高校新世纪优秀人才支持计划项目(2006HANCET-05)
2009-11-07
△指导老师
李建生(1963-),男,河南禹州人,教授,博士研究生导师,从事老年呼吸疾病的治疗与疗效评价研究。电话:0371-65676568,E-mail:li_js8@163.com。
