镁对草鱼生长和脂肪代谢的影响
2010-08-21汪福保林仕梅王亚哥
汪福保 罗 莉* 李 云 林仕梅 李 芹 陈 时 王亚哥 文 华
(1.西南大学动物科技学院,淡水鱼类资源与生殖发育教育部重点实验室,重庆400715;2.中国水产科学研究院淡水生态与健康养殖重点开放实验室,长江水产研究所,荆州434000)
镁是生物体内重要的阳离子,参与骨骼、牙齿的组成,催化和激活300多种酶体系,对动物的能量、蛋白质、糖和脂肪的代谢均产生重要的影响[1]。目前国内外对镁在水产动物上的营养研究主要集中在需求量[2-10]、沉积规律[2-3,11]、免疫[11]、缺乏症[4,11-12]等方面。关于镁对我国主要代表性鱼类的营养效应研究较少[13],而其对草鱼脂肪代谢调控的影响未见报道。基于此,本试验选用草鱼为研究对象,在基础纯化日粮中添加不同水平的镁,研究其对草鱼生长和脂肪代谢的影响,旨在探讨镁对草鱼的促生长效果和对脂肪代谢的调控规律,为草鱼饲料中镁的适宜添加和饲料配制提供理论依据。
1 材料与方法
1.1 试验日粮和试验设计
根据草鱼的营养参数[14],以酪蛋白、明胶、糊精、玉米淀粉等为主要原料配制基础日粮,其组成及营养水平见表1,试验日粮分别在基础日粮中添加0(对照组)、150、300、600、1 200和 2 400 mg/kg 镁(以MgSO4的形式添加,镁含量15%),制成粒径为2 mm的颗粒饲料,60℃烘干后,置-20℃冰箱中保存备用。各组日粮中镁的实测值分别为:76.9、247.7、382.9、692.0、1 298.1 和 2 481.2 mg/kg 。
1.2 试验鱼与饲养管理
试验用鱼为草鱼幼鱼,购自重庆北碚歇马鱼种场。试验鱼先经浓度3%的食盐溶液消毒后,暂养于水族缸中,以药饵投喂3 d,再以基础日粮驯化10 d。正式试验开始前,选择健康草鱼540尾,均重为(10.68±0.14)g,随机分入6个处理,每个处理3个重复,每个重复 30尾鱼。养殖容器为容积为250 L(有效体积200 L)的玻璃纤维水族缸。水源为曝气后的自来水,养殖期间保持微流水,水体交换量为0.5 L/min。每天按体重的2%~3%分3次投喂(08:00、13:00和18:00)。饲养试验为期10周。饲养期间水温22~28℃,DO>5.0 mg/L,pH 6.6~7.0,NH4+-N:0.1~ 0.3 mg/L,NO2--N:0.009~0.020 mg/L。
1.3 测定指标
试验前取15尾鱼作为初始样本。养殖试验结束,停食24 h后,测定每缸鱼的总重,记录饲料投喂量,同时取样待测。

表1 基础日粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of basal diet(DM basis,%)
1.3.1 生长指标
增重率(WG,%)=(Wt-Wo)×100/Wo;
特定生长率(SGR,%/d)=(lnWt-lnWo)×100/d;
饲料效率(FE)=(Wt-Wo)/F。
式中:Wo为鱼初始尾均重(IBW,g);Wt为鱼终末尾均重(FBW,g);d为养殖试验天数;F为尾均摄食饲料总量(g)。
1.3.2 全鱼、肌肉和内脏脂肪含量
每组随机取5尾鱼作为全鱼粗脂肪的测定样本,另取5尾鱼的背肌及内脏作为鱼体肌肉、肝胰脏和肠道粗脂肪的测定样本。采用索氏抽提法测定粗脂肪。
1.3.3 肝胰脏、肠道和血清指标
试验结束试验鱼称重后,每组取15尾鱼,立即杀死,在冰盘中解剖,取出肠和肝胰脏(剥除多余的脂肪和结缔组织),用冷蒸馏水(4℃)冲净消化道内容物,并用滤纸吸干水分,再分别称重。称重后剪碎,按1∶9(g/mL)加入生理盐水(4℃),迅速转入玻璃匀浆器匀浆(匀浆过程在冰浴环境中进行),将匀浆液离心(4℃,3 500 r/min)15 min,取上清液制得粗酶液。每组另取5尾试验鱼,尾静脉采血,离心(3 500 r/min)15 min后取上层血清,将粗酶提取液和血清置于-80℃超低温冰箱中冷藏保存,用于肝胰脏、肠道和血清指标的测定:1)血清总脂采用香草醛法[15]测定;2)血清胆固醇采用邻苯二甲醛法[15]测定;3)血清甘油三酯采用中生北控生物科技公司试剂盒按甘油磷酸氧化酶-过氧化物酶终点法测定;4)肝胰脏和肠道脂肪酶活性参照聚乙烯醇橄榄油乳化液水解法[16]测定,脂肪酶活性单位定义:在pH 7.5、40 ℃保温 15 min,脂肪酶水解脂肪,以1 min产生1 μ g脂肪酸的量定为1个活性单位;5)肝胰脏中苹果酸脱氢酶(malic dehydrogenase,MDH)、脂蛋白酯酶(lipoprotein lipase,LPL)活性和组织蛋白含量按照南京建成生物工程研究所试剂盒说明书测定。苹果酸脱氢酶活性单位定义:在25℃,pH 7.5时,每 mg组织蛋白每 min催化1 μ mol草酰乙酸的量为1个活性单位。脂蛋白酯酶活性单位定义:在25℃,pH 7.5时,每mg组织蛋白每h在反应系统中产生1 μ mol的游离脂肪酸的量为1个酶活性单位。肝胰脏酶液蛋白含量采用考马斯亮兰G-250法测定。
1.4 数据处理
采用SPSS 12.0统计软件进行单因子方差分析(One-way ANOVA),同时进行Duncan氏多重比较,P<0.05为差异显著。所有数据均以“平均值±标准差(Mean±SD)”表示。
2 结 果
2.1 镁对草鱼生长和饲料利用的影响
由表2可知,除1 298.1 mg/kg组增重率和特定生长率无显著变化外,其他各水平镁对草鱼生长性能及饲料利用影响显著(P<0.05),692.0 mg/kg组生长和饲料效率均优于其他各试验组(P<0.05),增重率、特定生长率和饲料效率分别较对照组(76.9 mg/kg)提高 52.02%、31.25%和 56.82%(P<0.05);2 481.2 mg/kg组生长和饲料利用情况最差,显著低于其他各组(P<0.05)。
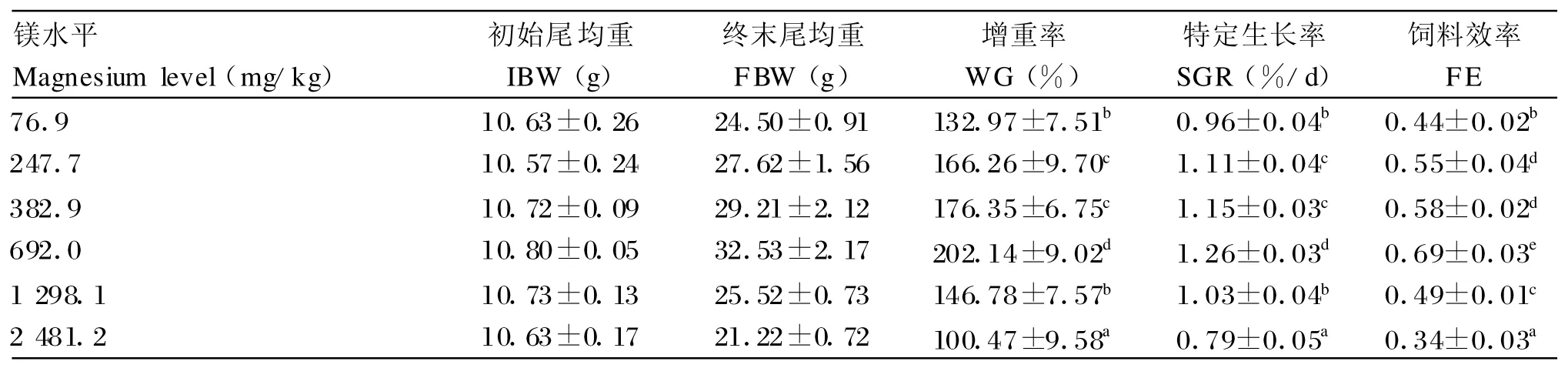
表2 镁对草鱼生长和饲料利用的影响Table 2 Effects of magnesium on growth and feed utilization of grass carp
2.2 镁对草鱼全鱼、肌肉和内脏脂肪含量及全鱼脂肪沉积效率的影响
由表3可知,除2 481.2 mg/kg组草鱼全鱼脂肪沉积效率无显著变化外,其他各水平镁对草鱼全鱼、肌肉和内脏脂肪含量及全鱼脂肪沉积效率影响显著(P<0.05)。随着日粮中镁添加量的增加,全鱼和内脏脂肪含量、全鱼脂肪沉积效率呈先上升后下降的趋势,均在692.0 mg/kg组达到最大值,分别比对照组提高16.91%、18.00%和56.79%(P<0.05)。382.9 mg/kg组和692.0 mg/kg组全鱼和内脏脂肪含量差异不显著(P>0.05),但均显著高于其他4组(P<0.05);各试验组肌肉脂肪含量组间差异不显著(P>0.05),但均显著高于对照组(P<0.05)。
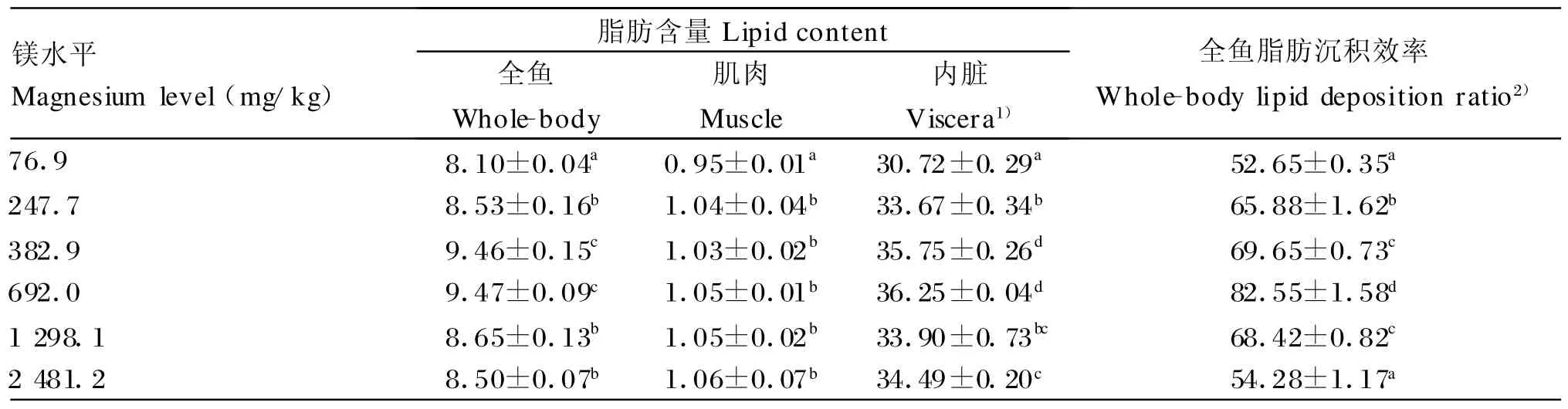
表3 镁对草鱼脂肪含量及全鱼脂肪沉积效率的影响(鲜重的百分数)Table 3 Effects of magnesium on lipid content and whole-body deposition ratio of grass carp (percentage of live weight,%)
2.3 镁对草鱼血清生化指标的影响
由表4可知,镁对草鱼血清总脂、胆固醇和甘油三酯的影响表现出相同的规律,即先上升后下降,均在692.0 mg/kg组达到最大值,分别比对照组提高19.12%、30.21%和33.54%(P<0.05)。
2.4 镁对草鱼脂肪消化代谢酶活性的影响
由表5可知,除2 481.2 mg/kg组鱼肝胰脏脂蛋白酯酶活性与对照组差异不显著(P>0.05)外,日粮中添加镁均能显著提高草鱼肝胰脏脂肪酶和苹果酸脱氢酶的活性,降低脂蛋白酯酶活性(P<0.05),以上3种酶活性均在692.0 mg/kg组达到最大值或最小值,肝胰脏脂肪酶和苹果酸脱氢酶活性分别比对照组提高144.77%和25.48%(P<0.05),脂蛋白酯酶活性比对照组下降58.82%(P<0.05)。日粮添加镁对肠道脂肪酶活性未产生显著影响(P>0.05)。
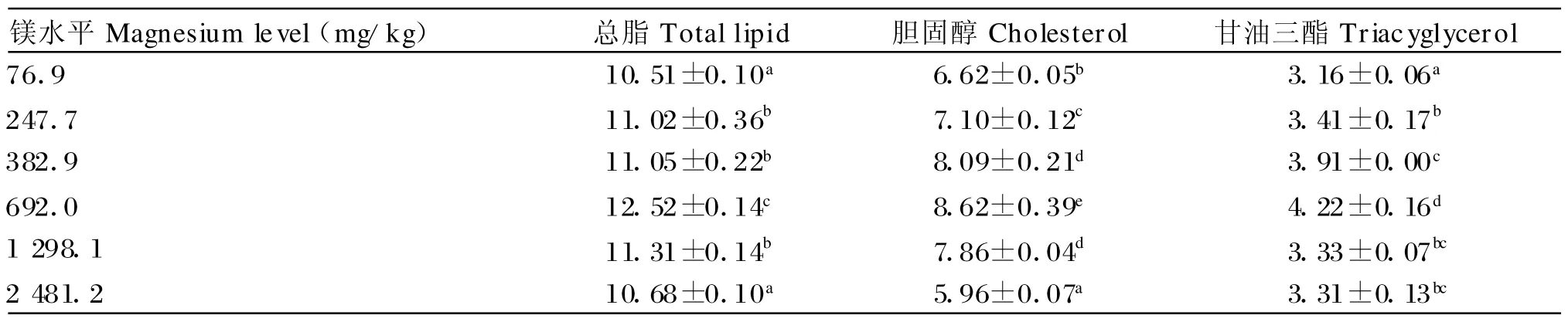
表4 镁对草鱼血清总脂、胆固醇和甘油三酯的影响Table 4 Effects of magnesium on total lipid,cholesterol and triacyglycerol in serum of grass carp (mg/L)

表5 镁对草鱼脂肪消化代谢酶活性的影响Table 5 Effects of magnesium on activities of lipid digestive and metabolism enzymes of grass carp
3 讨 论
3.1 镁对草鱼生长性能的影响
镁对水产动物生长性能的影响在大西洋鲑[3]、斑点叉尾鮰[4]、真鲷[5]、孔雀鱼[6]、凡纳滨对虾[7]、虹鳟[8-9]、异育银鲫[17]、草鱼[13]、鲤[10,18]、罗非鱼[13,19]上已有报道,研究表明饲料中添加适量镁能显著提高部分试验动物的生长性能[4,6-10,13,17-19],而饲料中缺少镁会使水产动物食欲不振、生长缓慢、活动呆滞,并会导致死亡率增高,同时生产性能明显下降[3-4,8-13]。本试验结果表明,对照组没有表现出明显的镁缺乏症,但与试验组相比其生长仍受到抑制。同位素试验发现,当食物中的镁不能满足需要时,罗非鱼可从水中吸收镁来满足一部分需要;而当食物中的镁含量过高时,它便通过皮肤将多余的镁排出体外,以保持体内镁平衡,这个过程会消耗大量的能量,导致生产性能下降[20]。Dabrowska等[19]也发现罗非鱼摄食低蛋白质(24%)、高镁(3.2 g/kg)日粮10周后生长速度、红细胞数量和血红蛋白含量显著下降,且活动呆滞,表明饲料中过量添加镁还会导致机体代谢紊乱,出现中毒反应。为研究草鱼日粮中镁的适宜添加量及过量添加镁的反应,本试验设置了高水平组,结果表明当饲料中镁含量超过1 298.1 mg/kg时,草鱼的生长速度减慢,当含量达到2 481.2 mg/kg时,草鱼的生长速度甚至低于不添加镁的对照组,但没有观察到中毒反应。以上说明高镁日粮(1 298.1~2 481.2 mg/kg)下草鱼生长会受到不良影响,与鲤[18]、罗非鱼[19]和凡纳滨对虾[7]的研究结果一致。
3.2 镁对草鱼体脂和血脂的影响
日粮中添加镁对畜禽具有降脂作用。Zofkova等[21]认为高血镁通过抑制畜禽胰岛素分泌和葡萄糖转化成脂肪而减少脂肪沉积。镁对水产动物的作用却报道不一。Shim等[6]发现,日粮中镁水平升高时,孔雀鱼鱼体脂肪含量相应增高。虹鳟中也有类似情况[9]。而高文[13]对罗非鱼的研究却发现,镁对其全鱼和肌肉的脂肪含量不产生影响。本研究结果表明,随着镁添加量的升高,全鱼和内脏的脂肪含量先上升后下降,且添加镁组的全鱼、内脏和肌肉的脂肪含量均显著高于对照组。镁对草鱼体脂影响程度为:内脏 >全鱼>肌肉,全鱼脂肪沉积效率在692.0 mg/kg组达到最高。说明镁对草鱼体脂的影响既不同于畜禽,也不同于罗非鱼,其影响机制有待进一步研究。
Rayssiguier等[22]研究表明大鼠缺镁后血浆中三酰甘油酯含量显著升高,并且肝中糖原含量显著降低,肝中三酰甘油酯增加。这与Tongyai等[23]的报道基本一致。Raysiguier等[24]还发现大鼠采食缺镁日粮导致高脂血症,主要是血浆中三酰甘油酯的脂解作用受影响和肝脂蛋白酯酶显著减少而引起。本研究结果显示,镁对草鱼血脂的影响与大鼠相反,低镁组血清总脂、甘油三酯和胆固醇含量显著下降;而在生长性能最好的692.0 mg/kg组,全鱼和内脏的脂肪含量最高,全鱼脂肪沉积效率最高,同时,血清总脂、甘油三酯和胆固醇含量达到最高,肝胰脏脂蛋白酯酶活性最低。日粮添加镁导致草鱼血脂升高的原因之一可能是由肝脂蛋白酯酶的活性降低所引起。因为脂蛋白酯酶主要催化血浆中乳糜颗粒和极低密度脂蛋白中的甘油三酯水解,其活性降低可导致血浆乳糜颗粒及极低密度脂蛋白降解障碍,从而引起高血脂[25-26]。
3.3 镁对草鱼脂肪代谢调控的探讨
动物体脂是处于不断合成与分解的动态体系。与哺乳类不同,鱼类缺乏皮下脂肪层,其主要脂肪蓄积部位是腹腔肠系膜脂肪组织、肝脏及肌肉。由于肝脏是动物脂肪酸β-氧化代谢的重要部位,因而它是鱼类随营养状况而改变脂肪蓄积的主要调节性贮脂器官[27-28]。饲料脂肪消化吸收后经门静脉进入肝胰脏,肝胰脏合成的甘油三酯在血浆脂蛋白的运载下,流经外周组织,或被肌肉组织摄取作为能量利用,或被脂肪组织摄取而沉积作为能量储备(脂库)。Scott等[29]和 Lee等[30]研究证实,苹果酸脱氢酶、葡萄糖-6-磷酸脱氢酶活性的高低直接关系到NADPH的生成量,进而影响体内脂肪的合成。脂蛋白酯酶是存在于毛细血管内壁上脂解血浆脂蛋白-甘油三酯而释放游离脂肪酸进入周围组织的关键酶,它通过控制其在脂肪组织与其他组织器官表达水平的高低直接决定脂肪组织与其他组织器官脂质底物配额的相对量,从而间接决定从食物中摄入脂类的代谢前途:以体脂形式贮备起来或作为能源底物消耗掉,并最终对机体脂质蓄积状况产生决定性影响[25,31]。本研究结果表明,饲料中添加适量的镁能够显著提高肝胰脏组织中的苹果酸脱氢酶活性,同时降低脂蛋白酯酶活性,说明镁能够促进草鱼肝胰脏的脂肪合成能力,减弱其对脂蛋白的转运能力,致使肝胰脏脂肪大量沉积,同时脂蛋白酯酶活性降低引起血浆脂蛋白代谢障碍,导致高血脂。这可能是本试验日粮中添加适量镁后,草鱼体脂增加、血脂升高的原因之一。
4 结 论
①日粮中添加适量的镁能够显著提高草鱼的生长性能和对饲料的利用能力,当添加量为600 mg/kg(日粮镁含量692.0 mg/kg)时促生长效果最好。
②日粮中添加适量的镁能够显著提高肝胰脏脂肪酶活性,但对肠道脂肪酶活性无显著影响。
③镁能够促进草鱼体脂沉积。其通过增强肝胰脏组织中苹果酸脱氢酶活性,降低脂蛋白酯酶活性,促进草鱼肝胰脏的脂肪合成能力,减弱其对脂蛋白的转运能力,从而导致脂肪沉积增多。
[1] 邱榕生,呙于明.镁的营养研究进展[J].动物营养学报,2004,16(2):5-11.
[2] 黄耀桐,刘永坚.草鱼种无机盐需要量之研究[J].水生生物学报,1989,13(2):134-150.
[3] El-Mowafi A F A,Maage A.Magnesium requirement of Atlantic salmon(Salmo salar L.)parr in seawater-treated fresh water[J].Aquaculture Nutrition,1998,4:31-38.
[4] Gatlin D M Ⅲ,Robinson E H,Poe W E.Magnesium requirement of fingerling channel catfish and signs of magnesium deficiency[J].Journal of Nutrition,1982,112:1 182-1 187.
[5] Sakamoto S,Yone Y.Requirement of red sea bream for dietary Mg[J].Bulletin of the Japanese Society of Scientific Fisheries,1979,45:57-60.
[6] Shim K F,Ng S H.Magnesium requirement of the guppy(Poecilia reticulata Peters)[J].Aquaculture,1988,73:131-141.
[7] Cheng K M,Hu C Q,Liu Y N,et al.Dietary magnesium requirement and physiological responses of marine shrimp(Litopenaeus vannamei)reared in low salinity water[J].Aquaculture Nutrition,2005,11:385-393.
[8] Knox D,CoweyC B,Adron J W.Studies on the nutrition of salmonid fish.The magnesium requirement of rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1981,45:137-148.
[9] Ogino C,Takashima F,Chiou J Y.Requirement of rainbowtrout for dietarymagnesium[J].Bulletin of the Japanese Society of Scientific Fisheries,1978,44:1 105-1 108.
[10] Ogino C,Chiou J Y.Mineral requirements in fish-Ⅱmagnesium requirement of carp[J].Bulletin of the Japanese Society of Scientific Fisheries,1976,42:71-75.
[11] El-Mowafi A F A,Waagbo R,Maage A.Effect of low dietary magnesium on immune response and osmoregulation of Atlantic salmon[J].Journal of A-quatic Animal Health,1997,9:8-17.
[12] Cowey C B,Knox D,Adron J W.The production of renal calcinosis by magnesium deficiency in rainbow trout(Salmo gairdneri)[J].British Journal of Nutrition,1977,38:127-135.
[13] 高 文.草鱼对糖的利用及Mg2+对草鱼和罗非鱼利用高糖的影响[D].硕士学位论文.广州:中山大学,2006.
[14] 廖朝兴.草鱼配合饲料营养参数及配制技术[J].淡水渔业,1997(1):5-7.
[15] 桂远明.水产动物机能学实验[M].北京:中国农业出版社,2004:12-15.
[16] 上海市医学化验所.临床生化检验(上)[M].上海:上海科学技术出版社,1979:366-367.
[17] 艾庆辉,王道遵.镁对异育银鲫生长的影响[J].上海水产大学学报,1998(增刊):148-153.
[18] Dabrowska H ,Meyer-Burgdorff K,Gǜnther K D.Magnesium status in freshwater fish,common carp(Cyprinus carpio L.)and the dietary protein-magnesium interaction[J].Fish Physiology and Biochemistry,1991,9:165-172.
[19] Dabrowska H ,Meyer-Burgdorff K,Gǜnther K D.Interaction between dietary protein and magnesium level in tilapia(Oreochromis niloticus)[J].Aquaculture,1989,76:277-291.
[20] Bijvelds M J C,Flik G,Kolar Z I,et al.Uptake,distribution and excretion of magnesium in Oreochromis mossambicus:dependence on magnesium in diet and water[J].Fish Physiology and Biochemistry,1996,15:287-298.
[21] Zofkova I,Zamrazil V,Simeckova A.Acute hypermagnesaemia retards glucoseassimilation and inhibits insulin secretion during intravenous glucose tolerance test(IVGTT)[J].Hormone Metabolism Research,1988,20:120-121.
[22] Rayssiguier Y,Gueux E,Weiser D.Effect of magnesium deficiency on lipid metabolism in rats fed a high carbohydrate diet[J].Journal of Nutrition,1981,111:1 876-1 883.
[23] Tongyai S,Rayssiguier Y,Motta C.Mechanism of increased erythrocyte membrane fluidity during magnesium deficiency in weanling rats[J].The A-merican Physiological Society,1989:270-276.
[24] Rayssiguier Y,Gueux E,Bussiere L.Dietary magnesium affects susceptibility of lipoproteins and tissues to peroxidation in rats[J].Journal of the American College of Nutrition,1993,12:133-137.
[25] Auwerx J,Leroy P,Schoonjans K.Lipoprotein lipase:recent contributions from molecular biology[J].Critical Reviews in Clinical Laboratory Sciences,1992,29:243-268.
[26] Santamarina-Fojo S.Genetic dyslipoproteinemias:role of lipoprotein lipase and apolipoprotein C-Ⅱ[J].Current Opinion in Lipidology,1992,3:186-195.
[27] Lock E A,Mitchell A M,Elcombe C R.Biochemical mechanisms of induction of hepatic peroxisome proliferation[J].Annual Review of Pharmacology and Toxicology,1989,29:145-163.
[28] Ando S,Mori Y.Characteristics of serum lipoprotein features associated with lipid levels of muscle and liver from five species of fish[J].Nippon Suisan Gakkaishi,1993,59:1 565-1 571.
[29] Scott R A,Comnelius S G,Mersmann H J.Effects of age on lipogenesis and lipolysis in lean and obese swine[J].Journal of Animal Science,1981,52:505-511.
[30] Lee Y B,Kauffman R G.Cellularity and lipogenic enzyme changes activities of procine intramuscular adipose tissue[J].Journal of Animal Science,1974,38:538-544.
[31] Zechner R.The tissue-specific expression of lipoprotein lipase:implications for energy and lipoprotein metabolism[J].Current Opinion in Lipidology,1997,8:77-88.
