miR-221/miR-222在乳腺浸润性导管癌中的表达及临床意义
2010-08-21许践刚黄关立颜育祥张宪波胡晓清赵挺张筱骅
许践刚,黄关立,颜育祥,张宪波,胡晓清,赵挺,张筱骅
(1.温州医学院附属定理学院 肿瘤外科,浙江 温州 325000;2.温州医学院附属第一医院肿瘤外科,浙江 温州 325000)
MicroRNA(miRNA)是近年来发现的长度约22 nt的内源性短链RNA,它通过和编码蛋白质的mRNA互补结合,抑制其表达,从而起到调控细胞的分化、生长、发育、增殖、代谢、凋亡等功能[1-4]。近年来发现,miRNA可作为肿瘤抑制或促进因子参与肿瘤的发生过程[5]。miR-221和miR-222是成簇分布的miRNA。研究表明,抑癌基因p27[6-8],p57[6]、前凋亡因子Bim[9],Bmf[9]等均是mir-222/mir-221的靶基因,参与了肝细胞肝癌[6,9]、甲状腺癌[8]、前列腺癌[7]等肿瘤的发生。但迄今为止,关于mir-222/mir-221与乳腺癌诸多临床病理特征的关系鲜有研究。为此,本研究通过茎环Realt-ime RTPCR方法检测了36例乳腺浸润性导管癌中miR-221和miR-222的表达,分析它们和临床病理特征的联系,探讨miR-221和miR-222在乳腺癌中的作用。
1 资料和方法
1.1 一般资料 36例女性乳腺浸润性导管癌标本采自温州医学院附属定理学院和温州医学院附属第一医院2008年10月至2009年5月肿瘤外科住院手术治疗的患者,年龄37~71岁,中位年龄55岁。乳腺癌组织标本取自病灶中央无坏死部分,另取距肿瘤边缘约3 cm的癌旁非肿瘤乳腺组织,离体后切成米粒大小,30 min内液氮保存。乳腺癌的诊断及常规病理资料由病理科医生盲法阅片后提供。Her-2受体的阳性标准参照FDA推荐的HercepTest结果评分。雌激素受体和孕激素受体的阳性标准为:肿瘤细胞阳性数大于10%;小于等于10%则认定为阴性。
1.2 RNA抽提 按Trizol试剂(购自Invitrogen公司)说明书抽提样品总RNA,为增加小RNA得率,异丙醇沉淀步骤改为-20 ℃沉淀2 h以上。DEPC处理水溶解RNA,分光光度计测定260 nm及280 nm吸光值,确定RNA溶液浓度和纯度。取2~5μg总RNA以1%琼脂糖变性凝胶电泳检测RNA的完整性。
1.3 miR-221和miR-222表达检测 以let-7a作为内参,分析miR-221和miR-222表达。表1为相关分析的引物序列(由上海英骏生物技术有限公司合成)。1μg总RNA分别以miR-221,miR-222及let-7a茎环RT引物进行逆转录,反应条件为:16 ℃ 30 min,42 ℃ 30 min ,75 ℃ 15 min,反应结束后-20 ℃保存。以15μL反应体系进行Real-time定量PCR。miRNA检测反应体系包括:1μL RT产物,1×SYBR Green I Mastermix,0.5μmol/L miRNA特异前向引物、0.5μmol/L通用的反向引物。Real-time定量PCR条件为:95 ℃10 min后,95 ℃ 15 s,60 ℃ 1 min,40循环。Real-time定量PCR使用Applied Biosystems 7500仪器进行。所有样品做3复孔。PCR产物经8% PAGE电泳分析。记录每个反应管中的荧光信号到达所设定的域值时所经历的循环数即Ct值,以let-7a作为内参照,采用定量PCR中的相对定量法,以N=2-△△Ct表示肿瘤组织miRNA表达相对于配对的正常组织的变化倍数,其中△△Ct=(CtmiRNA-Ctlet-7a)肿瘤-(CtmiRNA-Ctlet-7a)正常。

表1 引物序列
1.4 统计学处理方法 miRNA表达数据以中位数和四分位数间距表示。采用非参数Wilcoxon符号秩和检验(配对的正常和肿瘤组),Mann-Whitney U检验(两组)和Kruskal-Wallis H检验(多组)进行统计处理。
2 结果
2.1 miR-221和miR-222在乳腺癌及对应正常乳腺组织中的表达 我们采用Tang等[10]建立的茎环RT-PCR分析miR-221和miR-222表达。图1显示miR-221,miR-222及let-7a keal-time PCR扩增产物的熔解曲线和扩增曲线。以let-7为内参,与对应正常乳腺组织比较,miR-221和miR-222在乳腺癌中的相对表达量(N=2-△△Ct)中位数分别为4.48和3.56,均明显高于对应正常乳腺组织(见图2)。采用配对样本的Wilcoxon符号秩检验其差异有显著性(P值均为0)。乳腺癌miR-221和miR-222表达两者比较差异无显著性(P=0.176)(见图 2)。

图1 miR-221,miR-222及let-7a Real-time PCR扩增产物的熔解曲线和扩增曲线

图2 miR-221及miR-22在乳腺癌中的相对表达水平
2.2 miR-221和miR-222表达水平与乳腺癌多种临床病理特征的关系 由表2可见,miR-221和miR-222的表达在不同雌激素和Her-2表达状态存在显著差异。雌激素受体阴性表达和Her-2阳性表达的乳腺癌组织的miR-221表达明显高于雌激素受体阳性和Her-2表达阴性的标本(P值分别为0.038和0.025);miR-222的表达与miR-221类似,雌激素受体阴性表达和Her-2阳性表达的乳腺癌组织表达明显升高(P值分别为0.017和0.026)。此外miR-221和miR-222的表达在不同增殖指数(ki67)状态也存在一定差异的趋势(P值分别为0.089和0.075),在低增殖指数组(ki67≤10%)中,其表达低于高增殖指数组(ki67>10%)。miR-221和miR-222的表达与月经状况、肿块大小、孕激素受体状态、淋巴结转移及TMN分期无关。
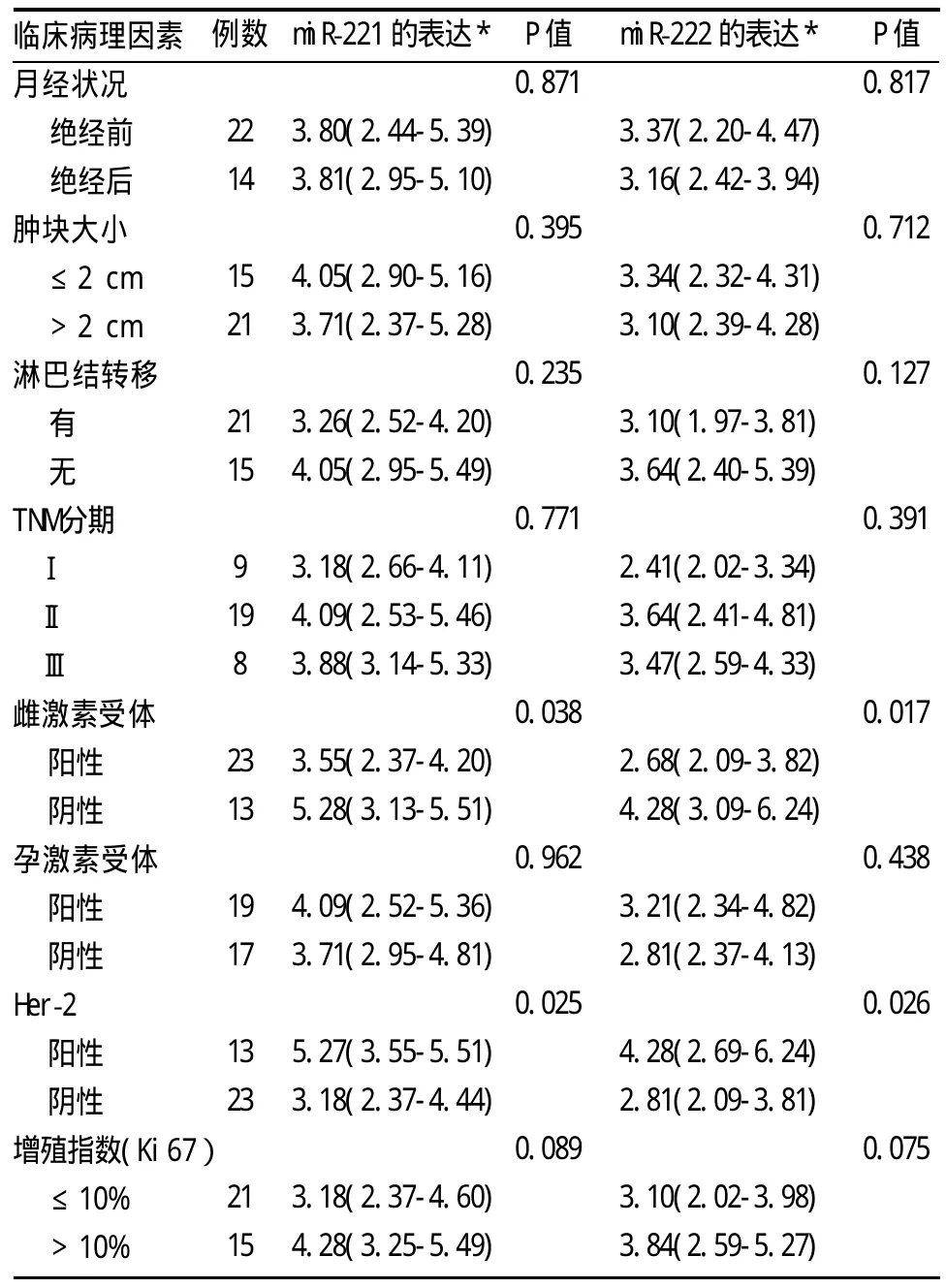
表2 乳腺浸润性导管癌中miR-221/miR-222表达和临床病理因素的相关性
3 讨论
肿瘤的发生和发展是细胞生长、凋亡等多个相关基因表达失衡的结果。跟绝大多数肿瘤一样,乳腺癌的发生、发展也是一个多基因改变的过程。在分子水平阐明乳腺癌的发生、发展机制是寻找新的分子治疗靶点的基础。以往的研究大多集中在编码蛋白的癌基因或抑癌基因上,近年来新发现的一类内源性微小RNA,即miRNA(microRNA),不编码蛋白质,通过碱基配对决定mRNAs的翻译和稳定性,从而调控细胞的分化、生长、发育、增殖、代谢、凋亡等功能。miRNA基因分布在除了Y染色体外的人类所有的染色体中[10]。根据生物信息学预测,一种miRNA可调控多达上百种靶基因的表达,miRNA可以通过其存在、缺失和表达水平的改变影响细胞的生长和分化。
miR-221和miR-222基因定位于X染色体P11.3区约1 kb的区域内,属成簇分布的miRNA,基本上呈同步表达,本研究亦发现两者在乳腺癌中的表达水平基本一致。近年来的研究表明,miR-221和miR-222积极参与了膀胱癌[11]、肝细胞肝癌[9]、胶质母细胞瘤[12]、前列腺癌[13]、甲状腺乳头状癌[8]、黑色素瘤[14]、胰腺癌[15]等肿瘤的发生。其靶基因涉及抑癌基因p27Kip1,p57Kip1,前凋亡因子Bim,Bmf,c-kit等,通过对这些基因的调控,抑制细胞凋亡、促进细胞生长,参与肿瘤发生[16]。
为分析miR-221,miR-222与乳腺癌发生、发展的关系,本研究以let-7a为内参,应用Realtime RT-PCR技术检测了36例乳腺浸润性导管癌组织相对于对应癌旁正常组织miR-221和miR-222的表达,并分析其与乳腺癌诸多临床病理特征的关系。与其他肿瘤中相关报道一致,乳腺癌中miR-221和miR-222的表达亦均明显上调。国内有学者运用miRNA芯片技术,筛选了乳腺癌细胞株MCF-7与乳腺上皮细胞MCF-10A的miRNA表达谱,发现miR-221,miR-222在MCF-7细胞中呈显著性低表达[19-20],与本研究结果不一致,究其原因,可能是由于本研究的研究对象是新鲜活体标本,其与MCF-7细胞株的基因表达谱存在差异。在分析miR-221和miR-222表达水平与乳腺癌多种临床病理特征的关系中可以发现,miR-221和miR-222的表达与雌激素受体的表达水平呈负相关,而与HER-2的表达呈正相关。最近有报道称,miR-221和miR-222通过靶向雌激素受体和p27 Kip1的表达,参与他莫昔芬治疗抵抗[17-18]。为此,乳腺癌组织miR-221和miR-222高表达亦可提示对内分泌治疗抵抗,抑制miR-221和miR-222的表达就有可能恢复内分泌治疗的敏感性。此外,miR-221和miR-222的表达在不同增殖指数(ki67)状态也存在一定差异的趋势,其在低增殖指数组(ki67≤10%)的表达低于高增殖指数组(ki67>10%),提示miR-221和miR-222可能还通过其他机制参与乳腺癌的发生和发展。
综上所述,本研究表明, miR-221和miR-222在乳腺癌组织较癌旁对应正常乳腺组织表达明显上调,并且和雌激素受体表达Her-2表达相关,不但是乳腺癌重要的潜在标志物,而且可能成为逆转内分泌治疗抵抗的治疗靶点。
[1] Ambros V. The functions of animal microRNAs[J]. Nature,2004, 431(7006):350-355.
[2] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism,and function[J]. Cell, 2004,116(2):281-297.
[3] Plasterk,RH.Micro RNAs in animal development[J]. Cell,2006,124(5):877-881.
[4] Poy MN,Spranger M, Stoffel M. microRNAs and the regulation of glucose and lipid metabolism[J]. Diabetes Obes Metab,2007,9(Suppl 2):67-73.
[5] Chen CZ. MicroRNAs as oncogenes and tumor suppressors[J]. N Engl J Med, 2005, 353(17):1768-1771.
[6] Fornari F, Gramantieri L, Ferracin M, et al. MiR-221 controls CDKN1C/p57 and CDKN1B/p27 expression in human hepatocellular carcinoma[J]. Oncogene, 2008,27(43): 5651-5661.
[7] Galardi S, Mercatelli N, Giorda E, et al. miR-221 and miR-222 expression affects the proliferation potential of human prostate carcinoma cell lines by targeting p27Kip1[J]. Biol Chem, 2007, 282(32):23716-23724.
[8] Visone R, Russo L, Pallante P, et al. MicroRNAs (miR)-221 and miR-222, both overexpressed in human thyroid papillary carcinomas, regulate p27Kip1 protein levels and cell cycle[J]. Endocr Relat Cancer, 2007,14(3):791-798.
[9] Gramantieri L, Fornari F, Ferracin M, et al.MicroRNA-221 targets Bmf in hepatocellular carcinoma and correlates with tumor multifocality[J]. Clin Cancer Research, 2009, 15(16):5073-5081.
[10] Tang F, Hajkova P, Barton SC, et al.MicroRNA expression profiling of single whole embryonic stem cells[J]. Nucleic Acids Research, 2006, 34(2):e9.
[11] Lu Q, Lu C, Zhou GP, et al. MicroRNA-221 silencing predisposed human bladder cancer cells to undergo apoptosis induced by TRAIL[J] . Urol Oncol, 2009 , 18.
[12] Gillies JK, Lorimer IA. Regulation of p27Kip1 by miRNA 221/222 in glioblastoma[J].Cell Cycle,2007,6(16):2005-2009.
[13] Sun T, Wang Q, Balk S, et al. The role of microRNA-221 and microRNA-222 in androgen-independent prostate cancer cell lines[J]. Cancer Research, 2009,69(8):3356-3363.
[14] Felicetti F, Errico MC, Segnalini P, et al. The promyelocytic leukemia zinc finger-microRNA-221/-222 pathway controls melanoma progression through multiple oncogenic mechanisms[J]. Cancer Research, 2008, 68(8):2745-2754.
[15] Greither T, Grochola LF, Udelnow A, et al.Elevated expression of microRNAs 155, 203, 210 and 222 in pancreatic tumors is associated with poorer survival[J]. Cancer, 2010,126(1):73-80.
[16] Sun T, Yang M, Kantoff P,et al.Role of microRNA-221/-222 in cancer development and progression[J]. Cell Cycle,2009.8(15):2315-2316.
[17] Zhao JJ, Lin J, Yang H, et al. MicroRNA-221/222 negatively regulates estrogen receptor alpha and is associated with tamoxifen resistance in breast cancer[J]. Biol Chem,2008, 283(45):31079-31086.
[18] Miller TE,Ghoshal K, Ramaswamy B, et al.MicroRNA-221/222 confers tamoxifen resistance in breast cancer by targeting p27Kip1[J]. Biol Chem, 2008, 283(44):29897-29903.
[19] 廖荣霞, 孙建国, 张亮, 等. 乳腺癌miRNAs表达谱检测及初步分析[J].第三军医大学学报, 2006, 28(22):2209-2212.
[20] 张辉,苏式兵,周钱梅,等.乳腺癌细胞与乳腺上皮细胞MicroRNAs表达谱的差异性分析[J].癌症,2009,28(5):493-499.
