恶性疟原虫网状细胞结合蛋白同源体5 F1段的克隆、表达及初步鉴定*
2010-08-21郝文波邓小英廖小青罗树红
郝文波,李 宏,邓小英,廖小青,李 明,罗树红
恶性疟原虫网状细胞结合蛋白同源体5 F1段的克隆、表达及初步鉴定*
郝文波,李 宏,邓小英,廖小青,李 明,罗树红
目的克隆表达恶性疟原虫网状细胞结合蛋白同源体5(PfRh5)F1片段,并评价其抗原性。方法PCR扩增目的基因片段,克隆到表达载体pET28a(+)中,构建PfRh5F1/pET28a原核表达载体。IPTG诱导表达目的基因,SDS-PAGE电泳分析表达产物,并用Western Blot检测其抗原性。结果成功构建了PfRh5F1/pET28a原核表达系统,并在大肠杆菌中以包涵体形式高效表达,表达产物能被恶性疟原虫感染患者血清识别,而不能被间日疟原虫感染患者及正常人血清识别。结论恶性疟原虫PfRh5 F1段在大肠杆菌中获得高效表达且表达产物具有良好的抗原性。
恶性疟原虫;网状细胞结合蛋白同源体5;克隆;表达
恶性疟原虫网状细胞结合蛋白同源体 5(PfRh5)是恶性疟原虫(P f)PfRh家族的一个新成员,位于裂殖子顶端的棒状体内,最近研究发现该蛋白是参与Pf入侵的一个重要蛋白,可与红细胞上尚未识别的一个新的糖基化的受体结合〔1-2〕,而且该蛋白对虫体的生存具有关键作用〔3〕。本实验克隆表达了PfRh5蛋白的F1段(K31-F174),该片段预测与红细胞上受体结合相关,为进一步研究该蛋白在红细胞入侵中的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株 载体pET28a为Pharmacia产品、大肠杆菌宿主菌Rosetta为本室保存。
1.1.2 虫株与抗体 恶性疟原虫HCC1/HN株由本室保种;恶性疟原虫和间日疟原虫病人血清由云南省西双版纳傣族自治州疾病预防控制中心提供;H RP标记的羊抗人IgG抗体购自武汉博士德生物工程有限公司。
1.2.3 主要试剂 基因组DNA提取试剂盒、PCR产物纯化试剂盒、质粒快速提取试剂盒、琼脂糖凝胶电泳DNA纯化试剂盒、His-Ni-NTA亲和层析填料购自QIAGEN公司;限制性内切酶BamH I、Hind III,T4DNA连接酶为NEB产品;化学发光试剂盒(ECL)为美国Pierce公司产品;,其余试剂为国产分析纯。
1.2 方法
1.2.1 恶性疟原虫的培养 参考 T rager-Jensrn〔4〕等的方法,待原虫密度达到5%后离心收集含虫血。
1.2.2 恶性疟原虫基因组DNA的提取 按QIAGEN基因组DNA提取试剂盒说明书进行。
1.2.3 PCR扩增恶性疟原虫PfRh5基因F1片段根据恶性疟原虫(3D7株)PfRh5基因序列,设计并合成一对引物,F1P1:5'-ACGTCGGATCCAAAACGAAGAATCAA -3',F1P2:5'-CGAGCAAGCTTAAAATCCAAATGTCCTTC-3',并分别引入BamH I和Hind III酶切位点,由深圳华大基因科技股份有限公司合成。以恶性疟原虫染色体DNA为模板,PCR扩增目的基因。反应在50μ l体系中进行,循环参数为:95℃预变性3min,95℃变性 1min,52℃退火 45s,72℃延伸1min,30个循环后,72℃再延伸10min。扩增产物用1%琼脂糖凝胶电泳观察。
1.2.4 PfRh5F1/pET28a重组质粒的构建 PCR产物纯化后与质粒pET28a DNA分别用BamH I和Hind III双酶切,纯化酶切产物,在T4DNA连接酶作用下,16℃连接过夜。连接产物转化 Rosetta感受态细菌。
1.2.5 阳性重组质粒的筛选及鉴定 通过BamH I和Hind III双酶切及PCR筛选阳性重组克隆菌,送深圳华大基因科技股份有限公司进行测序分析。
1.2.6 重组载体的表达与纯化 将重组质粒PfRh5F1/pET28a转化入表达宿主菌 Rosetta中,IPTG诱导表达,收获菌体,SDS-PAGE电泳分析表达情况。收集的菌体经超声破菌、离心、变性、复性等过程处理后,过His-Ni-NTA亲和层析柱纯化。
1.2.7 Western blot分析重组蛋白的抗原性 重组蛋白纯化后进行10%SDS-PAGE凝胶电泳。电泳完毕后,将凝胶经半干转移仪(美国BIO-RAD公司)转移至PVDF膜,常规5%脱脂牛奶封闭过夜,分别以恶性疟原虫感染患者、间日疟原虫感染患者和正常人血清为一抗(1∶1 000),室温1h,PBS洗涤后加HRP标记的羊抗人二抗室温孵育2h,PBS漂洗后ECL显色。
2 结 果
2.1 PCR扩增产物 1%琼脂糖凝胶电泳观察PCR产物,可见在400bp和500bp之间有一DNA片段,与目的基因预期一致,见图1。
2.2 PfRh5F1/pET28a重组质粒的构建与鉴定从连接产物转化平板上挑取单菌落,提取质粒分别进行PCR及BamH I+Hind III双酶切鉴定,阳性重组克隆能扩增出429bp的目的片段(图2),用BamH I+Hind III双酶切后可产生5 300 bp及429bp两条带(图3),表明表达载体构建成功。将经酶切和PCR鉴定的阳性克隆菌,送深圳华大基因科技有限公司测序。测序结果与NCBI中由Gen-Bank提供的基因序列进行比对,碱基序列完全正确。
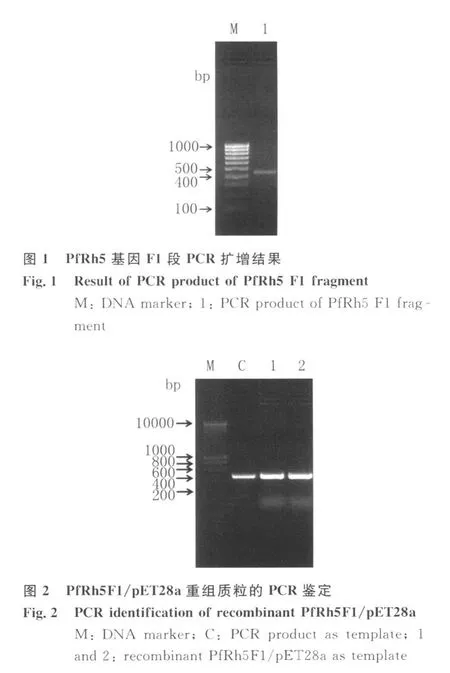
2.3 重组质粒的表达与纯化 将阳性克隆菌落及阴性对照同时进行诱导表达,收集菌体,常规处理后进行SDS-PAGE电泳检测,与空载体对照诱导表达结果相比,PfRh5F1/pET28a/Rosetta菌体在相对分子量约21.8kDa位置有的较强的表达条带出现。菌体经超声波破菌后,分别取上清和沉淀少许,常规处理样品并进行SDS-PAGE分析,发现目的蛋白主要出现在沉淀中,因此目的蛋白是以包涵体的形式表达(图 4)。包涵体经变性、复性处理后,过His-Ni-NTA亲和层析柱纯化,得到分子量约20kDa,纯度约90%的重组蛋白。
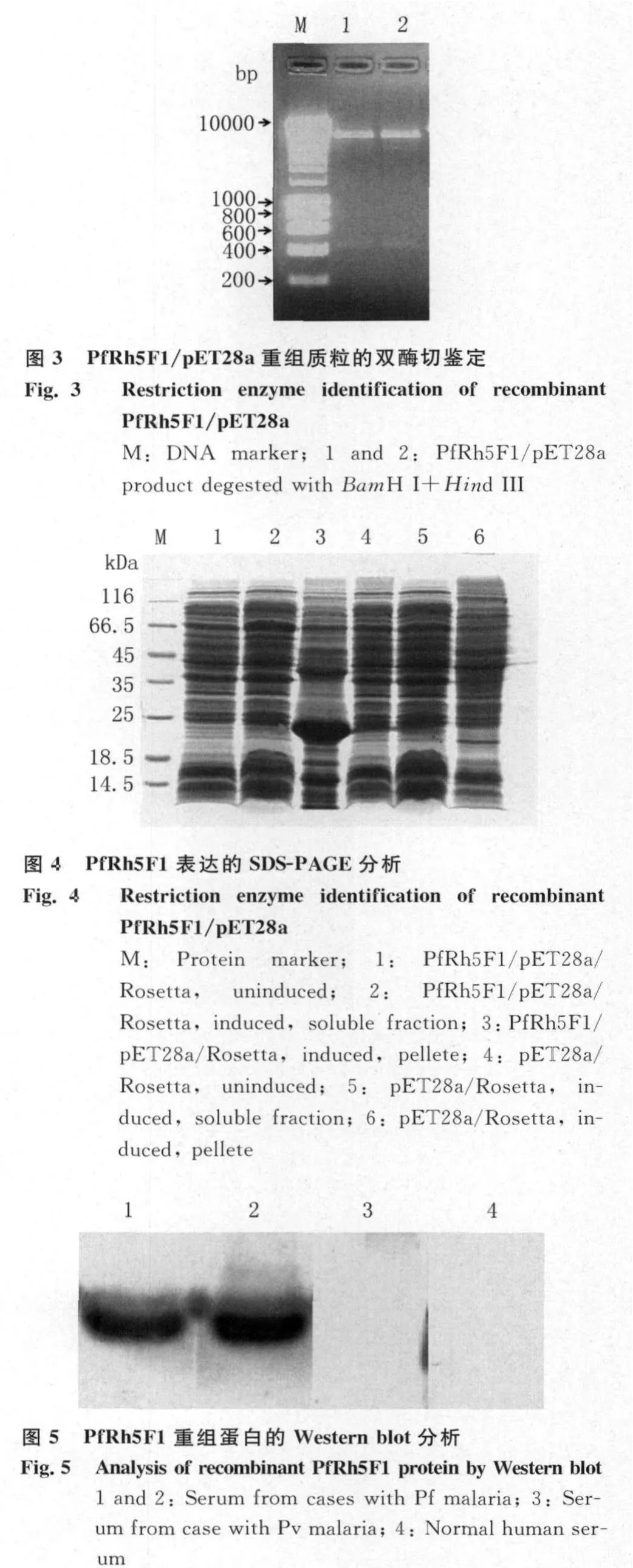
2.4 重组蛋白的抗原性分析 Western blot结果显示,纯化的重组表达蛋白能够被恶性疟原虫感染患者血清识别,而不被间日疟原虫感染患者及正常人血清识别,见图5。
3 讨 论
疟疾是一种严重危害人体健康的寄生虫病。目前,全世界范围内的疟疾发病率正在增高〔5〕。随着P f对多种抗疟药产生抗性,疟疾死亡病例逐渐增多,开发出新的有效的药物和疫苗已势在必行。
新药及疫苗的开发离不开对P.f致病机制的深入理解。裂殖子入侵红细胞是疟原虫在体内繁殖和对宿主致病的一个关键过程,阻断该过程是疟疾防治的一个重要策略〔6-7〕。PfRh5是最近发现的参与Pf入侵的一个重要蛋白,抗PfRh5抗体在体外具有抑制P f入侵的作用,重组PfRh5蛋白可以被疟原虫免疫血清及疟区暴露人群血清识别,提示P f裂殖子与红细胞之间存在一条新的入侵途径〔1,3〕。鉴定PfRh5与红细胞上的受体的相互作用,有助于我们更深入的理解Pf裂殖子的入侵机制,同时也可为研制P f红内期亚单位疫苗提供一个潜在的候选抗原。
本实验成功克隆、表达了恶性疟原虫PfRh5蛋白的F1段(K31-F174),该片段预测为PfRh5与受体结合的重要区域,表达产物主要以包涵体形式存在。包涵体经过变性、复性处理后,过His-Ni-NTA亲和层析柱纯化,获得了纯度较高的重组蛋白产物。通过Western blot分析重组蛋白的抗原性,结果重组蛋白能够与恶性疟原虫感染患者血清发生反应,而不与间日疟原虫感染患者和正常人血清反应,说明重组蛋白具有良好的抗原性,可能具有良好的生物学活性,这将为制备抗PfRh5蛋白的单克隆抗体及进一步研究该蛋白的功能奠定了基础。
〔1〕Rodriguez M,Lustigman S,Montero E,et al.PfRH5:a novel reticulocyte-binding family homolog ofPlasmodium falciparumthat binds to the erythrocyte,and an investigation of its receptor〔J〕.PLoS ONE,2008,3(10):e3300.
〔2〕Baum J,Chen L,Healer J,et al.Reticulocy te-binding protein homologue 5-an essential adhesion involved in invasion of human ery throcytes byPlasmodium f alciparum〔J〕.Int J Parasitol,2009,39(3):371-380.
〔3〕Hayton K,Gaur D,Liu A,et al.Erythrocy te binding protein PfRH5 polymorphisms determine species-specific pathways ofPlasmodium f alciparuminvasion〔J〕.Cell Host Microbe,2008,4(1):40-51.
〔4〕Trager W,Jensen JB.Human malaria parasites in continuous culture〔J〕.Science,1976,193(4254):673-675.
〔5〕Snow RW,Guerra CA,Noor AM,et al.T he global distribution of clinical episodes ofPlasmodium f alciparum malaria〔J〕.Nature,2005,434:214 217.
〔6〕Soldati D,Foth BJ,Cowman AF,et al.Molecular and functional aspects of parasite invasion〔J〕.T RENDS in Parasitology,2004,20(12):568.
〔7〕Cowman AF,Crabb BS.Invasion of red blood cells by malaria parasites〔J〕.Cell,2006,124:755-766.
Cloning,expression and identification of reticulocyte-binding protein homologue 5 F1 fragment inPlasmodium falciparum
HAO Wen-bo,LI Hong,DENG Xiao-ying,LIAO Xiao-qing,LI Ming,LUO Shu-hong
(Institute of Antibody Engineering,Schoolof Biotechnology,Southern Medical University,Guangzhou510515,China)
In order to clone and express reticulocyte-binding protein homologue 5(PfRh5)F1 fragment gene ofPlasmodium falciparum,the 429bp PfRh5 gene(91-519)was specifically amplified by polymerase chain reaction and cloned into pET28a(+)vector.The recombinant plasmid was then transformed and induced to express inE.coliRosetta.The expressed product was analyzed by SDS-PAGE and Western Blot respectively.And the expressed protein was insoluble with a size of about 21.9 kDa as predicted.Also,it exhibited a specific reaction with immune sera obtained from patients with Pf maleria.These results demonstrate that the PfRh5 F1 fragment has been successfully expressed and the expressed protein has certain antigenicity.
Plasmodium falciparum;reticulocyte-binding protein homologue 5;clone;expression
R382.3
A
1002-2694(2010)07-0624-03
*国家重点基础研究发展计划973专项(No.2007CB513101)和国家自然科学基金(No.30200238)联合资助
罗树红,Email:shluo815@yahoo.com
南方医科大学生物技术学院,广州 510515
2010-03-15;
2010-04-20
