CD55高表达在分离乳腺癌SP细胞中的作用研究
2010-08-21徐静娴刘冰阳森井英一青世克之贾心善张劲松
徐静娴,刘冰阳,森井英一,青世克之,贾心善,张劲松
(1.中国医科大学 附属第四医院眼科中心,眼科医院,辽宁省晶状体学重点实验室,沈阳 110005;2.中国医科大学 第93期临床医学7年制,沈阳 110001;3.大阪大学医学院病态病理教研室,日本 大阪 565-0871;4.中国医科大学 基础医学院病理学教研室,沈阳 110001)
癌干细胞是一小群具有在琼脂培养基中培养形成克隆,在体内移植分析中形成肿瘤的能力的细胞。癌干细胞最初发现于白血病[1]。近期研究发现,在长期培养的某些细胞株中也存在癌干细胞[2]。荧光染料Hoechst 33342对普通的癌细胞具有着色作用,但具有干细胞特性的癌细胞对该染料却具有排除能力,因此应用Hoechst 33342染色可分离癌干细胞。在荧光激活细胞分选分析中,带有较低水平Hoechst 33342染色的细胞被看作是具有癌干细胞特性的SP(side-population)细胞,相反,带有较高水平Hoechst 33342染色的细胞被看做是非SP细胞,即MP(main-population)细胞,不具有癌干细胞的特性。Kondo等[2]报告只有SP细胞既能生成SP细胞又能生成MP细胞,而MP细胞不具备这种能力。目前,利用SP细胞分选法来分离干细胞的方法已广泛应用于气管干细胞、肺癌干细胞的研究中[3]。
癌干细胞对凋亡具有抵抗性,但其机制目前尚不清楚。对癌干细胞进行抗凋亡能力分析困难的原因之一,就是分离癌干细胞时使用的Hoechst 33342染料具有能够诱导凋亡的毒性作用[4]。应用荧光激活细胞分选分离出来的SP细胞内包含的Hoechst 33342量比MP细胞低,SP细胞对凋亡的耐受性可能归因于Hoechst 33342的低含量,而非SP细胞本身的特性。因此,为了精确评估凋亡,SP细胞应使用不含有Hoechst 33342的系统进行分离。本研究以人类乳腺癌细胞株MCF7和MDA-MB-231为研究对象,应用Hoechst 33342染色及抗CD55抗体染色,分离出SP和MP细胞、CD55高表达(CD55hi)和CD55低表达(CD55lo)细胞,对比了2群细胞的特性,探讨了应用抗CD55抗体染色替代Hoechst 33342染色来分离乳腺癌SP细胞的可行性。
1 材料与方法
1.1 材料
人类乳腺癌细胞株MCF7和MDA-MB-231分别购自美国细胞中心(Rockville,美国)和日本科学研究资源库(HSRRB,日本)。培养于含10%胎牛血清(FCS)的 DMEM(Sigma,美国)培养基中。
1.2 方法
1.2.1 分选SP、MP细胞:采用Goodell等[5]分离SP细胞的方法,将细胞以1×106/ml的浓度加入2组培养基中∶第一组培养基中含Hoechst 33342 5 mg/ml,第二组培养基中除了5 mg/mlHoechst 33342外,另加入了戊酸丙胺(verapamil,50 mmol/ml)。37℃培养90 min后,收集细胞。应用含有三维激光的FACSVantage(Becton Dickinson公司,美国)进行分析,识别SP及MP细胞,分离并收集。
1.2.2 分选CD55hi、CD55lo细胞:将细胞以1×106/ml的浓度加入含2%FCS的PBS溶液中,再加入藻红蛋白(phycoerythrin,PE)标记的浓度为 5 ml/ml的抗CD55抗体(Immunotech公司,法国),避光染色30 min后,应用FACS Vantage SE分析,确定CD55hi与CD55lo细胞,分离并收集。
1.2.3 测定存活细胞比例:清洗细胞,用不含血清的DMEM悬浮,在96孔培养板中(5×103/孔)培养12或24 h后,行台盼蓝染色,通过随机计数5×102个细胞计算台盼蓝阴性细胞的比例。
1.2.4 体外克隆形成分析:用0.1 ml的含10%FCS的DMEM培养基悬浮清洗后的细胞,分别计数200个细胞,放入1 ml含15%FCS的DMEM的甲基纤维素培养基中培养14 d后,计数克隆形成的数目。
1.3 统计学分析
采用SPSS 13.0统计软件,数据均以±s表示,采用t检验进行统计学分析,P<0.01为差异有统计学意义。
2 结果
2.1 SP、MP细胞的分选
用Hoechst 33342染色并应用FACS-Vantage仪分析分选MCF7细胞,结果显示SP细胞占3.9%(图1A),在含有戊酸丙胺的溶液中,SP细胞比例明显降低(从3.9%降至0.03%)(图1B)。对分选后的SP和MP细胞再行抗CD55抗体染色,可见SP和MP细胞分别位于CD55hi和CD55lo区域(图1D)。

2.2 CD55hi、CD55lo细胞的分选
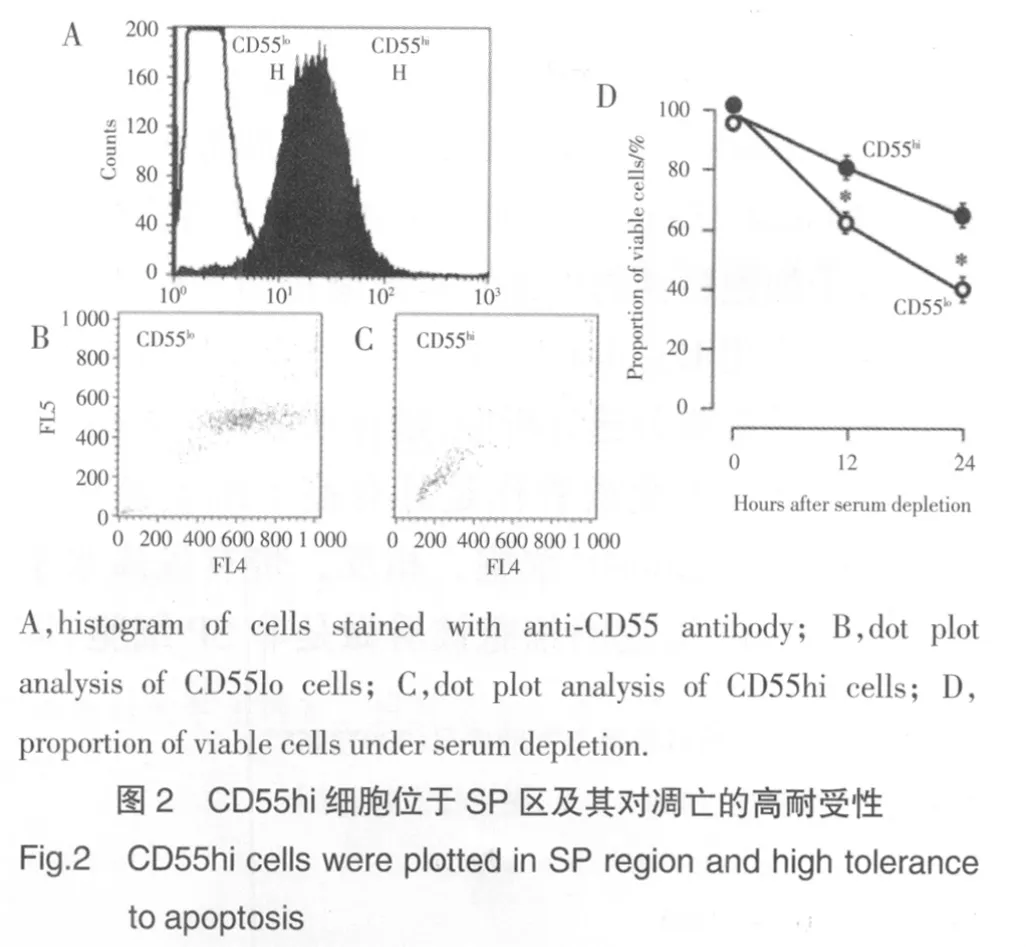
MCF7细胞用抗CD55抗体染色后被分别作为CD55hi和CD55lo细胞分选出来。CD55hi细胞的比例约占0.8%~1.3%。对分选出的CD55hi和CD55lo细胞行Hoechst 33342再染色,可见分别位于SP和MP区域中(图2A~C)。
2.3 血清缺失诱导凋亡分析
对MCF7细胞的SP和MP细胞进行分选、清洗后,用不含血清的试剂悬浮,测定到SP细胞中存活细胞的比例(12 h时为93%,24 h时为65%)比MP细胞中(12 h时为79%,24 h时为34%)高(图1C,P<0.01),表明在血清缺失的情况下,SP细胞比MP细胞存活时间长。同样,在血清缺失的情况下,甄选出的CD55hi细胞也比CD55lo细胞存活时间长(图2D)。
2.4 克隆形成能力分析
在含有15%FCS的含甲基纤维素的DMEM培养基中加入CD55hi和CD55lo细胞,CD55hi细胞所形成的克隆数(51.0±5.8)明显多于CD55lo细胞(5.3±2.3)(P<0.01)。
2.5 MDA-MB-231细胞株的检测结果
我们同时对乳腺癌细胞株MDA-MB-231也进行了SP、MP细胞及CD55hi、CD55lo细胞的分选及血清缺失诱导凋亡耐受性的分析,结果与MCF7细胞相似。
3 讨论
目前,适合SP细胞分离的表面标记还很有限。ATP结合转运蛋白G超家族成员2(ATP-binding cassette transporter G2,ABCG2)是骨髓 SP 细胞的标志,然而ABCG2敲除鼠并没有完全丧失乳腺SP细胞[6]。我们预测SP细胞一定能够表达某种表面分子,并起到保护细胞免受外源伤害刺激的作用。CD55可能就是这种合适的分子之一。CD55是一种补体调节蛋白,它能够防止补体因子在细胞表面的蓄积[7],在保护癌干细胞免受免疫系统攻击方面可能起重要作用。CD55的过度表达也是结肠癌愈后不良的可靠指征[8],在巨大淋巴瘤中,CD55的表达水平与肿瘤的大小及耐药性呈正相关[9],在SCID鼠中,CD55的表达敲除降低了前列腺癌细胞株的肿瘤起源性[10]。
本研究根据CD55的表达水平成功分离出了乳腺癌SP和MP细胞。实验结果表明,2种乳腺癌细胞株中SP细胞的CD55为高表达;分选的CD55hi和CD55lo细胞,再用Hoechst 33342染色时,分别位于SP和MP区域中;分选的SP和MP细胞,再用抗CD55抗体染色时,则分别位于CD55hi和CD55lo区域中;在血清缺失的情况下,CD55hi和CD55lo细胞分别显示了与SP和MP细胞相似的行为,即CD55hi细胞与SP细胞在体外同样显示出对血清缺失诱导凋亡的高耐受性;CD55hi细胞较CD55lo细胞在体外具有更强的克隆形成能力。综上所述,在乳腺癌中,CD55hi和CD55lo细胞分别可以代替SP和MP细胞,即应用细胞CD55高表达的特性可以替代Hoechst 33342染色来分离乳腺癌SP细胞。
本研究结果提示,CD55hi(SP)细胞比CD55lo(MP)细胞对凋亡刺激具有更高的抵抗性。因此,CD55可以推测为乳腺癌干细胞的一个表面标志,有可能成为针对癌干细胞治疗的一个新的靶点。进一步的研究(包括分离CD55hi细胞、评估其肿瘤起源性)将会更深入揭示在癌干细胞分离中CD55高表达的作用。
[1]Lessard J,Sauvageau G.Bmi-1 determined the proliferative capacity of normal and leukaemic stem cells [J].Nature,2003,423(6937):255-260.
[2]Kondo T,Setoguchi T,Taga T.Persistence of a small subpopulation of cancerstem-likecellsintheC6gliomacellline[J].ProcNatlAcad Sci USA,2004,101(3):781-786.
[3]Song N,Jia XS,Jia LL,et al.Expression and role of Oct3/4,Nanog,Sox2 in the regeneration of rat tracheal epithelium [J].Cell Prolif,2010,43(1):49-55.
[4]Zhang X,Chen J,Davis B,et al.Hoechst 33342 induces apoptosis in HL-60 cells and inhibits topoisomerase I in vivo[J].Arch Pathol Lab Med,1999,123(10):921-927.
[5]Goodell MA,Brose K,Paradis G,et al.Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo[J].J Exp Med,1996,183(4):1797-1806.
[6]Jonker JW,Freeman J,Bolscher E,et al.Contribution of the ABC transporters bcrp1 and mdr1a/1b to the side population phenotype in mammary gland and bone marrow of mice[J].Stem Cells,2005,23(8):1059-1065.
[7]Spendlove I,Ramage JM,Bradley R,et al.Complement decay accelerating factor (DAF)/CD55 in cancer[J].Cancer Immunol Immunother,2006,55(8):987-995.
[8]Durrant LG,Chapman MA,Buckley DJ,et al.Enhanced expression of the complement regulatory protein CD55 predicts a poor prognosis in colorectal cancer patients [J].Cancer Immunol Immunother,2003,52(10):638-642.
[9]Terui Y,Sakurai T,Mishima Y,et al.,Blockade of bulky lymphomaassociated CD55 expression by RNA interference overcomes resistance to complement-dependent cytotoxicity with rituximab[J].Cancer Sci,2006,97(1):72-79.
[10]Loberg RD,Day LL,Dunn R,et al.Inhibition of decay-accelerating factor(CD55)attenuates prostate cancer growth and survival in vivo[J].Neoplasia,2006,8(1):69-78.
