野西瓜挥发油对人胃癌 SGC-7901细胞的抑制
2010-08-17季宇彬
凌 娜,于 蕾,邹 翔,季宇彬
(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨 150076;2.抗肿瘤天然药物教育部工程研究中心,哈尔滨 150076)
野西瓜(Capparis spinosa,CS)为白花菜科山柑仔属植物,又称老鼠瓜、刺山柑、瓜儿菜、槌果藤,维语称“波里克果”或“卡盘”,是荒漠、半荒漠、干旱、半干旱地区极有栽培价值的抗旱植物[1].主要分布于欧洲、北美、大洋洲、亚洲西部,我国新疆、甘肃、内蒙古、西藏等省区.我国民间常用刺山柑医治风湿性关节炎,具有镇痛、消炎、抗凝血的功效[2].野西瓜的药用部位为叶、果和根皮.其果实所含挥发油的化学成分已有报道,通过 GC-MS法对化学成分进行鉴定,共分离出 57个峰,确定了其中 53种化合物[3].但对野西瓜挥发油诱导肿瘤细胞凋亡的机制报道较少.本研究通过 MTT、SRB、克隆形成能力实验及 Annexin V/PI双染体外试验来观察野西瓜挥发油对人胃癌 SGC-7901细胞的生长抑制作用,并探讨其作用机制.
1 实验材料
1.1 药品及试剂
野西瓜挥发油由哈尔滨商业大学药物研究所提供.RPMI-1640干粉(美国 GIBCO公司)、胎牛血清(杭州四季青),胰蛋白酶、二甲基亚砜(DMSO)、碘化丙啶 (PI)、MTT、磺酰罗丹明 B(Sulforhodamine B,SRB)均为 Sigma公司产品,Annexin V细胞凋亡试剂盒(美国 Biovison公司),阿霉素(浙江海正药业股份有限公司).
1.2 肿瘤细胞系
人胃癌细胞株 SGC-7901,由哈尔滨商业大学药物研究所提供,于 RPMI 1640培养液中加入10%的胎牛血清,青霉素 100 u/mL,链霉素 100 mg/L,置 37℃、5%CO2孵箱中培养,3~4 d传代 1次.
1.3 仪器和设备
CO2培养箱(美国 NBS公司),酶标仪(美国Bio-Rad公司),倒置显微镜(日本 OLYMPUS公司),激光共聚焦显微镜(德国 Leica TCSNT),超净工作台(苏州净化设备厂),电子分析天平(Sartorius),TDL80-2B低速离心机(上海安亭科学仪器厂).
2 实验方法
2.1 MTT法检测野西瓜挥发油对 SGC-7901细胞的抑制作用
取处于对数生长期的 SGC-7901细胞,消化后悬浮在一定量的培养液中,计数后调整细胞浓度为 5 ×104个/m L,接种于 96孔板,每孔 100μL,置37℃,CO2体积分数为 5%的饱和湿度条件下培养.待 24 h细胞完全贴壁后,试验组加入挥发油至终质量浓度为 10、50、100、150、200 μg/mL;阳性对照组阿霉素的质量浓度为 0.01、0.1、1、10μg/m L;空白对照组加相同体积的培养液,每个剂量设 6个平行样,继续培养 72 h后,弃去上清液后,每孔加入 MTT染液 100μL(0.5 mg/m L),继续培养 4 h,弃上清每孔加入DMSO 200μL震荡5~10min后,使用酶标仪检测 570 nm处吸光度,并按中效方程计算IC50
抑制率(%)=(1-试验孔平均 OD值 /对照孔平均 OD值)×100%
2.2 SRB法检测野西瓜挥发油对 SGC-7901细胞的抑制作用
将对数生长期的 SGC-7901细胞用胰酶消化后调成细胞浓度为 3×104/mL的细胞液,每孔 100 μL接种于 96孔板.培养 24 h后加入野西瓜挥发油至终质量浓度为 10、50、100、150、200和 300μg/mL,阳性对照组阿霉素的质量浓度为 0.01、0.1、1、10μg/m L;空白对照组加相同体积的培养液,每个剂量设 6个平行样,同时测定此时细胞的 OD515值(T0).72 h后弃上清,加 50%的冷三氯乙酸(TCA)液,置 4℃冰箱中固定 1 h,倒掉固定液,用去离子水洗 5遍,干燥后加 4mg/mL SRB染液,室温放置30m in;倒掉染液用 1%醋酸洗 5遍,过夜干燥,加浓度为 10mmol/L的 Tris缓冲液 150μL,10 min后测定波长为 515 nmOD值.用如下公式计算药物对肿瘤细胞的抑制率,并按中效方程计算 IC50.计算细胞 50%生长抑制所需的药物质量浓度(GI50);细胞完全生长抑制所需的质量浓度(TGI);杀死 50%细胞所需的药物质量浓度(LC50)[4].
生长率%=[(T-T0)/(C-T0)]×100%细胞杀死率%=[(T-T0)/T0]×100%
其中:GI50为[(T-T0)/(C-T0)]=50%时的药物质量浓度;TGI为 T=T0时的药物质量浓度;LC50为[(T-T0)/T0]=-50%时的药物质量浓度.C表示对照组细胞的 OD值;T表示加药组细胞的OD值;T0表示加药时对照平板细胞的 OD值.
2.3 克隆原形成试验测定野西瓜挥发油对肿瘤细胞克隆原形成的影响
取对数生长期细胞,配制成单细胞悬液,计数后调整细胞浓度为 50~100个/m L,按 2 mL/孔将单细胞悬液接种于 6孔板内,培养 24 h后,加不同质量浓度的野西瓜挥发油,终质量浓度分别为 50、100、150、200、300 μg/m L,空白对照组和给药组均各设 3个平行孔,野西瓜挥发油持续作用 14 d后,弃培养基,每孔用 PBS洗 2次,2 m L/次;无水甲醇固定 5 min,静置干燥;1%结晶紫 2 m L染色 5~10 min后,用自来水冲洗掉多余的染料,室温干燥;计数每孔大于 50个细胞的集落,根据下述公式计算各给药组集落形成率,按照中效方程计算 IC50值:

2.4 Annexin V-FITC/PI双标记法检测细胞早期凋亡
将对数生长期的 SGC-7901细胞,用胰酶消化后调成细胞浓度为 3×105/m L的细胞液,每孔1m L接种于 6孔板中.培养 24 h后加入野西瓜挥发油至终浓度为 50、100、150、200和 300μg/mL,阳性对照组阿霉素质量浓度为 5μg/mL;空白对照组加相同体积的培养液.24 h后收集细胞,冷 PBS洗细胞 2次,细胞数 1×105~5×105个/m L.将细胞重悬于 500μL的 1×Binding Buffer,然后加入 5 μL Annexin V-FITC和 10μL PI染色液,室温避光孵育 5min;离心去上清,PBS洗 1次,最后将细胞重悬于 1 m L PBS,用激光共聚焦显微镜进行检测并拍照.同时以不加 Annexin V-FITC及 PI的细胞作为阴性对照[5].
2.5 实验数据处理
应用 SPSS11.5软件对数据进行统计学处理,结果以±S表示,组间比较采用方差检验.
3 实验结果
3.1 MTT法检测野西瓜挥发油对 SGC-7901的细胞毒作用
实验结果表明:质量浓度为 50~300μg/m L野西瓜挥发油对 SGC-7901细胞的生长具有一定的抑制作用,与空白组比较差异有显著性,并且随着浓度增加,抑制率逐渐增加,即具有剂量依赖关系,经直线回归计算出野西瓜挥发油对 SGC-7901的 IC50为 145.5 μg/mL(见表1).
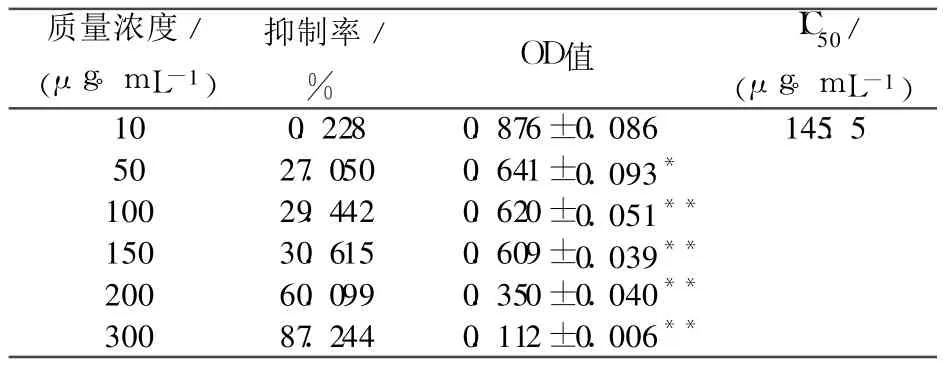
表1 野西瓜挥发油对SGC-7901细胞增殖的影响(MTT)
3.2 SRB法检测野西瓜挥发油对 SGC-7901肿瘤细胞增殖的影响
SRB是一种蛋白质结合染料,粉红色,可溶于水.此实验方法的原理是 SRB可与生物大分子中的碱性氨基酸结合,在 515 nm的 OD读数与细胞数呈良好的线性关系,故可用作细胞数的定量.用该方法观察了野西瓜挥发油对体外培养的 SGC-7901细胞增殖的影响,结果如表2.

表2 野西瓜挥发油对SGC-7901细胞增殖的影响(SRB)
3.3 野西瓜挥发油对 SGC-7901肿瘤细胞克隆原集落形成的影响
克隆原细胞(Clonogenic cell)是指具有分裂能力的细胞.当单个细胞连续分裂 6代或 6代以上时,其后代所组成的集落便含 50个以上细胞.通过集落计数可对克隆原细胞做定量分析,它反映出单个细胞的增殖潜力.集落形成实验结果显示,野西瓜挥发油在浓度为 50μg/mL时,SGC-7901细胞集落形成率为 78.76%,并且随着质量浓度的升高克隆原形成率逐渐降低,野西瓜挥发油对 SGC-7901细胞集落形成的 IC50为 160.04μg/mL.提示:野西瓜挥发油明显抑制了 SGC-7901细胞分裂和集落形成能力,并具有一定的质量浓度依赖性(见图1).
3.4 Annexin V-FITC/PI双标记法检测细胞早期凋亡
应用 Annexin V联合 PI双染色,激光共聚焦扫描显微镜观察,正常活细胞 Annexin V和 PI均为低染;细胞凋亡早期的细胞膜完整,Annexin V高染,细胞膜呈绿色荧光,PI低染,细胞核不着色;凋亡中、晚期细胞则 Annexin V和 PI均高染,细胞膜呈绿色荧光,细胞核呈红色荧光.
实验结果可见,经过不同剂量野西瓜挥发油作用 24 h的 SGC-7901细胞中,出现凋亡早、中、晚期的 SGC-7901细胞,部分细胞的细胞核呈大小不等、形态不规则的碎片状或梅花状,为典型的细胞凋亡形态.对照组的 SGC-7901细胞 Annexin V和 PI均低染,未见凋亡形态的细胞(图2).
4 讨 论
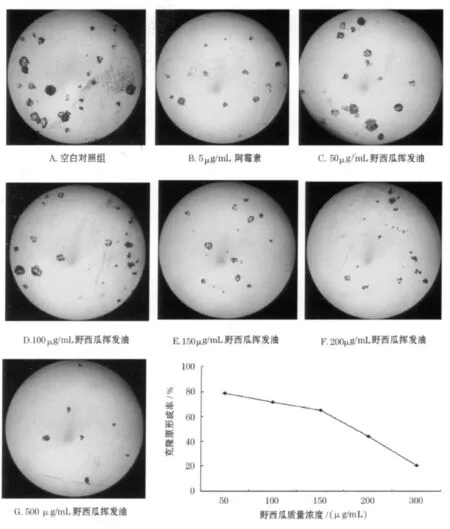
图1 野西瓜挥发油对SGC-7901细胞克隆原集落形成的影响
细胞凋亡(apoptosis)是指在生理或病理状态下,细胞启动自身基因调控机制而发生的有序的、主动的自然死亡过程,是正常细胞维持群体数量稳定,清除转化细胞,防止癌变所必需的生命活动之一.它的异常与许多疾病尤其是肿瘤的发生发展有关.
细胞凋亡的早期事件之一是:细胞膜表面的磷脂酰丝氨酸(Phosphatidyl serine,PS)从细胞膜内转移到细胞膜外.目前应用 Annexin V联合 PI双染色法是检测细胞凋亡较为理想的方法之一[6].PS位于正常细胞膜的内侧,但在细胞凋亡的早期,PS可从细胞膜的内侧翻转到细胞膜的表面,暴露在细胞外环境中,Annexin V是一种分子质量为 35~36 ku的钙依赖性磷脂结合蛋白,能与 PS高亲和力特异性结合,它可以作为探针检测暴露在细胞膜表面的 PS.碘化丙啶(Propidium Iodide,PI)是一种核酸染料,不能透过完整的细胞膜,但在凋亡中、晚期的细胞和死细胞中,PI能够透过细胞膜而使细胞核红染.将 Annexin V标记上异硫氰酸荧光素(FITC),同时结合使用 PI拒染法进行凋亡细胞双染后利用荧光显微镜检测细胞凋亡[7].该方法可将凋亡早、中、晚期的细胞以及死细胞区分开来:正常活细胞 Annexin V和 PI均低染,不着色;凋亡细胞的早期,Annexin V高染,细胞膜呈绿色荧光,PI低染,细胞核不着色;凋亡中、晚期细胞则 Annexin V和 PI均高染,细胞膜呈绿色荧光,细胞核呈红色荧光.与传统方法比较,Annexin V联合 PI双染色法检测凋亡细胞不需要固定,灵敏性、特异性高,结果更为可靠.其最大特点是检测细胞膜尚未破裂的早期凋亡细胞,并可区别不同的细胞群体,以观察这些细胞群中有无细胞凋亡过程.

图2 FITC-Annexin V/PI双染检测野西瓜挥发油对 SGC-7901细胞凋亡的影响
本实验以野西瓜挥发油作用于 SGC-7901细胞,通过 MTT法验证野西瓜挥发油对 SGC-7901细胞的生长有抑制作用,且具有剂量依赖关系,72 h的 IC50为 145.5μg/m L,同对照组相比差异显著(P<0.01).SRB结果显示低浓度的野西瓜挥发油通过抑制肿瘤细胞生长而起抗癌作用,其 GI50约为121.37μg/mL,当质量浓度达到 240.55μg/m L时细胞生长受到完全抑制,随着质量浓度继续增加至900.96μg/mL时有一半数量的细胞被杀死.采用Annexin V/PI双染染色法,激光共聚焦扫描显微镜检测到 SGC-7901细胞形态的变化.经过不同剂量的野西瓜挥发油作用 24 h的 SGC-7901细胞,出现凋亡早、中、晚期的细胞形态.研究还发现野西瓜挥发油可诱导 SGC-7901细胞凋亡,使肿瘤细胞内 Ca2+浓度升高,并降低细胞线粒体膜电位,且发生 S期周期阻滞[8-9].进一步说明了野西瓜挥发油通过启动线粒体途径诱导 SGC-7901细胞凋亡,进而抑制 SGC-7901细胞的生长.
[1] 张立运,杨 春.保护风蚀地的刺山柑[J].植物杂志,2004,1:3-4.
[2] 李学明,周淑芬,张顺礼.槌果藤的药理研究[J].新疆中医药,1986,2:32-35.
[3] 白宏进,赵小亮,刘文杰.刺山柑果实挥发油化学成分的研究[J].安徽农业科学,2007,35(9):2517-2518.
[4] SUN L Y,SHAO S H.Effects of Na2SeO3Detected by SRB Method on the Growth of SGC-7901 Cells[J].JBeihua Uni(Natural Science),2004,5(2):122-123.
[5] BERNAS T,ASEM E K,ROBINSON JP,et al.Confocal fluorescence imaging of photosensitized DNA denaturation in cell nuclei[J].Photochem Photobiol,2005,81(4):960-969.
[6] SGONC R,GRUBER J.Apoptosis detection:an overview[J].Experimental Gerontology,1998,33(6):525-533.
[7] 谭晓华,张亚历,周殿元,等.细胞凋亡的方法学研究进展[J].肿瘤,1997,17(5):288-291.
[8] 王 崴,于 蕾,崔荣田,等.野西瓜挥发油诱导SGC-7901凋亡的初步研究[J].哈尔滨商业大学学报:自然科学版,2008,24(4):369-399.
[9] 凌 娜,季宇彬,于 蕾,等.野西瓜挥发油抑制人肝癌HepG-2细胞增殖作用[J].哈尔滨商业大学学报:自然科学版,2010,26(3):257-260,264.
