猪源乳酸菌的分离、筛选、鉴定及产酸性能的研究
2010-08-09郭志杰张德晓王晓翠
郭志杰 李 杰 李 鑫 张德晓 王晓翠
乳酸菌在替代腹泻、促生长、抗生素等综合方面一定程度上起到良好的作用,被人们认为是理想绿色添加剂。人们根据乳酸菌生理功能,将其应用到仔猪腹泻的防治上,起到了显著降低腹泻率,促生长的效果,提高了养猪的经济效益[1]。理想的益生素菌种最好来自同源动物的肠道。Timmerman等(2006)研究表明,同源性乳酸菌对宿主的益生作用优于异源菌株[2]。由于动物种类和环境的不同定植肠道的种类和数量相差很大,定植的能力也不尽相同,相应在粪便里也不尽相同[3]。然而得到并筛选出同源且抗逆性强的菌株尤为重要。故分离并筛选耐受性和抑菌效果良好的菌株为研究仔猪防腹泻、促增长的微生态制剂提供依据。
1 材料与方法
1.1 试验材料与设备
1.1.1 病原指示菌
大肠杆菌和沙门氏菌均由东北农业大学动物医学院赠送。
1.1.2 培养基
MRS液体和固体培养基、营养肉汤、LB培养基。
1.1.3 生化鉴定试剂
5%过氧化氢(v/v)、奈示试剂、PY基础培养液、柠檬酸铁氨、v-p试剂、明胶、细菌微量生化反应管。
1.2 试验方法
1.2.1 菌株分离与命名
取28日龄新鲜断奶仔猪粪便0.5 g置于4.5 ml灭菌生理盐水中,摇匀。进行梯度稀释,稀释至第7个梯度,吸取 10-5、10-6、10-7梯度稀释液 200 μl于固体MRS培养基平板上均匀涂布。将上述平板置于37 ℃恒温培养箱(5%CO2)培养 48 h,挑去健壮、活性高的单菌落30株。反复划线纯化到获得纯菌株为止。
进行革兰氏染色、镜检。选择革兰氏阳性菌且无芽孢的菌株为后备菌株。将菌液与灭菌甘油按1:1混合置于-20℃冰箱进行菌种保藏。
菌株的命名:以“乳酸菌”首字母与分离出菌株的顺序来命名。如分离出的第1株乳酸菌命名为R1,分离出第8株则为R8。
方干又有七律诗《题龙泉寺绝顶》和《再题龙泉寺上方》。据嘉泰《会稽志》:“(龙泉寺)东晋咸康二年建。唐会昌五年废,大中五年重建。咸通二年改今额。”[10]卷八因而可以据此判断在咸通二年(861)方干52岁之后至少曾经两次造访会稽龙泉寺并且留下诗篇。
1.2.2 耐酸试验
将上述保藏菌株按5%(v/v)接种量接种,活化2到3代以保证菌株高活性,活化培养时间为24 h。
将最后1次活化好的菌液按5%(v/v)接种量接入pH值2.5的MRS液体培养基,同时接入不加酸MRS液体培养基作为对照,2 h后,分别吸取酸处理和对照组菌液200 μl进行涂板,培养48 h后进行平皿菌落计数。计算酸处理过的存活率 A(%)=X1/X0×100,式中:A为酸处理后的存活率;X1为处理2 h后每毫升的活菌数(CFU);X0为对照组2 h后每毫升的活菌数(CFU)。
1.2.3 耐胆盐试验
在液体MRS加0.3%(m/v)猪胆盐摇匀,方法同上述耐酸试验。计算胆盐处理过的存活率B(%)=Y1/Y0×100。式中:B为胆盐处理后的存活率;Y1为胆盐处理2 h后每毫升的活菌数(CHU);Y0为对照组2 h后每毫升的活菌数(CFU)。
1.2.4 抑菌试验
大肠杆菌、沙门氏菌按5%(v/v)接种量接入LB培养基进行培养,37℃恒温培养箱培养24 h,涂板查数后调节原菌液107CFU/ml,同样方法调节乳酸菌菌液浓度108CFU/ml。采用牛津杯法,吸取200 μl致病菌在营养琼脂涂板,分别制成大肠杆菌板和沙门氏菌板,无菌条件下将牛津杯放在平板上然后吸取200 μl乳酸菌发酵液于杯中,每个菌株做3个重复,平放37℃恒温培养箱培养24 h,测其抑菌直径,每个抑菌圈测3个直径,取其平均值。
目的菌株进行产酸验证。把每株菌都活化2次以达到高的活性,按5%(v/v)接种量接入100 ml的三角瓶中。每株菌做3个重复,即每株菌测得3个pH值,求其平均值。
1.2.6 鉴定试验
首先通过菌落形态特征与显微镜(10×100)观察可初步判定球或杆状。再通过过氧化氢试验、硝酸还原试验、明胶液化试验、吲哚试验、硫化氢试验、pH值 9.2和 pH值 9.6生长试验、4%NaCI、16.5%NaCI生长试验、细胞运动性(半固体穿刺)试验,做出关于杆菌与球菌属的进一步鉴别。再通过精氨酸产氨试验和各类糖发酵试验结果与《乳酸细菌的分类鉴定与试验方法》和《常见细菌系统鉴定手册》对照进行种的鉴定。
2 结果与分析
2.1 菌株的分离
试验从新鲜断奶仔猪粪便中分离出30株无芽孢乳酸杆菌,且30株都是革兰氏阳性。其在MRS固体培养基上菌落形态也各异,多呈白色或乳白色还有呈半透明状,表面大多光滑较多中央有隆起现象,边缘大多整齐也有放射粗糙型。
2.2 耐酸试验
通过pH值2.5处理后存活率见表1。由表1可知,R9、R11、R12、R14、R15、R18、R23表现出较强的耐受性,酸处理2 h后存活率仍达到30%以上;R3、R21、R22对酸也有一定的耐受性,存活率超过20%;而R25、R30此条件下较为敏感,存活分别为10.0%、10.2%;其余菌株则受到强烈的抑制。最终以存活率10%为界限,选定R3、R9、R11等13株菌进行下一步的筛选。

表1 pH值2.5条件下30株乳酸菌存活率
2.3 耐胆盐试验
通过0.3%胆盐浓度后存活率见表2。由表2可知,R11、R14、R15、R18、R22都表现出较强的耐受性;R3、R30也有一定的耐受性,其余菌株则受到强烈的抑制。最终以存活率10%为界限,选定R3、R11等7株菌进行下一步的筛选。

表2 9株菌在0.3%胆盐浓度存活率
2.4 抑菌试验
大肠杆菌、沙门氏菌病原菌抑菌直径见表3。由表3 可知,R11、R15、R18、R224 株菌对大肠杆菌、沙门氏菌都有较强的抑菌作用,R14处于过渡期,R3、R30抑菌能力较弱,以18 mm为界,R18在抑制沙门氏菌时没有达到18 mm,但在繁殖以及在其它耐性方面都有强的作用,故保留其菌株。选出 R11、R15、R18、R22为筛选目的菌种。
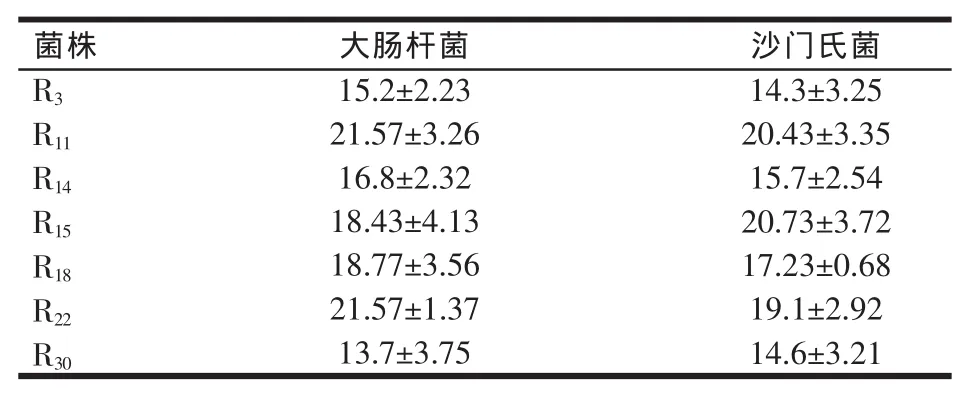
表3 对指示菌抑菌直径测定(mm)
2.5 产酸试验
4株菌产酸能力见表4,由表4可知,4株菌产酸能力都很强,且3次重复测定pH值的变化都很小。只有R18的pH值超过4.00,虽超4.00但其产酸能力仍很强。其中R11产酸能力最强,pH值达3.83。

表4 分离菌产酸试验结果
2.6 鉴定试验
对4株菌首先进行属的鉴定。通过菌落形态、镜检与进一步通过生化鉴定不发生过氧化氢试验、不能硝酸还原、不能明胶液化、不能产生吲哚、不能产生硫化氢可初步判定R18、R22为乳酸杆菌属。通过镜检观察菌的排列状态与进一步的生理生化鉴定:发酵葡糖糖产酸不产气,在15和45℃条件下可以生长,生长于6.5%NaCI与pH值9.6的环境可初步判定R11、R15是肠球菌属。

表5 2株乳杆菌种鉴定结果
对4株菌再进行种的鉴定。通过表5与《乳酸细菌的分类鉴定与试验方法》对照可知,R18除了在利用核糖与鉴定特征有差别外,其余与嗜酸乳杆菌相符;R22除了利用棉籽糖与鉴定特征有差别外,其余与口乳杆菌相符。通过表6与《乳酸细菌的分类鉴定与试验方法》对照可知,R11为屎肠球菌、R15为鸡肠球菌。
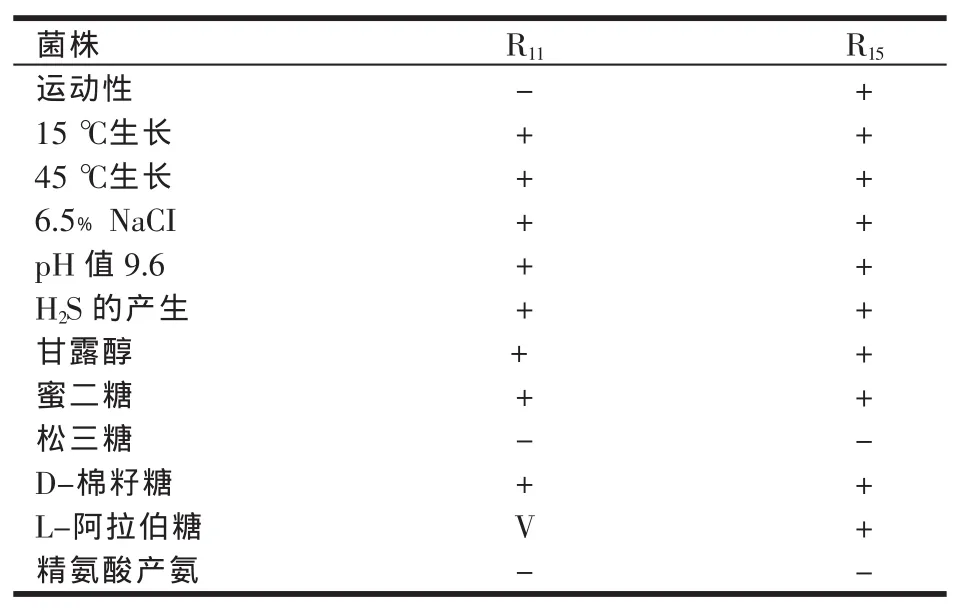
表6 2株乳球菌种鉴定结果
3 讨论
3.1 菌株的分离
根据微生态学原理从肠道或粪便中分离乳酸菌应用于生产被认为是一种可行的方法[4]。分离菌株的同源性很重要,有报道认为,正常菌群在动物体内的定植是通过粘附来完成的,从某一类动物分离到的乳酸菌只对这类动物的消化道上皮表现出较强的粘附性,对其它动物不粘附或低粘附,而这种粘附性是关系到微生物添加剂作用效果的关键问题[5]。许多从鸡上分离的乳酸菌只对鸡小肠粘膜上皮细胞有粘附力,而对大鼠和猪等则没有粘附力,同样从大猪上分离的乳酸杆菌对小猪的肠粘膜上皮细胞粘附力较差[6]。益生菌菌株定植的宿主特异性直接影响到益生素制剂的应用效果,因而菌种的分离选择必须注意到宿主特异性问题[7]。粪便里的活菌经过胃肠道已经经过逆性环境的筛选为以后的体外筛选打下基础。
试验采用MRS琼脂作分离乳酸菌用培养基,它含有较高浓度的乙酸盐离子并有刺激因子吐温-80,可抑制其它许多微生物生长,起到选择的作用[8]。试验不是在纯厌氧条件下进行,而是采用5%二氧化碳浓度培养,目的是得到对环境要求比较低,易分离、培养、保存的兼性厌氧菌,便于实际生产的应用。
3.2 酸耐受性
幼龄动物胃内的pH值一般在3~4左右,小肠内pH值为4~5,大肠内pH值高达5.0以上[9]。乳杆菌要进入仔猪消化道起作用,首先应该能够耐受较低pH值的酸性环境,因为初生仔猪胃内pH值为5.0,几小时后降为3.0~4.0,5周龄时pH值为2~3.0,其后相对稳定。这种酸度对许多乳杆菌来说都是不耐受的,从外界进入的乳酸杆菌必须经过胃的酸性环境,保持足够的活菌数才能起作用,在本试验中将耐酸性作为乳酸杆菌筛选的首要指标,既减少后期工作量,又保证筛选菌株能顺利通过酸性胃环境,进入肠道发挥功能。
3.3 胆盐耐受性
有研究表明,由肝脏分泌到十二指肠的高浓度的胆盐具有抗菌活性,它对细胞膜有很强的破坏力,它的疏水作用可导致膜蛋白离解和细胞膜破裂[10]。故益生菌要顺利进入动物肠道,除具有可耐受胃中低pH值的能力外,还需具备耐受小肠中胆汁等形成的高渗透压环境的能力。小肠中胆汁盐含量在0.03%~0.3%之间波动[11],故采用0.3%胆盐作为筛选耐受肠道内胆盐的指标。通过耐酸与耐胆盐试验可知,胆盐是比胃酸对乳杆菌更不利的因素,这与赵瑞香等[12]的报道一致。
3.4 抑菌试验
乳酸菌代谢产物抑制大肠杆菌和沙门氏菌的效果以抑菌圈的大小为指标。牛津杯中的抗菌物质能透过琼脂来抑制大肠杆菌和沙门氏菌,离牛津杯越远,能渗透过去的抗菌物质的浓度就越小,所以抑菌圈越大,说明效果越好。7株乳杆菌对大肠杆菌和沙门氏菌的抑菌圈从13~21 mm不等。作为益生菌的乳酸菌菌株在体外应具有很好的抑菌作用,故以18 mm大小的抑菌圈为标准[13]。乳酸菌代谢产生的酸、细菌素、过氧化氢等物质对病原菌起到抑制或杀灭的作用。国内外的研究报道表明,不同的乳杆菌菌株起抑菌作用的主要物质不尽相同,有的主要是酸,有的主要是细菌素,有些是这些物质的共同作用。与Vandenbergh报道的乳杆菌主要是通过代谢产生的乙酸、乳酸等抑制细菌生长的结果一致[14]。
3.5 产酸试验
乳酸菌产酸功能是一个很重要的指标,酸可使胃内蛋白酶原激活,同时酸具有强的杀菌作用,筛选出的菌都可以分泌出低的pH值。
3.6 鉴定试验
对菌进行有效、准确鉴定是开发和利用他们的前提条件。目前乳酸菌的分类鉴定方法很多,主要包括常规鉴定法、快速鉴定法以及分子生物学鉴定方法。而经典鉴定法即生理生化鉴定是常规鉴定法的主要组成部分,同时也是大多数实验室进行常规菌种鉴定应用最多的方法。各种细菌所具有的霉系统不尽相同,对营养基质分解能力也不一样,因而代谢产物或多或少各有区别,可供鉴别细菌用。
4 小结
R11、R15、R18、R22对酸、胆盐、抑菌及产酸性能的综合能力较好。在pH值2.5作用后存活率分别为32.1%、61.2%、32.5%、29.2%;在含0.3%猪胆盐MRS液体培养基中培养2 h后存活率依次为40.1%、20.2%、22.1%、30.1%;且此4株菌株抑菌与产酸能力也较强;通过鉴定可知,R11为屎肠球菌、R15为鸡肠球菌、R18嗜酸乳杆菌、R22为口乳杆菌。
[1]杨菲菲,麻丽坤,王增敏,等.断奶仔猪饲料中乳酸菌的应用[J].上海畜牧兽医通讯,2006(5):60-61.
[2]Timmerman H M,Veldman A,E van de Elsen,et al.Mortality and growth performance of broilers given drinking water supplemented with chicken-specific probiotics[J].Poultry Science,2006,85:1383-1388.
[3]Chiquette.The role of probiotics in promoting dairy production[J].advances in diary technology,2009,21:143-157.
[4]舒会友.猪源乳酸菌益生素的研制及其应用 [D].湖南农业大学,2005.
[5]Frank.T Jones.Use of direeted mierobials not new way they work still not clear[J].Feed stuffs,1991:63:31-33.
[6]黄沧海,谯仕彦,李德发,等.仔猪专用益生乳酸杆菌菌种的分离[J].饲料工业,2004,25(10)25-27.
[7]赵瑞香,李元瑞,孙俊良,等.嗜酸乳杆菌在模拟胃肠环境中抗性的研究[J].微生物学报,2002,29(3):234-238.
[8]林朝洪.猪源益生乳杆菌的分离、鉴定和筛选及ERIC-PCR分型研究[D].四川农业大学,2007.
[9]田召芳.抑菌性乳酸杆菌的筛选、应用及生物学特性研究[D].泰安:山东农业大学,2003:6-8.
[10]De Boever P,Verstraete W.Bile salt deconjugation by Lactobacillus Plantarum 80 and its implication for bacterial toxicity[J].J.Appl.Microbiol.,1999,87(3):345-352.
[11]王玉华,张桂荣,刘景圣.2株耐酸及耐胆盐嗜酸乳杆菌的分离筛选及其发酵特性研究[J]东北师大学报,2006,38(3):15-118.
[12]赵瑞香,李元瑞,郭洋.嗜酸乳杆菌抑菌特性的研究[J].中国微生态学杂志,2001,13(6):318-319.
[13]唐晓丽.猪源益生乳酸杆菌的筛选及在断奶仔猪生产中的应用[D].四川农业大学,2007.
[14]Vandenbergh P A.Lactic acid bacteria,their metabolic products and interference with microbial growth[J].FEMS Microbiol.Rev.,1993,12(1/3):221-237.
