不同单酶制剂混合检测对比研究
2010-08-09汤海鸥高秀华
汤海鸥 高秀华 黄 辉
复合酶制剂以综合各种单酶于一体为优势已经在饲料中得到广泛应用,而且在畜牧业生产中起到了重要的作用,并起到了非常明显的效果。复合酶多以单株菌种发酵再以互补复配的方式进行生产,因其含有单酶品种多,在进行酶制剂检测的过程中各单酶之间可能存在的干扰一直妨碍着复合酶制剂活性的准确测定,例如酸性蛋白酶是否会影响其他酶制剂活性的表达等[1]。鉴于此,本试验以各种单酶为研究对象用不同方式进行混合,再进行测定酶活,以研究复合酶检测过程中存在的问题和正确的测定方法,为商品复合酶制剂产品的酶活测定和质量控制提供参考。
1 材料与方法
1.1 试验材料
供试木聚糖酶、纤维素酶、淀粉酶和酸性蛋白酶样品由北京挑战生物技术有限公司提供,试验中以测定的酶活实际值为准。
1.2 木聚糖酶活力测定方法
1.2.1 酶活定义
样品在温度37℃、pH值5.5的条件下,1 min内从燕麦木聚糖(浓度为1%)中产生了1 μmol木糖所需的酶量,为一个木聚糖酶活性单位(U)。
1.2.2 底物(1%燕麦木聚糖)配置
称取1.00 g燕麦木聚糖,用80 ml左右的磷酸氢二钠-柠檬酸缓冲液溶解,于70℃下磁力搅拌半小时,冷凉后用醋酸调至pH值5.5,转入容量瓶中,用缓冲液定容至100 ml。离心机4 000 r/min离心10 min后取上清液备用。4℃避光保存,有效期为3 d。
1.2.3 DNS试剂配置
称取3,5-二硝基水杨酸3.15 g,加水500 ml,水浴至45℃,逐步加入100 ml 0.05 mol/l氢氧化钠溶液,不断搅拌,直到溶液清澈透明,再逐步加入四水酒石酸钾钠91.0 g、苯酚2.50 g和无水亚硫酸钠2.50 g,补加水300 ml,搅拌,溶解后停止加热冷却至室温,用水定容至1 000 ml。储存在棕色瓶中,避光保存。室温下存放7 d后可以使用,有效期为6个月。
1.2.4 酶样测定步骤
在试管中加入1.8 ml 1.0%的木聚糖底物,加入酶液 200 μl,37 ℃准确反应 10 min,加入 3.0 ml DNS 试剂,沸水浴5 min,空白制作时DNS先于酶液之前加入。540 nm波长处测定OD值。从木糖标准曲线求得木糖含量,计算酶活力单位。
1.2.5 木糖标准曲线制作
取15 ml刻度管7支,加入磷酸氢二钠-柠檬酸缓冲液 0.5、1.0、2.0、3.0、4.0、5.0 ml,再分别加 10 μmol/ml木糖标准液1.0 ml,以缓冲液为空白,反应测定步骤同1.2.4节。
1.3 纤维素酶、淀粉酶和酸性蛋白酶活力测定方法
纤维素酶酶活测定参照中华人民共和国农业行业标准NY/T 912—2004[2],淀粉酶和酸性蛋白酶酶活测定参照中华人民共和国轻工行业标准QB/T 1803—1993[3]。
1.4 试验设计
1.4.1 各单酶活性的测定
分别测定木聚糖酶、纤维素酶、淀粉酶和酸性蛋白酶的活性,并测定各单酶中含有的其他3种酶活量(测定过程中,每个样平行取3份,结果取平均值,下同)。
1.4.2 酸性蛋白酶对其他酶活性的影响试验
试验采取完全随机的3×1×3设计方式:按照梯度1、0.5、0.1 g称取木聚糖酶样品(所有样品称量值保留四位有效数字),分别与0.2 g的酸性蛋白酶混合,酶提40 min,测定酶活,纤维素酶和淀粉酶同样按照木聚糖酶试验设计方式进行试验,以上设计同比设定两个处理温度(20、37℃)。
1.4.3 四种单酶整体混合试验
称取木聚糖酶、纤维素酶、淀粉酶和酸性蛋白酶各10 g,将4种酶制剂混合在一起,用各酶相对应的缓冲液酶提40 min,然后测定各种酶的活性,并与原酶活测定值进行对比分析。
2 试验结果与分析
2.1 各单酶活性的测定
供试木聚糖酶、纤维素酶、淀粉酶和酸性蛋白酶样品的酶活测定结果,及各单酶中其他3种酶活含量如表1。
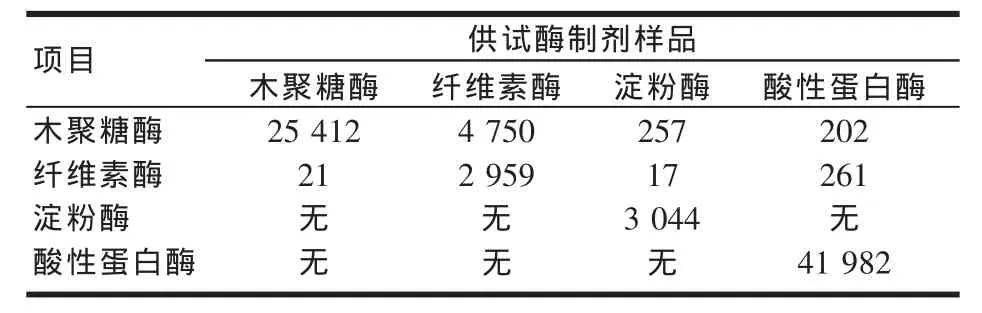
表1 供试样品酶活测定结果(U/g)
由表1可以看出:4个样品中除了木聚糖酶样品外,其他3个酶制剂都含有一定量的木聚糖酶活性,其中尤其是纤维素酶样品中含有较多量的木聚糖酶;非纤维素酶样品中也都含有一定量的纤维素酶活性,其中以酸性蛋白酶样品中纤维素酶活性含量较高;除淀粉酶和酸性蛋白酶样品本身外,其他酶制剂中未检测出淀粉酶和酸性蛋白酶活性,这主要原因可能与酶制剂的诱导物和分泌方式有关,相对于木聚糖酶和纤维素酶,淀粉酶和酸性蛋白酶对诱导物的要求更严格,且分泌方式多以胞内为主[4]。
2.2 酸性蛋白酶对其他酶活性的影响
试验设计按1.4.2节进行混合后,各酶制剂不同混合比例不同温度下测定酶活值如表2。
将表2的酶活测定值与原酶活测定值进行比较,二者之间的相对误差值如表3。
从表2和表3结果可以看出,所有酶活测定结果和原酶活值之间的相对误差都在酶制剂检测允许误差8%之内,且所有相对误差都未超过3%,这说明酸性蛋白酶并没有对其他酶制剂产品酶活产生很大的影响。同样从不同温度对比结果可以看出,酶提温度的改变对酶活也没有产生显著影响。
2.3 四种单酶整体混合试验结果
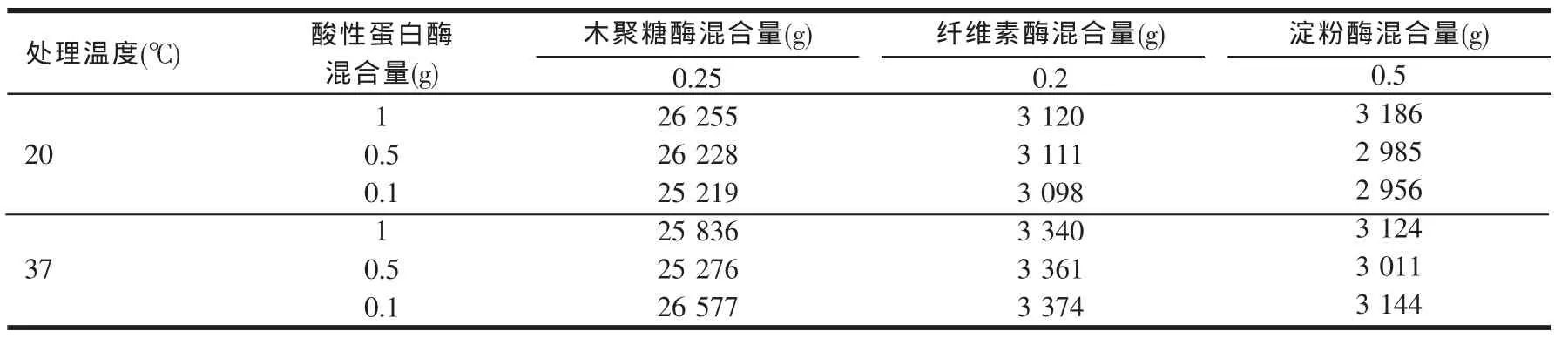
表2 酸性蛋白酶和不同酶制剂不同混合比例下各酶酶活测定值(U/g)
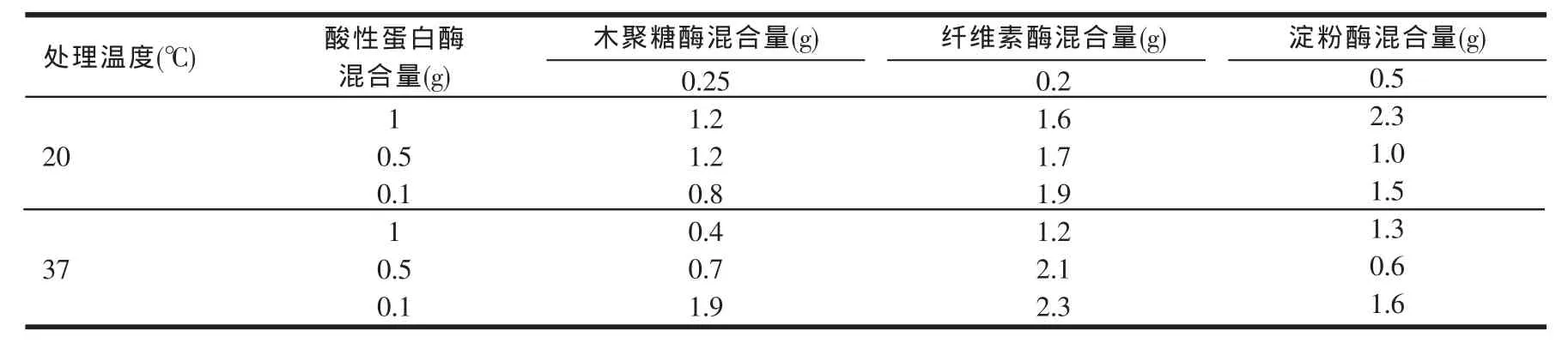
表3 表2测定酶活值与原酶活值之间的相对误差计算结果(%)
试验设计按照1.4.3节进行混合后,对样品进行各种单酶活性的测定,将测定结果乘以稀释倍数(即混合产生的质量倍数4),并与混合前四种样品中含酶总量进行对比,计算混合前后的相对误差值见表4。

表4 四种单酶混合后酶活测定值及与混合前酶活总量之间的相对误差结果
从表4结果可以看出,除木聚糖酶外,其他3种酶制剂的相对误差都不到3%,在酶制剂检测允许误差范围8%之内,这说明各种酶制剂相互混合对纤维素酶、淀粉酶和酸性蛋白酶检测没有影响;木聚糖酶混合后的测定值和总酶活相对误差值比较大,分析其原因可能是淀粉酶在酶提的过程中和载体淀粉发生反应产生还原糖造成的,木聚糖酶酶活的检测原理是利用指示剂显色酶解过程产生的还原糖的量来判定酶活。
鉴于以上分析,试验进行了进一步论证,将木聚糖酶、纤维素酶和酸性蛋白酶按照1.4.3节混合方式进行对比检测。并将测定结果乘以稀释倍数(即混合产生的质量倍数3),与混合前3种样品中含酶总量进行对比,计算混合前后间的相对误差值见表5。

表5 3种单酶混合后酶活测定值及与混合前酶活总量之间的相对误差结果
从表5结果可以看出,除去淀粉酶后3种酶制剂检测酶活值都在3%之内,木聚糖酶混合后的测定值和总酶活相对误差值为2.9%,远小于酶制剂检测允许误差范围8%,这说明排除淀粉酶产生还原糖的干扰后酶活检测可以达到非常准确的判定。
3 讨论
因为复合酶中含有酶种多,各单酶间的相互干扰因素比较复杂,尤其是一些以还原糖显色为判定标准的酶活检测方法易受复合酶中产生还原糖的干扰,所以复合酶的准确测定一直是复合酶质量判定的一大难题。本试验主要目的就是利用各种已知酶活样品进行混合后再测定混合样中各单酶酶活变化情况,以便研究复合酶中各单酶活性的检测方法。
在实际复合酶制剂检测过程中各单酶活性测定受影响因素主要有两种:一是酶制剂本身对其他酶制剂酶活产生的影响,如酸性蛋白酶;二是酶制剂和载体在酶提的过程中发生酶解反应产生的产物对其他酶制剂活性检测产生的影响,如淀粉酶。从本试验结果可以看出,对于试验选用的4种酶制剂检测酶活值易受干扰的主要是木聚糖酶,其他3种酶制剂酶活测定值受酶制剂混合产生的影响很小;而木聚糖酶在排除淀粉酶的干扰后酶活检测值基本不受影响。本试验在选材的过程中根据酶制剂发酵产生方式和复合酶实际含单酶情况,选取两类具有代表性的4种酶制剂,其他酶制剂可以根据酶学性质做类似的推断,也可以进行进一步的试验进行准确论证。
[1]聂国兴,李春喜,明红,等.不同浸提方案对饲用木聚糖酶活性测定结果的影响[J].饲料工业,2003,24(9):35-37.
[2]农业部全国饲料工作办公室,中国饲料工业协会,全国饲料工业标准化技术委员会等.NY/T 912—2004.饲料添加剂纤维素酶活力的测定分光光度法[A].饲料工业标准汇编(2002~2006)[C].北京:中国标准出版社,2006.
[3]全国食品发酵标准化中心,中国标准出版社第一编辑室.QB/T 1803—1993.工业酶制剂通用试验方法[A].白酒标准汇编(第二版)[C].北京:中国标准出版社,2007.
[4]Astrid R.Stricker·Robert L.Mach·Leo H.de Graaff.Regulation of transcription of cellulases-and hemicellulases-encoding genes in Aspergillus niger and Hypocrea jecorina(Trichoderma reesei)[J].Appl.Microbiol.Biotechnol.,2008,78:211-220.
