气相色谱质谱法检测蔬菜中多效唑的残留
2010-08-09王立君
吕 燕,赵 健,杨 挺,王立君
(农业部农产品质量安全监督检验测试中心,浙江 宁波 315040)
1 引 言
多效唑(Paclobutrazol)是三唑类植物生长延缓剂,广泛应用于蔬菜生产中,具有延缓植物生长、抑制茎枝伸长、促进分蘖、促进成花和座果、增强抗旱及抗寒性、提高耐盐性和延缓植物衰老等多种效应[1-7]。现在国内已有水果[8-9]、粮谷[10]等多效唑的检测方法,而蔬菜中残留的检测方法仍少见,用气相色谱-质谱测定蔬菜中多效唑残留量的方法却未见报道。该文采用乙腈作为提取液,通过对弗罗里硅土净化柱洗脱行为的优化,建立了用气相色谱-质谱选择离子方式测定蔬菜中多效唑的方法,该方法简便、快捷、准确。
2 实验部分
2.1 试剂与材料
丙酮(色谱纯),正己烷(色谱纯),氯化钠(分析纯),乙腈(分析纯),固相萃取柱(弗罗里硅土,1 g/6 mL),多效唑标准品(纯度99.0%Dr.Ehrenst orfer GmbH)。
淋洗液:取5mL丙酮,用正己烷稀释至100mL;
洗脱液:取15 mL丙酮,用正己烷稀释至100mL。
2.2 标准储备液和工作液的配制
多效唑标准储备液:用少量丙酮溶解,正己烷定容,配制成1000mg/L,再于4℃冰箱中冷藏保存,有效期3个月。
标准工作液:将储备液用正己烷稀释成浓度为0.050~1.0mg/L标准工作液。
2.3 仪器与设备
Agilent 6890N GC/5973 MS气质联用仪(配备电子轰击离子源(EI));梅特勒-托利多AX205型精密分析电子天平,感量0.01 mg;梅特勒-托利多PL3002型电子天平,感量0.01g;BUCHI V850型旋转蒸发仪;德国IKA T25型匀浆机;高速冷冻离心机(SIGMA 3K15);固相萃取仪(Supeclo)。
2.4 实验步骤
2.4.1 提取
准确称取25.00 g匀浆后的抽取样品,置于250mL匀浆瓶中,加入50.0mL乙腈,10000r/min匀浆2 min后静置10 min,用滤纸过滤,滤液收集到装有10 g氯化钠的100 mL具赛量筒中,收集滤液40~50 mL,盖上盖子剧烈震荡1 min,在室温下静置30min,使乙腈相和水相分层。
2.4.2 净化
从100 mL具塞量筒中吸取乙腈相10.00 mL至250mL烧杯中,烧杯在70℃水浴锅上加热,杯中缓缓通入氮气,蒸发近干,加入2.0mL淋洗液溶解,待净化。
将弗罗里硅土固相萃取小柱,用5.0 mL正己烷预处理,活化,当溶剂液面到达柱吸附层表面时,立即倒入上述待净化溶液,用10.0mL淋洗液淋洗弃去全部流出液,然后用30.0mL洗脱液洗脱,收集洗脱液于50 mL浓缩瓶中,将盛有洗脱液的浓缩瓶置于旋转蒸发仪上,在40℃水浴条件下,旋转蒸发至近干,残渣用正己烷溶解并定容至2.0mL,待测定。
2.5 添加回收率实验
设添加水平为 0.040 mg/kg、0.10 mg/kg和0.50 mg/kg,并设空白对照,重复5次,处理同“2.4”。
2.6 仪器参数与测定条件
2.6.1 气相色谱部分
HP-5MS弹性石英毛细管柱:30m×0.25mm(i.d.),0.25 μm;程序升温:起始温度 100℃,以 20℃/min升温至220℃,再以5℃/min升温至250保持8 min;进样口温度:280℃;传输线温度:280℃;进样模式:不分流进样;进样量:1μL;载气流速:1.1mL/min。
2.6.2 质谱部分
四极杆温度:150℃;离子源温度:230℃;电子能量:70eV。数据采集方式:选择离子监测方式(SIM),监测离子 125,167,236。
3 结果与讨论
3.1 实验条件选择
3.1.1 提取剂的选择
分别选用丙酮、乙腈、乙酸乙酯、丙酮-乙酸乙酯提取样品中的多效唑,实验结果表明,单独用丙酮作为提取溶剂,提取液浓缩后溶液的粘稠度高,使净化工作无法进行;用乙酸乙酯或丙酮-乙酸乙酯进行提取,虽然不影响净化,但是提取效率低;选用乙腈作为提取溶剂,样品回收率在85%以上,故选用乙腈作为提取溶剂。
3.1.2 洗脱剂的选择
分别用正己烷、5%丙酮-正己烷、10%丙酮-正己烷、15%丙酮-正己烷、30%丙酮-正己烷进行洗脱实验。结果表明,用正己烷和5%丙酮-正己烷作为洗脱剂时,多效唑不能被洗脱下来;选用10%丙酮-正己烷多效唑可被洗脱下来,但定量回收所需溶剂多;采用15%丙酮-正己烷和30%丙酮-正己烷溶液均可只用少量洗脱剂定量洗脱组分,但后者同时使大量的杂质洗脱下来。故选用10mL 5%丙酮-正己烷淋洗,用15%丙酮-正己烷洗脱收集,洗脱溶剂用量少,样品也得到了较好的净化。
3.2 线性范围与检测限
取多效唑标准储备液,用正己烷稀释配置成浓度为 0.050 mg/L、0.10 mg/L、0.20 mg/L、0.50 mg/L、1.0 mg/L系列标准工作液液,按2.5仪器条件测定,获得不同浓度的多效唑响应峰面积,以定量离子的峰面积(Y)对相应多效唑标液质量浓度(X)作线性回归,结果表明多效唑在0.050~1.0mg/L范围内线性关系良好,其回归方程为Y=5.71×105X-7.58×103(R2为0.9998)。通过计算空白样品信噪比S/N=3获得该方法检出限为量0.01mg/kg。图1~图5为标准溶液、空白样品和添加样品的总离子流图和质谱图。
3.3 准确度和精密度

在未检出多效唑的白菜和黄瓜样品中分别添加3个不同含量水平的农药标准液,涡旋混合2 min,静置30 min,使添加浓度分别为0.040 mg/kg,0.10 mg/kg和0.50 mg/kg,每个水平做5次平行实验,按照2.4处理后进样,计算加标回收率和相对标准偏差(RSD),结果见表1。此结果回收率良好,相对标准偏差小于10%,符合农药残留检测要求。
对于实际样品,白菜和黄瓜中多效唑的最低检出浓度为0.01mg/kg。

4 结束语
实验以乙腈高速匀浆提取,再经弗罗里硅土固相萃取小柱净化,建立了蔬菜中多效唑残留量的气相色谱-质谱检测方法,该方法灵敏度高,选择性好,通过选择离子的相对丰度,可以对检测结果进行确证。经考察,该方法在选定的浓度范围内,多效唑回收率高,测定精密度好。
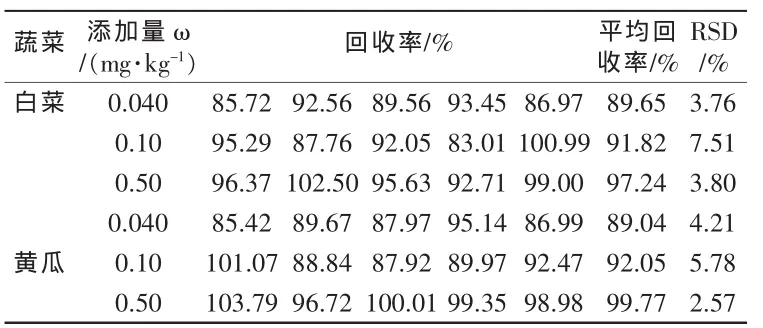
表1 蔬菜中多效唑的添加回收率
目前,我国规定了花生中多效唑的最大残留限量值为0.5mg/kg[11],但尚未制定白菜和黄瓜中多效唑的最大残留限量值,而日本肯定列表中未见白菜和黄瓜的最大残留限量,所以两种蔬菜中多效唑最大残留限量归为“一律标准”,即为0.01 mg/kg。该研究方法符合残留分析试验要求,能够用于检测蔬菜中多效唑的农药残留。
[1]吕忠玉.荞麦喷施多效唑的实验效果简报[J].农业科技与信息,2009(5):29-30.
[2]卢向阳.多效唑在油菜雪灾后的施用效果研究[J].现代农业科技,2009(2):130-132.
[3] 杨福孙,孙爱花,王燕丹,等.生长延缓剂对槟榔苗期叶绿素含量及叶绿素荧光参数的影响[J].中国农学通报,2009(2):255-257.
[4]陈 晖.湖南地区辣椒冬播春育规模型育苗技术探讨[J]. 长江蔬菜,2009(1):27-29.
[5] 曹翠玲,杨 力,胡景江.多效唑提高玉米幼苗抗旱性的生理机制研究[J].干旱地区农业研究,2009,27(2):153-158.
[6]左顺杰.马铃薯喷多效唑效果好 [J].农药市场信息,2009(7):42.
[7] 王 存.多效唑在植物生产上的应用现状[J].热带农业科学,2009(2):67-72.
[8] 戴蕴青,刘 肃,黄卫东,等.高效液相色谱法测定苹果中的多效唑含量[J].色谱,1995(6):455-457.
[9] 白 桦,邱月明,张 青.气相色谱-质谱法测定苹果中多效唑残留量[J].分析测试学报,2005(4):64-66.
[10]白 桦,邱月明,郝 楠,等.气相色谱-质谱法测定粮谷中多效唑残留量[J].检验检疫科学,2004(3):54-55.
[11]NY 1500.10.1-2007,农产品中农药最大残留限量[S].北京:中国农业出版社,2008.
