伊曲康唑肌肉注射液的药代动力学研究
2010-08-08崔鹏博李继昌刘运枫
刘 云,崔鹏博,常 虹,陈 曦,陈 亮,李继昌,刘运枫
(东北农业大学动物医学学院,哈尔滨 150030)
伊曲康唑是一种合成的亲脂性三氮唑衍生物,其抗菌谱广、性质稳定、副作用小。对浅部真菌、酵母菌、其他丝状菌和双相菌等都有很好的效果,现在它已经成为治疗全身性真菌感染的理想药物[1]。目前,伊曲康唑在我国人类医药批准上市的剂型有静脉注射剂、口服溶液和胶囊,对其肌肉注射剂研究则很少[1-5]。动物与人类不同,大部分真菌感染为浅表性的,主要表现为皮肤真菌病。近年来我国奶牛皮肤真菌病的发病率呈上升趋势,牛群一旦感染,很难根治。特别是犊牛感染皮肤真菌后,其生长发育会受到严重影响。同时真菌也会造成奶源的污染,引起人的真菌感染。本试验以羟丙基-β-环糊精化合物做辅料对伊曲康唑分子进行包合制成肌肉注射剂,并以山羊为试验动物,采用高效液相色谱-紫外检测器对伊曲康唑肌肉注射剂在山羊体内的药物代谢动力学进行研究,为研制出适合动物应用的抗真菌的药物剂型奠定基础。
1 材料与方法
1.1 药品、试剂与仪器
伊曲康唑原粉(上海志强生物科技有限公司,20060902);1,2-丙二醇(上海试剂总厂);聚乙二醇(PEG-400)(北京化工厂);无水乙醇(分析纯)(天津市永大化学试剂开发中心);磷酸(分析纯)(天津市北方天医化学试剂厂);甲醇(色谱纯)(购自美国Burdick&Jackson公司);乙腈(色谱纯)(购自美国J.T.Baker公司);三乙胺(色谱纯)(购自天津市科密欧化学试剂有限公司);岛津-2010A型高效液相色谱仪(日本岛津公司);KQ-500D型数控超声清洗器(昆山市超声仪器有限公司);TGL-16G型高速离心机(Centrifuge公司)。
1.2 色谱条件
色谱住:Waters C18(150 mm×3.9 mm,5 μm);流动相:乙腈-0.1%三乙胺缓冲液(85%磷酸调pH 2.5),体积比为 70: 30,用 0.45 μm 微孔滤膜过滤,超声脱气,流速:1 mL·min-1;紫外检测波长:261 nm;柱温为室温;进样量20 μL。
1.3 试验设计
山羊3只,试验前正常进食,按4 mg·kg-1在后肢内侧肌肉进行注射伊曲康唑肌肉注射剂。在给药后 0、0.5、1、2、3、4、5、6、7、8、9、10、11、12、24、48 h颈静脉采血。每个时间点采血3 mL,放入肝素钠真空贮血管中,3 000 r·min-1离心15 min,取血浆1 mL转移至带盖塑料离心管中密封,-20℃保存。
1.4 血样预处理
取血浆1.0 mL于7 mL EP管中,加2.0 mL甲醇,混匀,沉淀蛋白,10 800 r·min-1离心10 min,取上清液2.0 mL,37℃水浴,氮气吹干,将残留物用120 μL流动相复溶,涡旋1 min,移入1.5 mL离心管,10 800 r·min-1离心5 min,取上清液,20 μL 进样测定。
1.5 标准曲线制作
精确称取伊曲康唑原粉1 mg,加甲醇溶解配制成0.01 mg·mL-1的伊曲康唑标准液,放于4℃冰箱中保存备用。取羊空白血浆1 mL,共6份,用伊曲康唑标准液与空白血浆配制成血药浓度分别为:20、50、100、200、500、1 000 ng·mL-1的血浆标准溶液。按“血样预处理”中所述进行操作,所得数据进行线性回归计算,得出标准曲线回归方程。y=672.83x+17530,其中 R=0.9991,n=6,在10~500 ng·mL-1浓度范围之内线性关系良好,最低血浆检出浓度为20 ng·mL-1。
1.6 方法精密度和样品回收率检测
取羊空白血浆和伊曲康唑标准液制作高、中、低浓度的质控样本,分别为20、100、500 ng·mL-1。3个样本为一组。取5组质控样本,于1 d日内连测5次,计算日内变异系数。每天取一组质控样本,连测5 d,计算日间变异系数。取5组指控样本连测5次,来计算相对回收率。另外,取聚乙二醇与伊曲康唑原粉分别配制成20、100、500 ng·mL-1浓度的质控样本,三个为一组。取5组质控样,连续测量,记录其峰面积,来计算绝对回收率。
1.7 数据处理
将各时间点血浆药物浓度的平均值,带入MCPKP药动学软件,为一房室模型,权重系数为1/C2,进行处理,求出主要参数的均值和相对标准差。
2 结果与分析
2.1 色谱图分析
从图1中可知伊曲康唑的保留时间为3.19 min,重复性较好,主峰与杂质峰间分离良好,无干扰,空白血浆处理效果好,对主峰测定无影响。但是,主峰的对称性稍差,存在轻微的拖尾现象。


图1 伊曲康唑高效液相色谱Fig.1 Chromatogram of itraconazole
2.2 血药浓度-时间曲线
按4 mg·kg-1进行肌肉注射,在肌内给药后0.5、1、2、3、4、5、6、7、8、9、10、11、12、24、48 h采集颈静脉血样。处理后用高效液相色谱测定,结果带入标准曲线回归方程,测得伊曲康唑在羊体内的各点血药浓度,结果见表1。三只羊的血药浓度-时间曲线见图2。

表1 山羊各时间点伊曲康唑血药浓度测定Table 1 Results of itraconazole plasma concentration in goats at each time point
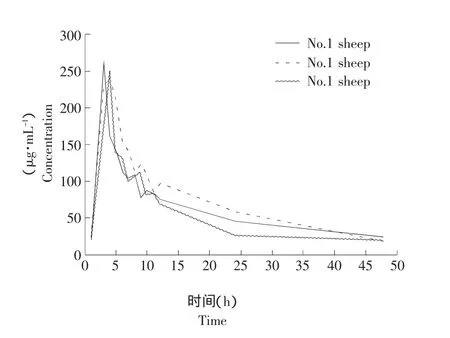
图2 伊曲康唑在山羊体内各时间点血药浓度变化曲线Fig.2 Plasma concentration variation curve of itraconazole in goats at each time point
2.3 血浆药物代谢动力学参数
结果见表2。
将各时间点血浆药物浓度的平均值带入MCPKP药动学软件进行处理,计算主要药代动力学参数,所得数据如表2所示。
2.4 方法精密度和样品回收率检测结果
结果见表3。
本试验所测定的日间和日内相对误差均小于10%,说明本方法的回收率和精密度测定完全符合生物样本测定的要求。

表2 伊曲康唑在山羊体内药代动力学参数Table 2 Pharmacokinetics parameters of itraconazole in goats
3 讨 论
本试验采用高效液相色谱法对伊曲康唑进行血药浓度的测定,结果表明,与白林等方法比较[4],本方法简便易行,重复性好,专一性强,灵敏度高,能够满足伊曲康唑血药浓度测定和药代动力学研究。
当药物以肌肉的方式注射进入羊体内后,伊曲康唑的药代动力学参数并不够十分理想,AUC、Kel、Cmax等均低于预测值,可能原因如下,当药物以肌注的方式进入体内后,由于伊曲康唑具有很高的组织亲和性,所以,会有一部分的伊曲康唑与肌肉组织结合,当伊曲康唑与肌肉组织结合后只有一小部分可以经过重吸收进入循环系统,直接影响到了血药浓度。但是,在这种血药浓度情况下,也是可以达到对真菌病进行治疗的目的。根据Cauwenbergh和陈佳试验结果来看[5-6],使用伊曲康唑进行一周的治疗后,皮肤中的药物浓度为血浆中的5~10倍,根据感染部位的不同,伊曲康唑水平可维持3~4周。王爱平[7]研究表明,伊曲康唑在角质组织中有蓄积作用,因为皮肤、毛发和甲是完全独立的部位。一旦伊曲康唑进入这些器官,就不再重新分配到系统循环。根据伊曲康唑的最小抑菌浓度,这种方式给药是可以达到抑菌效果的。因此,将伊曲康唑包合剂以肌注方式治疗皮肤癣病,具有一定的可行性。

表3 伊曲康唑的精密度和回收率Table 3 Precision and recovery for the analysis of itraconazole
4 结论
利用高效液相色谱法检测血浆中伊曲康唑含量、各项指标符合规定,方法有效、可行。通过对羊肌肉注射伊曲康唑药代动力学分析,表明伊曲康唑包合剂肌肉注射后可达到一定的血药有效浓度,肌内注射伊曲康唑包合剂注射液可以用于动物皮肤癣菌的治疗。
[1] 白林,陈秀兰,哈英霞,等.高效液相色谱法测定人血清中伊曲康唑浓度[J].解放军药学学报,1999,15(2):48-49.
[2] 李惠云,李小利,王本杰,等.伊曲康唑分散片/胶囊人体药代动力学及生物等效性研究[J].中国现代应用药学杂志,2006,23(9):898-900.
[3] 汪贻广,齐晓飞,王建伟,等.伊曲康唑包合物注射液的制备及理化性质考察[J].沈阳药科大学学报,2005,22(3):161-163.
[4] 白林,陈秀兰,吕晓川.伊曲康唑胶囊的人体药代动力学研究[J].人民军医药学专刊,1999(3):133-136.
[5] Cauwenbergh G,Degreef H,Heykants J,等.口服伊曲康唑在人皮肤中的药代动力学研究[J].中国社区医师,2006,22(18):19-21.
[6] 陈佳,吴安.伊曲康唑治疗进展[J].中国皮肤性病学杂志,1998,12(6):386-387.
[7] 王爱平.伊曲康唑间歇冲击治疗趾甲真菌病疗效和血清及甲中药物水平临床研究[J].临床皮肤科杂志,2004,33(9):574-576.
