大白菜黑腐病鉴定的湿度试验及其苗期与成株期抗病性的相关分析
2010-08-07翟文慧张涛涛张凤兰
翟文慧 张涛涛 胡 俊 张凤兰 严 红*
(1内蒙古农业大学农学院,内蒙古呼和浩特 010018;2北京市农林科学院植物保护与环境保护研究所,北京 100097;3北京市农林科学院蔬菜研究中心,北京 100097)
大白菜黑腐病是由野油菜黄单胞杆菌野油菜致病变种〔Xanthomonas campestrispv. campestris(Pam.)Dowson〕(Williams et al.,1972)引起的。1973年美国各地大规模发生该病,在生产上造成了严重损失(Williams,1980)。我国20世纪70年代就对此病有过报道(李明远,2004),近年来,黑腐病在大白菜上的为害日益严重,在全国范围内均有不同程度的发生。该病在大白菜苗期和成株期均可侵染发生。在黑腐病的防治中,选用抗病品种是一个经济安全的方法。在抗病育种过程中,对所选材料进行抗病性鉴定是必不可少的,鉴于苗期鉴定主要在室内进行,需要的空间面积小,温湿条件较易控制,且周期短、速度快,可节省大量人力物力(丁万霞 等,2000;龚静等,2001)。室内苗期人工接种鉴定大白菜黑腐病抗性目前已被广泛采用(解永梅 等,2007;芦燕和张鲁刚,2008)。但是由于大白菜黑腐病菌可在大白菜任何生长期进行侵染,造成大白菜发病,而苗期和成株期对黑腐病的抗性是否一致,目前未见相关的报道。Bandyopadhyay和Chattopadhyay(1985)认为,黑腐病抗性作用点可能在水孔区域,说明湿度对大白菜黑腐病的发生有很大的影响。本试验在苗期人工接种采用7种不同的保湿方法,从中选出使大白菜对黑腐病的抗性表现最为充分的保湿条件,并对不同抗病性的大白菜品种进行苗期和成株期病情指数间的相关性分析,以确立苗期人工接种黑腐病进行品种抗病性鉴定的可靠性,为大白菜抗病育种和生产上筛选抗病品种提供科学依据。
1 材料与方法
1.1 材料
供试大白菜品种为北京大牛心(中熟,合抱二牛心类型)、北京新1号(晚熟,大青叶类型)、北京新4号(晚熟,大青叶类型)、京翠70号(中熟,青麻叶类型)、京翠60号(早熟,青麻叶类型)和京秋 65号(中熟,叠抱平头类型),均由北京市农林科学院蔬菜研究中心提供。北京新 1号为抗病对照,北京大牛心为感病对照。播种前将供试材料的种子在 50 ℃热水中浸泡10 min消毒(李树德,1995)。
黑腐病病原采自北京市农林科学院蔬菜研究中心自然发病的大白菜上,经北京市农林科学院植物保护与环境保护研究所植物病害综合研究室鉴定为Xanthomonas campestrispv. campestris。
1.2 方法
1.2.1 苗期抗病性鉴定
1.2.1.1 接种及保湿方法 苗期人工接种方法参考严红等(2001)的方法,在4~5片真叶时,用喷雾法接种,接菌浓度为1.0×108pfu·m L-1,均匀喷洒到叶片上,以叶片布满菌液但无水滴滴落为度。接种材料有北京大牛心、北京新4号和北京新1号,接种保湿采用7种不同处理方法。处理1,不保湿,不接种;处理2,接种前保湿12 h,接种后保湿24 h;处理3,接种前保湿12 h,接种后保湿48 h;处理4,接种前不保湿,接种后保湿24 h;处理5,接种前不保湿,接种后保湿48 h;处理6,接种前保湿12 h,接种后不保湿;处理7,接种前不保湿,接种后也不保湿。每处理15株,3次重复,室内相对湿度40.33 %,保湿罩内相对湿度92 %~100 %,接种后14 d进行调查。
1.2.1.2 苗期抗病性鉴定 苗期人工接种鉴定方法参考1.2.1.1,保湿方法采用处理4(接种前不保湿,接种后保湿24 h),大白菜品种为北京大牛心、北京新1号、北京新4号、京翠70号、京翠60号和京秋65号。
1.2.2 成株期抗病性鉴定 将6个大白菜品种在温室育苗,14 d后种植于网室内,每个品种10株,4次重复。结球期人工接种黑腐病菌,接种方法同1.2.1.1,接种后保湿24 h,14 d后进行调查。
1.3 病害调查分级及抗性归类标准
依据《国家“九五”科技攻关计划项目专题验收报告》中总结制定的标准并加以改良进行病情分级和抗病性归类。
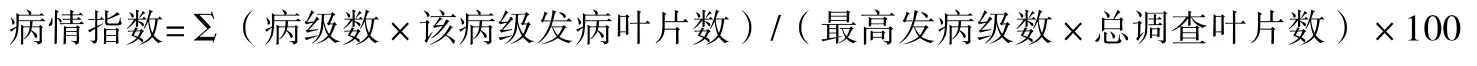
苗期病情分级标准:0级,无病症;1级,水孔处有黑色枯死点,无扩展;3级,病斑从水孔向外扩展,占叶面积5.0 %以下;5级,病斑从水孔向外扩展,占叶面积5.1 %~25.0 %;7级,病斑从水孔向外扩展,占叶面积25.1 %~50.0 %;9级,病斑从水孔向外扩展,占叶面积50.1 %以上。
成株期病情分级标准:0级,无病症;1级,1~3片外叶有1~2个病斑;3级,1~3片外叶有多个病斑;5级,50 %的外叶有病斑;7级,50 %以上的外叶有病斑,并且病斑沿叶脉扩展至茎部;9级,病斑扩展至根茎部,整个植株死亡。
抗病性归类标准:免疫(I),病情指数0;高抗(HR),病情指数0.01~11.11;抗病(R),病情指数11.12~33.33;耐病(T),病情指数33.34~55.55;感病(S),病情指数55.56~77.77;高感(HS),病情指数77.78~100.00。
1.4 数据处理
采用DPS软件进行数据处理、回归分析。
2 结果与分析
2.1 苗期人工接种处理中保湿对大白菜抗病性的影响
大白菜苗期人工接种黑腐病菌时不同保湿处理的病情指数、抗性分类及其方差分析见表1。

表1 苗期病情指数、方差分析及抗性分类
由表1可知,北京新1号、北京大牛心和北京新4号在处理3下发病最严重,极显著高于其他处理;处理4和处理5差异不显著。不同品种间对大白菜黑腐病的抗性程度差异明显,北京新1号最抗病,病情指数为3.46~31.29,在高抗和抗病之间;北京大牛心和北京新4号都较感病,病情指数为12.98~66.91,在感病和抗病之间。
由图 1、2可知,接种前后不同保湿处理下,大白菜苗期抗病性差异显著,其中接种前保湿时间对大白菜的黑腐病抗性影响不大;接种后保湿24 h与保湿48 h对大白菜发病情况影响不大;接种后是否保湿对病情的发展影响最大,是保证抗病性鉴定结果准确可靠的关键因素。

图1 接种前不保湿,接种后不同保湿时间对大白菜发病的影响
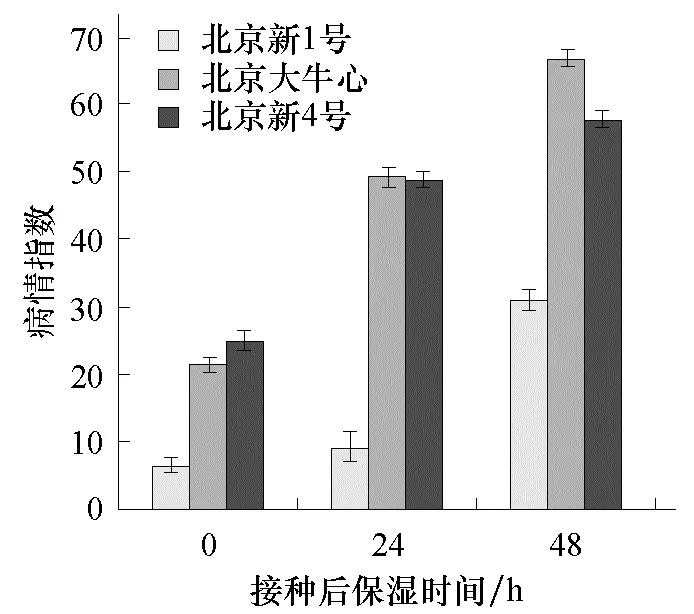
图2 接种前保湿12 h,接种后不同保湿时间 对大白菜发病的影响
2.2 苗期与成株期抗病性的相关性
北京大牛心、北京新1号、北京新4号、京翠70号、京翠60号和京秋65号成株期和苗期(接种前不保湿,接种后保湿24 h)的病情指数见表2。
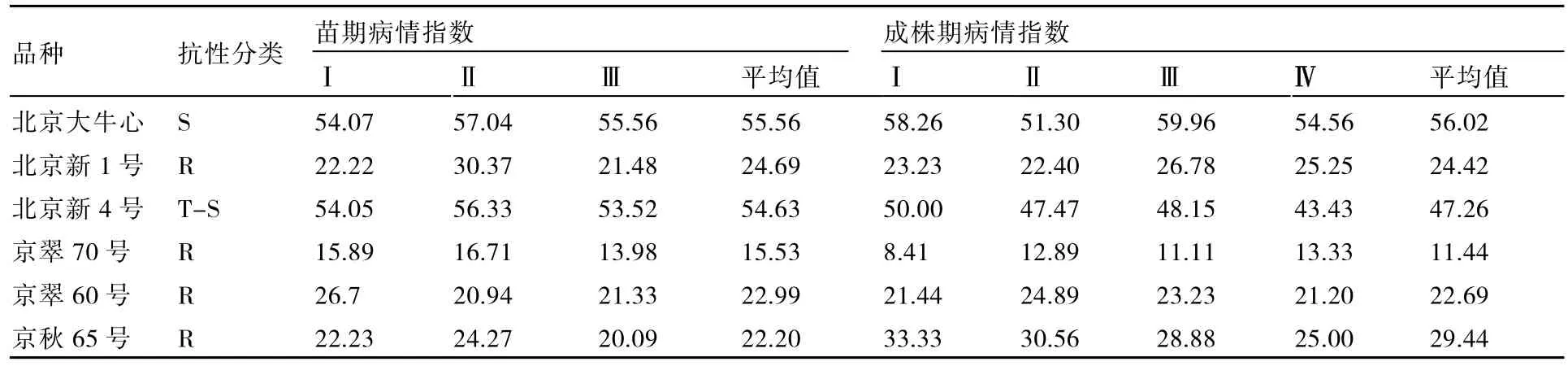
表2 6个大白菜品种苗期和成株期的病情指数

表3 6个大白菜品种苗期和成株期病情指数的方差分析
回归方程:Y=2.781 4+0.888 3X;相关系数R=0.961;t测验:t=6.95>t0.01,5=4.032;F测验:F=48.234 8>F0.01。
依据t测验和F测验得出苗期人工接种的病情指数和成株期的病情指数有真实直线回归关系,相关系数为0.961,说明利用苗期人工接种方法来鉴定大白菜品种的黑腐病抗性是准确可靠的。
3 结论与讨论
北京大牛心、北京新1号、北京新4号、京翠70号、京翠60号和京秋65号均为栽培品种,追踪多年来在生产中对黑腐病的抗感表现,与本试验苗期和成株期人工接种鉴定的抗感类型一致,北京新1号、京翠70号、京翠60号和京秋65号表现为抗病,而北京大牛心和北京新4号在秋季降雨次数多的年份表现为感病。
大白菜黑腐病苗期人工接种鉴定保湿方法试验表明,大白菜品种间对黑腐病的抗性存在显著差异,无论怎样调整保湿时间,北京新1号的抗病性始终保持在高抗和抗病之间,为抗病品种,而北京大牛心和北京新4号的抗病性会因保湿时间的长短在感病和抗病之间变化,只要接种后保湿即表现为感病或耐病,虽然几种处理按病情指数被划分为不同的等级,但方差分析结果显示差异并不显著,因此认为这两个品种均为对黑腐病感病的品种。
本试验还表明湿度对大白菜黑腐病抗性有很大的影响,接种后是否保湿对病情的发展影响最明显,是保证抗病性鉴定结果准确可靠的关键因素。这一结果与Bandyopadhyay和Chattopadhyay(1985)认为黑腐病抗性作用点可能在水孔区域的论点相吻合,也与肖崇刚(1994)在研究甘蓝黑腐病苗期鉴定方法时,得出喷雾接种后发病程度与保湿有关的报道一致,但肖崇刚的方法在喷雾后只保湿了12 h,而本试验保湿时间为24 h及48 h,至于12 h的保湿时间是否能使不同抗性的大白菜品种充分发病,则有待进一步研究。
对苗期和成株期人工接种大白菜黑腐病菌后的病情指数进行回归分析,结果表明苗期和成株期人工接种鉴定的病情指数间有真实直线回归关系(R=0.961),说明利用苗期人工接种的方法来鉴定大白菜对黑腐病的抗性是可靠的,而采用苗期人工接种鉴定的方法周期短、速度快,可节省大量人力物力,在大白菜抗病性育种中可简化选育程序、缩短育种年限,对加快抗病育种进程有重要意义。
丁万霞,李建斌,徐鹤林. 2000. 我国结球甘蓝育种研究的现状及展望(上). 上海蔬菜,(1):15-16.
龚静,朱玉英,吴晓光. 2001. 甘蓝黑腐病抗性材料筛选及接种方法的研究. 上海农业科技,(4):87,77.
李明远. 2004. 十字花科蔬菜黑腐病的发生与防治. 当代蔬菜,(11):36.
李树德. 1995. 中国主要蔬菜抗病育种进展. 北京:科学出版社:79-82.
芦燕,张鲁刚. 2008. 陕西省大白菜黑腐病苗期人工接种抗性鉴定方法研究. 西北农业学报,17(4):219-222.
肖崇刚. 1994. 一种甘蓝黑腐病接种新方法. 植物保护,20(5):35.
解永梅,张薇,赵永强,张广民. 2007. 山东省白菜黑腐病苗期抗病性鉴定方法. 植物保护学报,34(6):661-662.
严红,裘季燕,张涛涛,田兆丰. 2001. 白菜苗期三种病原复合接种的多抗性鉴定方法研究. 植物病理学报,31(3):109-113.
Bandyopadhyay S,Chattopadhyay S B. 1985. Incidence of black rot of cabbage and cauliflower under different conditions of infection. Indian Journal Agricultural Science,55(5):350-354.
W illiams P H,Staub T,Sutton J C. 1972. Inheritance of resistance in cabbage to black rot. Phytopathology,62:247-252.
Williams P H. 1980. Black rot:a continuing threat to world crucifers. Plant Dis,64:736-742.
