双胎胎盘HLA-G第8外显子多态性与妊娠结局的相关性研究
2010-08-04陈敏玲方群庄广伦罗艳敏陈宝江何志明陈筠虹陈涌珍
陈敏玲 方群 庄广伦 罗艳敏 陈宝江 何志明 陈筠虹 陈涌珍
(中山大学附属第一医院妇产科胎儿医学中心,广东广州 510080)
近年来全社会双胎发生率呈明显上升趋势,究其原因与辅助生育技术发展、高龄孕妇增多以及促排卵药物使用有关。双胎妊娠与单胎妊娠比较,不良妊娠结局发生率明显增高。约83%的双胎妊娠合并有1种以上的妊娠并发症。迄今,对于双胎不良妊娠结局的原因尚不明确。近年研究发现HLAG基因第8外显子上3'非翻译区的14bp缺失/插入(14-bp/14+bp)多态性对于妊娠维持具有重要作用,可能影响妊娠结局。本研究采用多聚酶链反应-序列特异性引物法(PCR-SSP)检测双胎胎盘该位点的多态性,探讨双胎H LA-G第8外显子基因多态性分布,并探讨其与双胎妊娠结局的关系。
1 资料与方法
1.1 一般资料 收集2003年11月至2005年12月在中山大学附属第一医院分娩的双胎病例共125例,追踪妊娠结局,各种产科合并症诊断标准参照乐杰主编的《妇产科学》(第 6版)。孕妇平均年龄(30.1±4.1)岁,平均孕次1次,产次2次,平均分娩孕周(35.3±2.8)周(22~39周)。辅助生殖受孕66例(52.8%),自然受孕59例(47.2%);双绒毛膜双胎76例(60.8%),单绒毛膜双胎49例(39.2%,其中有1例为辅助生殖技术ICSI受孕,其余48例均为自然受孕)。
1.2 方法
1.2.1 胎盘标本取材及处理 在知情同意下,胎盘娩出后,立即在各胎儿脐带附着点对应处自胎盘母体面向胎儿面剪切胎盘组织约5 g。在冰生理盐水中反复漂洗,去除血液,分装冻存管中,液氮冻存半小时后转移至-80℃冰箱保存。采用饱和酚、氯仿的方法提取胎盘的基因组DNA。
1.2.2 PCR扩增HLA-G第8外显子基因 参照文献设计引物,由大连宝生物技术有限公司合成,序列如 下 :GE14 HLA-G:5′-GTG ATG GGC TGT TTA AAG TGT CAC C-3′;RHG4:5′-GGA AGG AAT GCA GTT CAG CAT GA-3′;β-actin 引物由上海生工生物工程技术服务有限公司合成 5′–GTG GGG CGC CCC AGG CAC CA – 3′;5′–GTC CT T AAT GTC ACG CAC GAT T TC – 3′,扩增产物为548 bp。PCR反应体系为 50 μ L,其中模板 DNA 500 ng,10×PCR反应液 5 μ L,10 U/μ L Taq 酶(TaKaRa 公 司)0.5 μ L,10 mmol/L dNTPs 4μ L,10 μ mol/L 上下游引物各 1μ L 。PCR反应条件为:94℃5 min预变性,94℃30 s,58℃50 s,72 ℃60 s,循环35次,延伸72 ℃10 min。
1.2.3 PCR扩增产物的电泳 ①选择合适的垂直电泳槽;②配置凝胶液:配方见试剂配制;③灌置凝胶:凝胶液配好后,充分混匀,凝胶液体沿着一侧玻璃板注入,渐及底部,乃至全部充盈两层玻璃板夹缝。胶液灌好后,在玻璃板上方插入齿梳。在室温下让凝胶聚合约45 min;④配制电泳缓冲液:配制1XTBE电泳缓冲液1 000 ml,分别加入到上下电泳槽中。将玻璃板插入电泳槽中,夹紧,倒入电泳液;⑤电泳:小心取出梳子,立即用缓冲液冲洗加样孔,取出 PCR 产物10 μ l,加入上样缓冲液2 μ l混匀 ,用移液枪将混合液加入预先制备好的8%聚丙烯酰胺凝胶的上样孔中,垂直电泳仪100 V 10 min,60 V电泳6小时;⑥根据指示剂迁移位置来判定是否终止电泳,下胶;⑦按常规硝酸银染色,固定:清洁洗槽,将有凝胶的玻璃板面向下,凝胶浸入固定液中,使凝胶与玻璃板分离,固定30 min;凝胶用蒸馏水清洗;1%硝酸浸泡10 min,用蒸馏水清洗;染色:将凝胶浸入显色液中,出现电泳带,加入终止液,凝胶用蒸馏水清洗;⑧使用干胶仪制成易于保存的图片。
1.2.4 PCR扩增产物的序列测定 选取-14 bp/-14 bp和+14 bp/+14 bp各1条带,切胶、纯化,送英韦创津公司测序。①PCR产物直接纯化,纯化后的PCR产物测序,DNA纯度要求:OD260/OD280=1.6~2.0、DNA浓度要求:PCR产物10 ng/μ L;②测序PCR反应。配制Master Mix后在热循环仪GeneAmp PCR 9600上进行DNA扩增:
反应体系:
DNA(200 ng/μ L) 1μ L
BigDye Mix 8 μ L
Primer(3.2pmol/μ L)1 μ L
灭菌去离子水 10 μ L
总体积 20 μ L
反应条件:先进行98℃2 min预变性,再进行25个循环(96℃10 s变性,50℃5 s退火,60℃4 min延伸),最后4℃保温。③纯化测序PCR产物,电泳样品配制和变性,在上述乙醇挥发干的样品中加入12 μ L的 Hi-Di Formamide;上样毛细管电泳。④毛细管电泳。⑤使用Sequence Analysis软件对测序结果进行分析。
1.3 统计学方法 统计分析均使用SPSS13.0软件包完成,以2个胎盘14+bp等位基因出现总频数分组进行统计。以P<0.05为具有统计学显著差异。2组间均数比较采用t检验,3组间均数之间的比较采用ANOVA方法和分层分析。
2 结果
2.1 扩增产物经8%非变性聚丙烯酰胺(PAGE)凝胶电泳结果 第8外显子存在1个14 bp删除/插入位点(14-bp/14+bp)多态性,14-bp基因型可扩增出 210 bp的片断,而 14+bp基因型产生224 bp的条带,杂合子可见210 bp和224 bp的2条片段。采用北京天为时代科技有限公司的pBS DNA/Hae III作为DNA marker(见图1)。

图1 HLA-G第8外显子基因8%非变性聚丙烯酰胺凝胶电泳结果marker:PBR DNA/HaeⅢladder(213bp/234bp)
2.2 PCR扩增产物测序结果 与GenBank Blast比对,224 bp产物比210bp产物多出了1个14 bp的基因序列:AT T TGT TCA TGC CT(见图2)。与文献报道[1]一致。

图2 HLA-G第8外显子测序图
2.3 不同基因型双胎妊娠合并症比较(见表1)。双胎14+bp等位基因出现总频数与双胎妊娠结局的关系(见表2)。
其他内科合并症包括:甲亢、肝炎、血小板减少性紫癜等从上面2个表可见羊水过多与双胎输血综合征与双胎间基因是否一致有显著性关系(P<0.05),这与单绒毛膜双胎双胎间基因一致性较高有关。其余合并症与双胎盘是否基因一致无关。2个胎儿基因型分布顺序对统计结果无影响(P>0.05)。2胎14+bp等位基因出现总频数在出现子痫前期双胎中有显著性差异,且经 Ridit检验证实子痫前期发生率与2胎14+bp等位基因总频数有关(95%可信区间为0.189~0.288,P<0.05)。小于32周早产与14+bp等位基因总频率不同分组未见显著性关系(P=0.058),但在胎儿携带4个14+bp等位基因组中比例较高(2例/6例)。考虑到不同的绒毛膜性质可能导致双胎基因分组和其他其他变量的关系可能不同,故以绒毛膜性质为分层因素(协变量)筛选与双胎基因分组有统计学意义的因素,分析方法:分类变量按照 CMH(Cochran-Mantel-Haenszel)法进行分析;连续性变量采用协方差分析进行分析。其中有统计学差异的变量为:子痫前期(P=0.0002)。
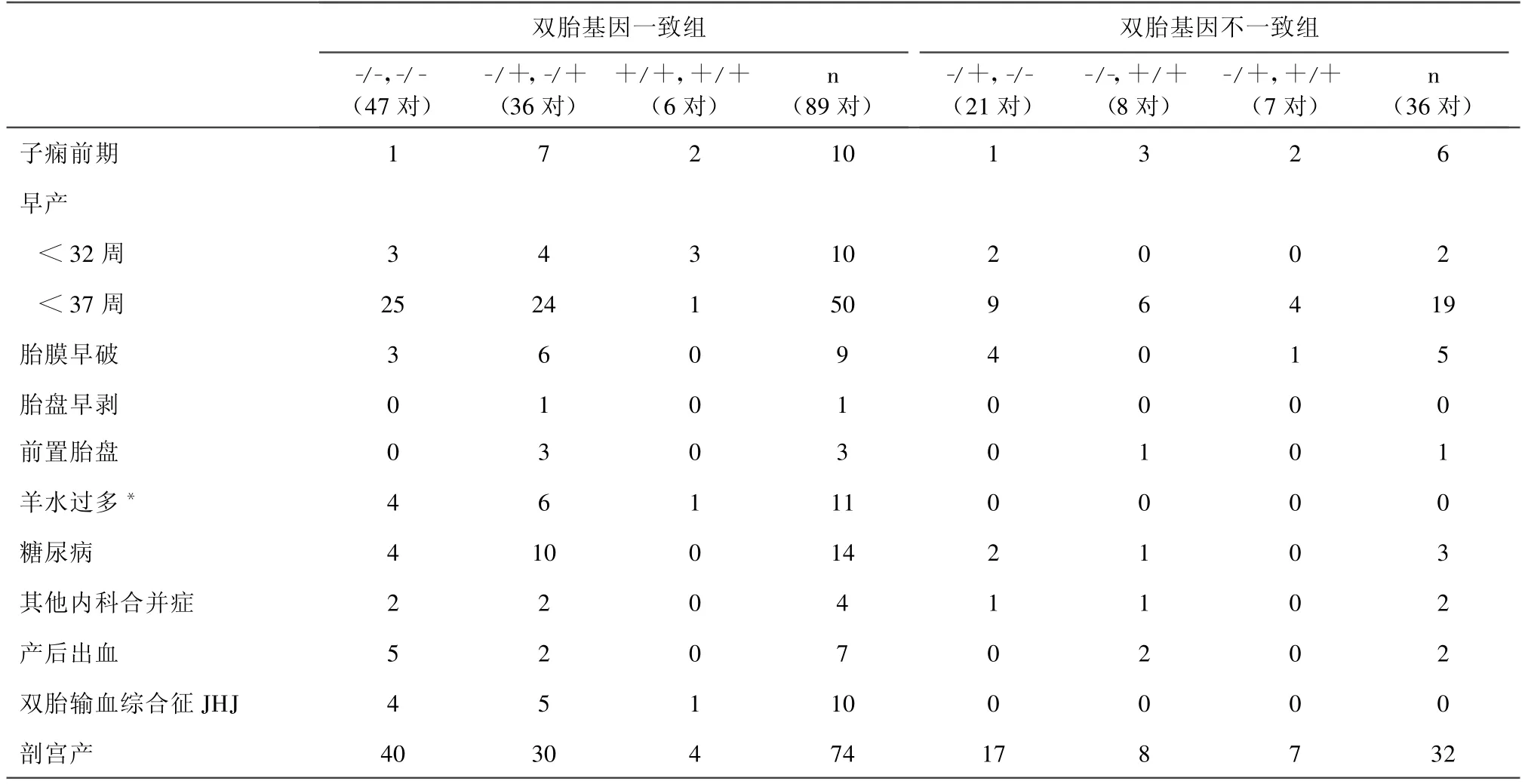
表1 不同基因型双胎妊娠合并症比较(n)
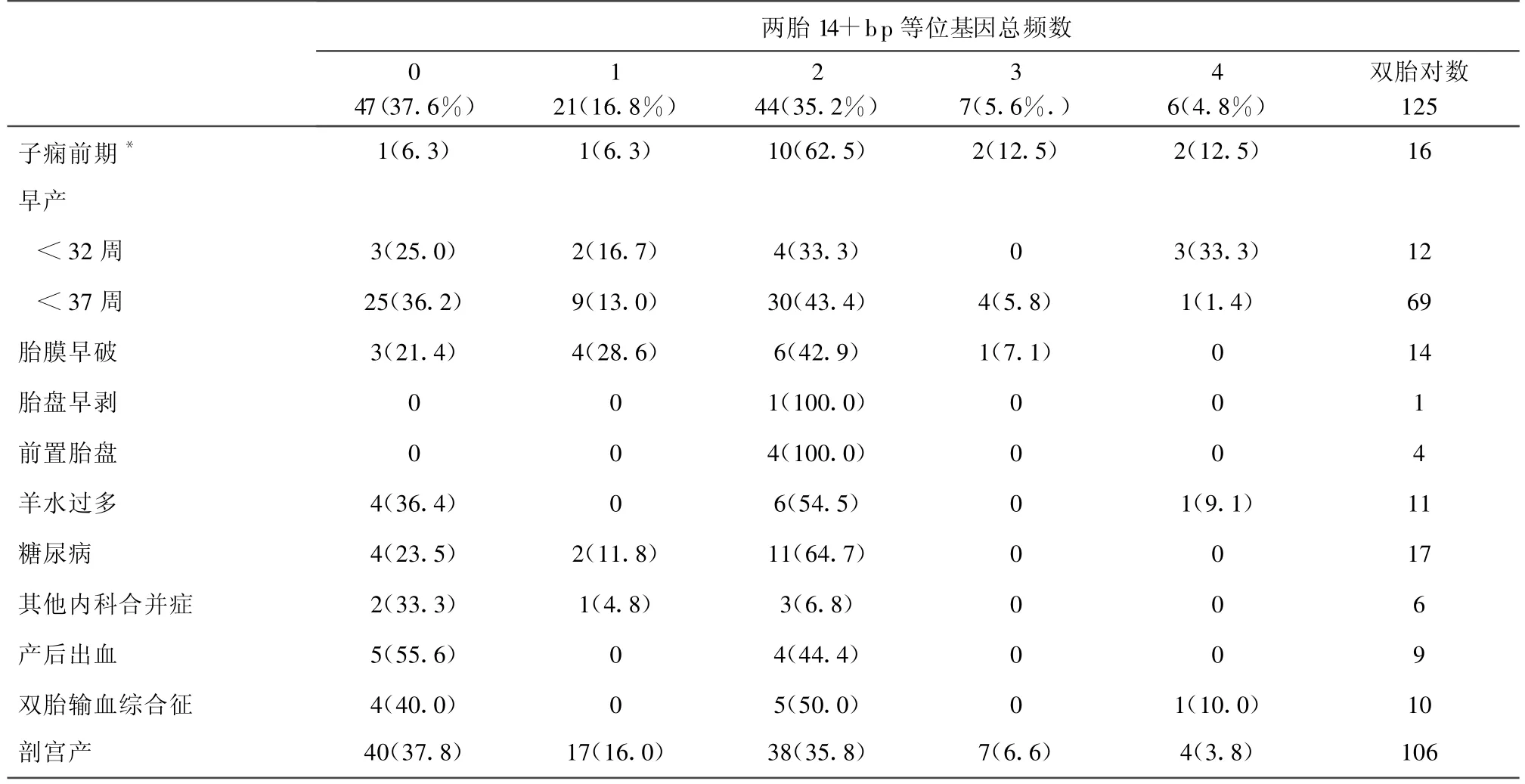
表2 双胎14+bp等位基因总频数与双胎妊娠结局的关系[n(%)]
3 讨论
3.1 HLA-G第8外显子多态性与妊娠维持 无论是单胎抑或双胎妊娠,成功妊娠的维持与母胎间正常的免疫耐受密切相关。早在20世纪50年代英国学者Medawer就提出胎儿为半异体移植物的概念。HLA-G维持妊娠的机制包括:①直接或间接抑制蜕膜自然杀伤(dNK)细胞;②与蜕膜组织中的T细胞结合,抑制T细胞杀伤;③调节T辅助性细胞因子分泌,促使 Th2偏移;④可溶性HLA-G分子通过激活Fas/FasL旁路,引起活化母体CD8+T细胞的凋亡[2]。HLA-G多态性部位呈“成簇”趋势,主要分布在5个区域,包括由外显子 2、3、4所编码的具有抗原结合功能的结构域、5'端上游调节区(5'URR)和外显子8的3'非转录区(3'UTR),而在其他基因编码区核苷酸序列变异较少,相对比较保守。1993年由 Harrison首次报道了H LA-G第8外显子(14-bp/14+bp)多态性,在对灵长类动物的MHC-G进化过程研究中发现,这种14bp多态性属于缺失性多态,而非插入性多态。研究发现14+bp等位基因表达时,外显子8起始处1个92bp片断被切除,结果表明被切除的 HLA-G mRNA(92-bp)可能比完整的HLA-G mRNA更稳定而影响选择性剪切。推测这一区域参与HLA-G转录后调控,其多态性变化和HLA-G mRNA表达水平和HLA-G的蛋白水平密切相关。近年来发现HLAG第8外显子中的14bp缺失/插入位点(14-bp/14+bp)多态性与妊娠维持的关系密切,成为关注热点。越来越多报道该位点多态性与单胎自然流产、子痫前期、胎盘早剥等不良妊娠结局有关。但哪1种多态性有利于维持妊娠的结论有所不同。2002年Hviid等[3]发现孕妇14+bp/14+bp多态性与RSA明显相关;而2004年 Tripathi等[1]则认为孕妇14-bp/14+bp基因型与RSA关系更加密切;2000年Bermingham等[4]发现子痫前期患者子代14-bp/14+bp基因型比率较高;2001年O'Brien及2004年 Hylenius等[5]认为胎盘 14+bp/14+bp基因型与子痫前期发病有关。
3.2 双胎妊娠的维持 约83%的双胎妊娠合并有1种以上的妊娠并发症。双胎妊娠早期流产发生率为5%,是单胎的2~3倍;和单胎妊娠相比,双胎合并子痫前期,相对危险率为2.04~4,且一旦并发子痫前期,病情往往较为严重,以中、重度为主;双胎胎盘早剥发生率较单胎增高(4.7%比0.7%);胎儿发育受限发生率是单胎妊娠的10倍;单绒毛膜双胎孕32周前的早产率为9.2%,双绒毛膜双胎为5.5%,而单胎妊娠仅为1%~2%。但迄今,对于双胎容易发生子痫前期等不良妊娠结局的原因尚不明确。既往认为双胎妊娠由于子宫腔过大,引起子宫张力增高,容易引发流产和早产,其次由于子宫腔增大后使胎盘严重缺血缺氧,胎盘抗氧化酶减少和活性下降,胎盘局部出现氧化应激,引起脂质过氧化和绒毛间隙的白细胞活化,加剧氧化应激,从而造成血管内皮细胞激活功能障碍和结构损伤,使双胎妊娠较单胎更易发生母儿严重并发症。但是这一理论并不完善,有学者对羊膜腔内压力进行研究,发现双胎妊娠过程中子宫腔内压力并没有明显增加[3]。因此双胎妊娠的维持机制尚未明了,其妊娠期的免疫耐受状况目前也尚不清楚,但早在20世纪70年代,就有学者提出双胎妊娠较单胎妊娠携带的组织相容性抗原量明显增高,推测这种特殊的胎儿抗原超负荷对妊娠结局有一定的影响。从关于基因多态性的研究中也发现双胎妊娠胎儿某些基因的多态性对妊娠结局可产生影响,如胎儿携带IL-1拮抗受体第2等位基因(IL1RN*2)的总频数与双胎发生胎膜早破相关,且显著增加围产儿死亡率。若第1胎胎儿Fas基因启动子出现第 670位的 A→G的单核苷酸突变(TNFRSF6),则双胎发生未足月胎膜早破(PPROM)的几率显著性增高[4]。单胎妊娠中H LA-G第8外显子多态性与妊娠结局相关的研究结果是否在双胎妊娠上适用,目前尚未见相关报道,是值得探讨的问题。
3.3 H LA-G第8外显子基因多态性与双胎妊娠合并症的关系 文献报道双胎妊娠合并子痫前期发生率约为11.8%~37%[5],与本文结果相符。子痫前期的发生与胎盘滋养细胞侵蚀功能降低有关,妊娠初期,当滋养干细胞分化为细胞滋养层后,由增殖表型转化为侵蚀表型,标志为HLA-G、基质金属蛋白酶及黏附分子受体类型的改变,之后其生理性血管重铸发生异常。因此子痫前期的发生与H LA-G密切相关。体外培养的子痫前期患者胎盘滋养细胞发现H LA-G的表达下降,本研究亦证实H LA-G第8外显子多态性与双胎子痫前期的发生可能有关。本研究中双胎妊娠合并子痫前期发病率为12.8%,在子痫前期组中14+bp/14+bp基因型比率显著增高,此结果与2008年国外的研究结果[6]相一致,该文献报道单胎胎盘HLA-G第8外显子14+bp序列的存在与子痫前期的发生有关,认为此序列的存在影响HLA-GmRNA的类型和蛋白表达,从而对子痫前期的发病起重要作用。
双胎妊娠特有的合并症(如双胎输血综合征、双胎不同一性等)与胎盘14 bp基因多态性未见明显关系。羊水过多与双胎输血综合征与双胎间基因是否一致有显著性关系(P<0.05),这与单绒毛膜双胎双胎间基因一致性较高有关。因为双胎输血综合征、羊水过多与单绒毛膜性质有关,所以在双胎基因一致组中多见。双胎不同一性与胎盘14 bp基因多态性无关,推测不同一性双胎胎儿的体重和表型的不一致与免疫因素关系不大,需从另外角度探讨,可能和双胎间遗传异质性、X染色体失活偏离、胎盘血供和宫内环境差异有关。
[1]T ripathi P,Abbas A,Naik S,et al.Role of 14-bp deletion in the HLA-G gene in the maintenance of pregnancy[J].Tissue Antigens,2004,6:706-710.
[2]Chaouat G,Ledee-Bataille N,Dubanchet S,et al.T H1/TH2 paradigm in pregnancy:paradigm lost? Cytokines in pregnancy/early abortion:reexamining the T H1/TH2 paradigm[J].Int Arch Allergy Immunol,2004,2:93-119.
[3]Fisk NM,Ronderos-Dumit D,T annirandorn Y,et al.Normal amniotic pressure throughout gestation[J].Br J Obstet Gynaecol,1992,1:18-22.
[4]Kalish RB,Nguyen DP,VardhanaS,etal.A single nucleotide A>G polymorphism at position-670 in the Fas gene promoter:relationship to preterm premature rupture of fetal membranes in multifetal pregnancies[J].Am J Obstet Gynecol,2005,1:208-212.
[5]Fischer RL,Weisberg LS,Hediger ML.Etiology of thirdtrimestermaternal hyperuricemia in nonpreeclamptic twin gestations[J].Obstet Gynecol,2001,1:62-65.
[6]Moreau P,Contu L, Alba F,etal.HLA-G Gene Polymorphism in Human Placentas:Possible Association of G*0106 Allele with Preeclampsia and Miscarriage[J].Biol Reprod,2008,79:459-467.
