骨髓间充质干细胞对大鼠实验性肺气肿的作用
2010-07-30李宝平
李 旭,李宝平
(山西医科大学,山西太原 030001)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是呼吸系统疾病中的常见病和多发病,此病患病率和死亡率均高,可导致患者肺功能进行性减退,严重影响其劳动力和生活质量,因此成为一个重要的公共卫生问题。COPD与慢性支气管炎和肺气肿密切相关,而肺气肿是指肺部终末细支气管远端气腔出现异常持久的扩张,并伴有肺泡壁和细支气管破坏而无明显的纤维化[1]。因此,对肺气肿的治疗在COPD的治疗中显得尤为重要。目前研究认为肺气肿是一种不可逆转的病理改变[2-4],对此病尚无有效的根治方法。骨髓间充质干细胞(MSCs)是成体干细胞的一种,是一类多能干细胞,具有多向分化的潜能[5-6],其多向分化的特性为我们治疗不可逆病变提供了一种新的思路。本实验在用烟熏诱导大鼠肺气肿形成后,观察使用MSCs后的干预作用,为肺气肿的治疗提供参考和实验依据。
1 材料与方法
1.1 材料
Wistar雌性大鼠 24 只,鼠龄 8 周,体重(180±20)g;Wistar雌鼠1只,鼠龄6周,体重约150 g(山西医科大学生理实验动物中心提供);4,6-二乙酰基-2-苯基吲哚(DAPI,北京中杉金桥生物技术有限公司);Anti-Pan-cytokeratin(北京博奥森生物技术有限公司);羊抗兔IgG-Cy3(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 实验动物及分组 Wistar雌性大鼠24只随机分为四组,每组6只,分别为健康组(A组)、模型组(B组)、生理盐水对照组(C组)和治疗组(D组)。B、C、D组均利用烟熏的方法诱导其肺气肿的形成,之后D组给予骨髓间充质干细胞治疗,C组给予生理盐水作为对照,给药4周后处死大鼠。
1.2.2 大鼠肺气肿模型的制作 参照许三林等的方法自制大鼠实验性被动吸烟装置,将大鼠置于自制玻璃箱内被动吸烟,每次点燃香烟(金丝猴牌,宝鸡卷烟厂制)10支,1次/d,持续30 min,每周6次,连续12周,12周后肺气肿形成。
1.2.3 大鼠骨髓间充质干细胞的分离、培养 取6周龄Wistar雌鼠1只,采用无菌操作的方法,用咬骨钳将股骨和胫骨两骨端剪去,用PBS缓冲液将骨髓冲入离心管中,用吸管吹吸混匀。用比重为1.077 g/ml的淋巴细胞分离液进行分离,用含10%胎牛血清的DMEM培养液悬浮细胞,置于37℃、5%CO2培养箱中孵育。待细胞生长密度达80%~90%时进行消化,以1∶2比例进行传代,扩增培养[7],通过多次传代对细胞进行纯化,取第3代细胞。
1.2.4 细胞标记 取第3代大鼠骨髓间充质干细胞,加入无菌的DAPI至终浓度为50 g/L,在37℃条件下孵育30 min,离心后PBS反复洗涤以去除未结合的DAPI,离心收集细胞,稀释至1×1010/L,放于冰浴中,1 h内将细胞通过尾静脉注射注入受体大鼠体内。
1.2.5 肺组织病理标本的制备 断颈处死大鼠后,在胸部切断肋骨,以暴露气管、肺脏等,主支气管切断后用弯钳将其提起,沿背部脊柱前方分离,将肺脏及心脏分离出来,剪去心脏后在25 cm H2O(1 cm H2O=0.098 kPa)压力下经气管灌注10%中性甲醛溶液固定肺脏30 min,结扎气管,浸入10%中性甲醛溶液,固定48 h,每只大鼠各取双侧最大横径处肺组织,常规石蜡包埋切片,HE染色。
1.2.6 Pan-cytokeratin免疫荧光染色 石蜡切片脱蜡后,将切片放入蒸馏水中,PBS洗3次,5 min/次,0.1 mol/L枸橼酸盐缓冲液(pH 6.0)微波抗原修复,滴加5%BSA封闭液,加入 Anti-Pan-cytokeratin(稀释比 1∶200,抗体稀释液为 0.3%Triton X-100/PBS),4℃过夜,阴性对照组用PBS代替。加入羊抗兔 IgG-Cy3(稀释比 1∶50)1∶100 稀释,50%缓冲甘油封片,荧光显微镜观察荧光染色的结果并拍照。
1.3 统计学分析
2 结果
2.1 大鼠肺脏大体标本观察
健康组肺脏表面平整光滑,淡粉红色,质地较软,弹性较好,指压后无压痕。模型组肺脏体积明显增大,弹性较差,呈苍白色,经指压后可留有压痕,肺脏切面可见多量较大的肺泡腔,呈现不规则的形状,且大小不一。D组和C组肺脏病变较B组轻。
2.2 肺组织病理学观察
在显微镜下观察HE染色后的病理切片。A组大鼠肺组织肺泡大小均匀,肺泡数目较多,肺泡间隔较厚。B组出现肺内呼吸性细支气管、肺泡管、肺泡等的扩大,肺泡大小不一,肺泡数目明显减少,肺泡间隔变窄,并有不同程度的断裂。C组大鼠肺组织病理切片HE染色镜下观察,肺组织病理变化与B组相似,无明显变化。D组大鼠肺组织病理切片HE染色镜下观察,肺泡数目较C组增多,肺泡面积减小,肺泡间隔增厚。
2.3 大鼠平均肺泡数(MNa)和平均肺泡面积(MAA)
在100倍显微镜条件下,观察四组大鼠的肺脏病理切片,每只大鼠观察2张片子,每张片子随机选择10个视野进行肺泡计数,计数每个视野内的肺泡数(Na),测出每个视野的面积(TA),HE染色阳性区域为肺实质的面积(PA),以MAA=(TA-PA)/Na计算每个视野的平均肺泡面积,测量时尽量避开支气管及大、中血管。结果见表1。
表1 各组大鼠 MNa及MAA()

表1 各组大鼠 MNa及MAA()
与 D组比较,*P<0.05
组别 大鼠只数 MNa(个) MAA(μm2)A组664±6*44080±5078 B组631±7*102573±22783*C组633±4*90645±21715*D组646±564421±5223
经方差分析,MNa四组总体上 F=11.164,P=0.001,MAA四组总体上F=8.603,P=0.002,说明四组总体上MNa与MAA均有显著性差异。SNK-q检验两两比较结果显示,D组单位面积 MNa明显高于 B 组(P<0.05)和 C 组(P<0.05),但明显低于 A 组(P<0.05),B 组和 C 组之间无显著性差异(P>0.05)。四组 MAA 比较:A、D 组无显著性差异(P>0.05),B、C 组之间无显著性差异(P>0.05),D 组 MAA 明显低于 B组(P<0.05)和C组(P<0.05)。结果表明,D组单位面积MNa明显高于B组和C组,但仍低于A组;MAA明显低于B组和C组。
2.4 注射的骨髓间充质干细胞的检测
D组在荧光显微镜下,用DAPI标记后的骨髓间充质干细胞可以看见蓝色的胞核,说明注射的骨髓间充质干细胞进入肺组织中。此外,在肺组织中做Pan-cytokeratin免疫荧光染色,可见D组大鼠肺组织的肺泡壁、支气管壁均有大量红染的阳性细胞,还可发现少量胞核为蓝色的细胞,同时胞质为红色,提示供体来源的骨髓间充质干细胞在受体肺组织内可分化为上皮细胞。见图1~3(图1~3为同一视野,箭头所指为同一细胞)。

图1 可见大鼠肺组织内蓝色的细胞核(DAPI标记)(×200)

图2 免疫荧光染色可见肺泡上皮细胞呈红色(Cy3标记)(×200)
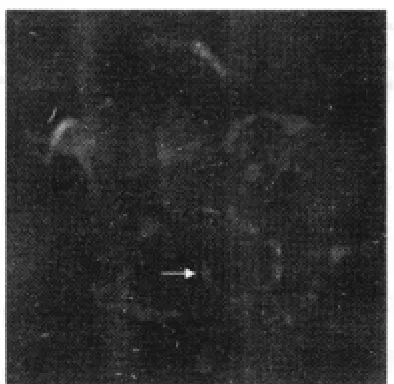
图3 在大鼠肺组织内可见同时具有蓝色胞核和红色胞质的细胞(×200)
3 结论
肺气肿在临床上表现为进行性发展的不可逆的气流受限,在病理学上表现为肺部终末细支气管远端气腔出现异常持久的扩张,并伴有肺泡壁和细支气管的破坏而无明显纤维化的疾病,具有极高的死亡率和致残率[8]。肺气肿的内科治疗以预防感染、控制并发症同时配合呼吸运动锻炼来改善患者的呼吸功能,虽有一定的作用,但不能阻止病情发展。外科方面,肺移植术和肺减容术已成为治疗终末期肺气肿最有效的方法[9-11],对于终末期肺气肿而言,唯一有效的治疗方法就是实行肺移植,但肺移植技术也有很大的局限性,如供体缺乏、价格昂贵等,所以无法广泛应用。本实验应用骨髓间充质干细胞为研究对象,就是因为间充质干细胞是一类具有分化潜能的细胞,可以在特定条件下分化为多种细胞,它的损伤趋化性可以使骨髓间充质干细胞“游”向损伤部位,并在局部微环境条件下诱导分化修复损伤部位。
制作肺气肿模型的方法多种多样,使用比较多的是弹性蛋白酶和香烟烟雾刺激的方法,使用弹性蛋白酶制作肺气肿模型虽然周期短,但是由于液态的弹性蛋白酶混合液要在气管内弥散,通过大鼠的呼吸来进行分布,所以不能均匀分布,以致肺气肿的病变以及病变程度的分布都是不均匀的,与此相比,香烟烟雾的刺激能更好地模拟人类肺气肿的发病情况[12]。因此,本实验采用烟熏来诱导大鼠肺气肿的形成。
本实验在对四组病理切片进行分析后,可以看到经过骨髓间充质干细胞治疗的大鼠单位面积MNa明显高于B组和C组,MAA明显小于B组和C组,说明肺气肿的病理变化发生了改善,同时在荧光显微镜下我们看到DAPI标记后的骨髓间充质干细胞进入了受损的肺组织,还发现其分化为上皮细胞,这些都说明骨髓间充质干细胞参与了肺组织的再生。骨髓间充质干细胞在此过程中发挥了重要的作用,这就为治疗肺气肿提供了一条新思路。本实验只是一个初步的研究,骨髓间充质干细胞在这个过程中是否有其他作用,以及其分化的机制是什么,肺气肿的病理变化是否能得到逆转,都还需要进一步研究。
[1]中华医学会呼吸病学会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
[2]Thomas L,Petty M.COPD in perspective[J].Chest,2002,121(5):116S-120S.
[3]Stephen I,Rennard D.New understanding of pathogenesis and mechanisms can guide future therapy[J].Postgraduate Medicine Minneapolis,2002,6(111):28-32.
[4]Angela B,Mark E,Melinda A.Chronic obstructive pulmonary disease:assessing and treating psychological issues in patients with COPD[J].Geriatrics,2005,12(60):18-21.
[5]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-56.
[6]Pittenger MF,Mackay AM,Beck SC,et al.Multilinegae potential of adult human mesenchymal stem cell[J].Science,1999,284(5411):143-147.
[7]华平,熊利华,张华,等.骨髓间充质干细胞移植重建大鼠缺血心肌的实验研究[J].中华显微外科杂志,2004,2(27):117-120.
[8]Pauwels RA.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease.NHLIB/WHO global initiative for chronic obstructive lung disease(GOLD)workshop summary[J].Am J Respir Crit Care Med,2001,163(5):1256.
[9]National Emphysema Treatment Trial Research Group.A randomized trial comparing lung-volume-reduction surgery with medical therapy for severe emphysema[J].N Engl J Med,2003,348(21):2059-2073.
[10]Cooper JD. The history of surgical procedures for emphysema [J].AnnThorac Surg,1997,63(2):312-319.
[11]Meyers BF,Patterson GA.Chronic obstructive pulmonary disease.10:bullectomy,lung volume reduction surgery,and transplantation for patients with chronic obstructive pulmonary disease[J].Thorax,2003,58(7):634-638.
[12]Shapiro SD.Animal models for COPD[J].Chest,2000,117(Suppl 1):223S-227S.
