根蘖型苜蓿根部RNA提取方法的比较
2010-07-25
(北京林业大学草地资源与生态实验室,北京 100083)
①苜蓿Medicago sativa是世界各国种植面积最多的牧草之一,在我国已有两千多年的栽培历史,属豆科多年生优质高产牧草,营养价值高,适应性强,适口性好,被誉为“牧草之王”。根蘖型苜蓿的根蘖性状起源于西伯利亚地区的野生黄花苜蓿M.f alcata,该性状能在水平根上形成根蘖,进而形成枝条,形成较强的抗旱、耐严寒的能力,是极具利用价值的优异遗传性状;探寻根蘖性状发生的分子生物学机制,寻找与根蘖性状相关的新基因是国内外研究的空白。寻找与根蘖性状发生的相关基因,首先要进行苜蓿cDNA的构建,目前国内有关苜蓿RNA的提取方法鲜有报道,因此,建立一种简便、高效适合苜蓿总RNA的提取方法,是进行根蘖苜蓿发生分子机制与新基因克隆的基础,也是进行苜蓿基因组深入研究的关键。
1 材料和方法
1.1 材料和试剂
1.1.1材料 根蘖型苜蓿为引自美国的Travois品种,取自北京顺义区赵全营镇试验地,该地位于北京城区的东北方,属暖温带半湿润气候。于2009年8月生长季将紫花苜蓿移栽回实验室。试验前取紫花苜蓿的新鲜叶片、茎和根组织,用焦碳酸二乙脂(Diethyl Pyrocarbonate,DEPC)水迅速清洗2次,用滤纸吸干表面的水,迅速用液氮进行研磨[1]。
1.1.2试剂和处理方法 所用试剂全部为新开试剂,用灭菌的0.1%DEPC水配置;离心管、各种枪头等塑料耗材均需预先用DEPC水浸泡过夜,次日于121℃高温灭菌备用;研钵、研杵、药匙、剪刀、试剂瓶等物品用锡箔纸包裹,于200℃高温灭菌4 h[2]。
1.2 根蘖型苜蓿总RNA的提取方法
1.2.1改良CTAB法 根据刘君[3]的方法,作适当修改。
1)取200 mg新鲜的紫花苜蓿材料放入预冷的研钵中,加入液氮,先轻轻研磨,在液氮即将挥发完时,迅速研磨,再加液氮再研磨,直至将苜蓿材料研磨至粉末,转入2 mL的离心管中。
2)在2 mL离心管中加入1 mL 65℃预热的提取缓冲液[RNA提取缓冲液为 2%CTAB(m/V)、4%PVP(m/V)、0.1 mol/L Tris-Cl(pH值 8.0)、25 mmol/L EDTA-Na(pH 值8.0)、1.4 mol/L NaCl、使 用 前 加 入 1% β-巯 基 乙 醇(V/V)],涡旋1 min,65℃温浴10 min,期间震荡离心2~3次。
3)分别加入1.5 mL的酸性饱和酚(pH值4.7~5.5)和1.5 mL的氯仿∶异戊醇(24∶1),充分震荡,冰上放置10 min,4℃,12 000 r/min离心10 min,将上清液转移至另一新的2 mL离心管中,重复1次。
4)取1 mL上清液移入一个新的1.5 mL离心管中,加入250 μ L的10 mol/L LiCl混匀后,-20 ℃冰箱中放置3 h,4℃,12 000 r/min离心10 min。
5)弃上清液,加入100 μ L 0.5%SDS溶液溶解沉淀,同时加入10 μ L的3 mol/L NaAc(pH 值为5.2),充分溶解后加220 μ L的预冷无水乙醇,混匀,于-70℃处理30 min,4℃,12 000 r/min离心15 min,去上清液。
6)用75%的乙醇洗涤沉淀2次,4℃,12 000 r/min离心10 min,弃上清液,沉淀于室温下风干后加入80 μ L DEPC水充分溶解,放置-70℃冰箱中保存备用。
1.2.2TRNzol法
1)取新鲜的紫花苜蓿材料在液氮中充分研磨,大约每100 mg使用 1 mL TRNzol。
2)将匀浆样品在15~30℃放置5 min,使得核酸蛋白复合物完全分离。
3)可选步骤:4℃,12 000 r/min离心10 min,取上清液。
4)每使用1 mL TRNzol加入0.2 mL氯仿,盖好管盖,剧烈振荡15 s,室温放置3 min。注意:如不能旋涡混匀,可手动快速颠倒混匀2 min。
5)4℃,12 000 r/min离心10~15 min,将上层水相(约600 μ L)转移到新管中。
6)在得到的水相溶液中加入等体积异丙醇,混匀,室温放置20~30 min。
7)4℃,12 000 r/min离心10 min,去上清液。离心前 RNA沉淀经常是看不见的,离心后在管侧和管底形成胶状沉淀。
8)加入1 mL 75%乙醇(DEPC处理过的双蒸水配制)洗涤沉淀。每使用1 mL T RNzol至少用1 mL 75%乙醇对沉淀进行洗涤。
9)4℃,5 000 r/min离心3 min,倒出液体,注意不要倒出沉淀,剩余的少量液体短暂离心,然后用枪头吸出,注意不要吸起沉淀。
10)室温放置晾干(不要晾的过干,RNA完全干燥后会很难溶解,晾干2~3 min即可),根据试验需要,加入40 μ L DEPC水,反复吹打,混匀,充分溶解RNA,放置-70℃冰箱中保存备用。
1.2.3改良的异硫氰酸胍法 根据刘春生和王文全[4]的方法,作适当修改。
1)取200 mg新鲜的紫花苜蓿材料在液氮中充分研磨,将粉末移入2 mL离心管中,加入在冰上预冷的800 μ L提取缓冲液[4 mol/L异硫氰酸胍、25 mmol/L柠檬酸钠(pH 值7.0)、0.5%十二烷基肌氨酸钠、8%PVP,用前加入1%β-巯基乙醇(V/V)]。
2)充分振荡混匀,加入50 μ L 2 mol/L NaAc(pH 值4.2)和 50 μ L 氯仿∶异戊醇(24∶1),充分混匀,冰浴15 min。
3)4℃,12 000 r/min离心20 min,将上清液移入新离心管,用等体积的氯仿:异戊醇(24∶1)抽提至界面清亮。
4)再将上清液移入新离心管,加入等体积的异丙醇,混匀,置-20℃沉淀2 h,4℃,12 000 r/min离心30 min。
5)小心移弃上清液,沉淀用500 μ L提取缓冲液重悬,同时加入1/10体积 3 mol/L NaAc(pH值5.2)和2.5倍体积的无水乙醇,-20℃放置2 h以上。4℃,12 000 r/min离心30 min,去上清液。
6)用75%乙醇洗沉淀2次,室温下干燥,加入80 μ L DEPC水溶解沉淀。
1.2.4改良SDS法 根据史宝胜等[5]及何振艳等[6]的方法,作适当修改。
1)取200 mg新鲜的紫花苜蓿材料在液氮中充分研磨,将粉末移入2 mL离心管中,向离心管中加入0.6 mL SDS提取缓冲液[2%(m/V)SDS、硼砂0.025 mol/L(pH值8.5),DEPC水处理]、0.06 mL的β-巯基乙醇、0.4 mL Tris苯酚和0.3 mL氯仿,迅速加入离心管中,剧烈震荡3 min。
2)4℃,12 000 r/min离心5 min,将上清液移入新离心管,加入0.3 mL Tris苯酚和0.3 mL氯仿,剧烈震荡2 min,4℃,12 000 r/min离心5 min,将上清液移入新离心管,用等体积氯仿重复步骤2抽提1次。
3)向上清液中加入等体积的4 mol/L LiCl和1/2体积的无水乙醇,混匀,冰浴10 min,4℃,12 000 r/min离心10 min。
5)沉淀溶于适量的DEPC水中,待溶解后加入1/10体积2 mol/L NaAc和3倍体积无水乙醇,冰浴10 min,4℃,12 000 r/min离心10 min。
6)用 75%的乙醇洗涤沉淀1次,加入 80 μ L DEPC水溶解沉淀。
1.3RNA纯度及其完整性检测用1.2%琼能量系统脂糖凝胶在50×TAE缓冲液下电泳,电泳后用凝胶成像系统观察结果。取3 μ L RNA 样品,用DEPC 水稀释到 300 μ L,混匀后用紫外分光光度计测定230、260和280 nm波长下的吸收值,进行总RNA质量浓度计算。
2 结果与分析
2.1 不同提取方法下苜蓿总RNA产率与纯度分析由表1可见,采用改良CTAB法和T RNzol试剂盒法提取的总 RNA 其OD260 nm/OD280 nm为 1.66~1.89,OD260nm/OD230nm为1.98~2.34,说明通过这2种方法得到的总RNA的产率和纯度都比较高,有效去除了蛋白、多糖和酚类等物质,减少了RNA的降解和损失,明显优于其他 2种方法提取的总 RNA,改良CTAB法与 TRNzol试剂盒法相比,总 RNA的纯度与产率都明显较高,是更适合提取苜蓿总RNA的方法。
改良SDS法和改良异硫氰酸胍法提取的总RNA其 OD260 nm/OD280nm过大或过小。比值过大,说明RNA有降解;比值过小,则说明有残余蛋白质或酚类存在。OD260 nm/OD230nm小于2.0,表明其中有大量的小分子或盐存在,因而这2种方法所得RNA需进一步纯化。
2.2 不同提取方法下苜蓿总RNA的完整性比较分析4种方法下提取的苜蓿根、茎、叶总RNA电泳检测结果如图1所示,用CTAB法和T RNzol试剂盒法提取的总 RNA,28S rRNA和18S rRNA和5S rRNA 3条带型清晰、整齐,很少有降解(用叶组织提取的总 RNA存在部分蛋白质污染),总RNA的28S rRNA亮度约为18S rRNA的2倍,同时没有发现DNA的污染;改良SDS法和改良异硫氰酸胍法提取的总RNA有28S rRNA 、18S rRNA 2条带,但亮度较差,带型不清晰,说明RNA产率很少且存在严重降解和带型弥散,可能是因为操作的时间较长导致,不适合苜蓿总 RNA的提取。从电泳图来看,CTAB法最适合苜蓿总RNA的提取。
本研究进一步对改良CTAB法和TRNzol试剂盒法下提取的总RNA进行凝胶电泳比较,结果如图2所示,改良CTAB法提取的效果最好,可以进行下一步分子生物学实验,而T RNzol试剂盒法存在部分蛋白质等杂质污染,虽然操作简便、省时,但使用前需要进一步纯化。
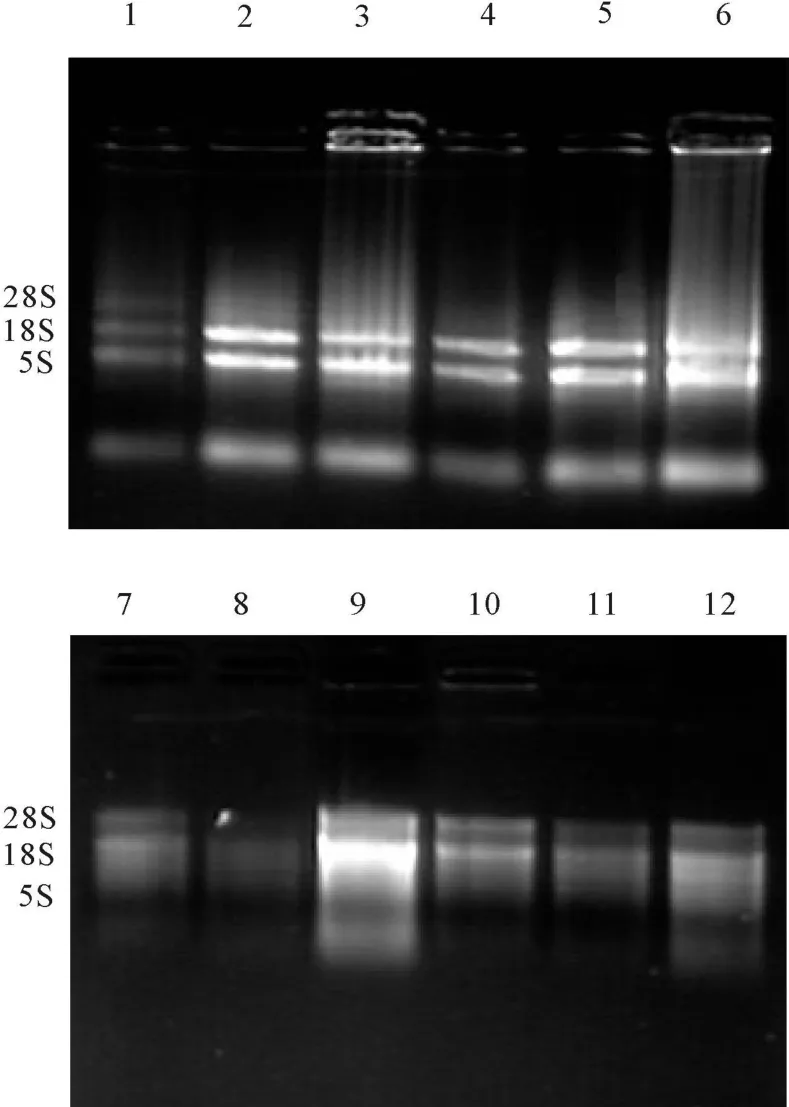
图1 不同方法下苜蓿总RNA(根、茎、叶)的凝胶电泳

图2 2种方法下苜蓿总RNA(根、茎、叶)的凝胶电泳
3 讨论与结论
3.1获得纯度高、完整性好的RNA是构建高质量cDNA文库、进行基因表达和功能鉴定等研究的前提[7]。苜蓿在生长过程中因生长环境胁迫而有着复杂的次生代谢,积累了大量的次生代谢物质,如多糖、异黄酮和皂甙类等小分子物质[8-9],它们容易与RNA共沉淀,对RNA的提取和纯化有干扰作用,从而影响总RNA的产率和纯度。因此,要获得完整和高纯度的 RNA是一项较为困难的工作。在改良CTAB法中加入酸性水饱和酚,可有效去除DNA污染,因为在酸性条件下,DNA一般存在于中间层(与蛋白和糖等共沉淀)或者在上层上清液中,尽量取最上层上清液可以有效去除 DNA杂质[10];本研究加入 3 mol/L NaAc(pH值为5.2)和预冷无水乙醇,可以有效去除微量Li+和Cl-,减少它们对RNA反转录和体外翻译的干扰;如果在改良CTAB法中采用7 mL离心管,可增加材料的使用量,更好地在转移足够的上清液时避免DNA污染;在提取过程当中直接加入饱和酚和氯仿异戊醇,减少了转移次数,避免了RNA酶的污染,为获得较高产率的苜蓿总RNA提供了保证[11]。
3.2改良CTAB法优点是成本低廉,且能够有效地去除样品中的蛋白质、多糖等物质,提取的RNA完整性好、纯度高;但步骤繁琐,有毒药品和试剂多,对人体影响大,而且要用 LiCl和饱和酚进行多次沉淀,进一步延长了抽提时间。TRNzol试剂盒法一步提取,快速简捷,所需试剂种类少,提取的RNA纯度和完整性均较好,缺点是价格昂贵,且只适于少量样品的提取,所得的RNA比较有限,不适合对RNA需求量大的研究[12]。本研究还发现,用T RNzol试剂盒提取RNA时,苜蓿的根和茎明显优于叶。改良SDS法和改良异硫氰酸胍法是从真核细胞中提取总RNA的常用方法,在许多植物中均可分离到高质量的RNA。但本研究发现,这2种方法不能有效地去除苜蓿样品中的蛋白质和多糖等物质,且均存在明显的降解和弥散现象,不适合苜蓿总RNA的提取。
3.3苜蓿抗性生理和分子生物学机制[13]、再生体系及基因工程[14-15]研究在苜蓿育种中起了重要作用,随着苜蓿基因组研究的兴起,提取完整性好、纯度高的高品质苜蓿总RNA,是开展苜蓿基因表达调控、抗性分子机制以及新基因挖掘等相关研究的前提,本研究针对根蘖型苜蓿高效RNA提取方法的总结,将为与苜蓿根蘖等优良性状相关的新基因克隆提供技术基础。
[1]法雷尔.RNA分离与鉴定实验指南[M].北京:北京化学工业出版社,2008.
[2]魏春红,李毅.现代分子生物学实验技术[M].北京:高等教育出版社,2006.
[3]刘君.乙烯利对麦冬光合作用的影响及相关基因的克隆[D].北京:北京林业大学,2008.
[4]刘春生,王文全.甘草不同器官RNA提取方法研究[J].北京中医药大学学报,2006,29(10):705-707.
[5]史宝胜,卓丽环.紫叶李叶片总RNA提取方法的改进与比较[J].分子植物育种,2006,4(5):721-725.
[6]何振艳,徐文忠,杨学习,等.提取蕨类植物蜈蚣草总RNA的一种有效方法[J].植物学通报,2005,22(2):198-202.
[7]印莉萍,刘祥林.分子细胞生物学实验技术[M].北京:首都师范大学出版社,2001.
[8]宋伟红,苗树君,史广德,等.苜蓿营养价值的影响因素及高效利用[J].中国牛业科学,2006,32(1):80-82.
[9]王彦华,王成章,史莹华,等.苜蓿多糖的研究进展[J].草业科学,2007,24(4):50-53.
[10]望飞勇,何勇,许本波,等.草坪植物 RNA提取方法的比较研究[J].长江大学学报,2007,4(1):56-60.
[11]何庆元,吴萍,李正鹏,等.苜蓿总RNA提取方法比较研究[J].中国草地学报,2009,31(1):116-119.
[12]李玉花.现代分子生物学模块实验指南[M].北京:高等教育出版社,2007.
[13]王玉祥,张博,王涛.盐胁迫对苜蓿叶绿素、甜菜碱含量和细胞膜透性的影响[J].草业科学,2009,26(3):53-56.
[14]马海燕,张博,郝兴明,等.苜蓿高效再生体系研究进展[J].草业科学,2005,11(30):30-35.
[15]李红,李波,王丽玲,等.紫花苜蓿耐羟脯氨酸变异体的筛选及抗性研究[J].草业科学,2008,25(10):29-33.
