干旱胁迫对苗期紫花苜蓿3种生理指标的影响
2010-07-25霍学敏呼天明杨培志孙伟泽韩云华
霍学敏,呼天明,杨培志,孙伟泽,韩云华
(西北农林科技大学动物科技学院,陕西 杨凌 712100)
紫花苜蓿Medicago sativa是我国干旱半干旱地区广泛种植的一种牧草,具有抗逆性强、产量高、品质好等诸多优点,是反刍动物的理想饲料,在我国的畜牧业发展和改善生态环境中起着非常重要的作用[1]。
干旱是造成苜蓿产量和品质下降的一个主要原因[2]。近年来有许多关于植物抗旱生理方面的研究[3-11],大多采用PEG处理的方法模拟干旱胁迫,但此方法同时也造成渗透胁迫。本试验首次采用了改良空气干旱法对苜蓿进行干旱处理,用试剂盒测定了丙二醛(MDA)含量、抗坏血酸(AsA)含量和过氧化物酶(POD)活性3项生理指标,以期了解苜蓿抗旱的生理机制,为苜蓿抗旱育种提供理论基础。
1 材料与方法
1.1 试验材料试验选用紫花苜蓿品种金皇后商品种子,浸于质量分数98%浓硫酸中1 h打破休眠,再用质量分数 5%次氯酸钠溶液消毒5 min,最后用蒸馏水冲洗至pH值中性。将处理后的种子摆放在直径12 cm的培养皿中(100粒/皿)于人工气候培养箱(ZPQ-350型)内20℃恒温连续暗培养3 d后再移入营养钵(内径9 cm,高9 cm)中继续培养。培养基质为河沙,培养液为1/4Hoagland营养液。幼苗培养于2008年12月在西北农林科技大学全自动PVC温室进行。
1.2 试验方法待苜蓿长出3~5片真叶时,用自来水洗出根,得到完整植株。用改良空气干旱法进行干旱处理:即用高级吸水纸将根部包起后悬于细铁丝上进行0、1.5、3、4.5和6 h的干旱处理(室内温度15℃,湿度55%~50%),每个时间点分别准确称取0.5 g地上部分和地下部分新鲜样品待测,重复3次。每份样品加入pH值7.4的磷酸缓冲液4.5 mL,冰浴研磨,8 000 r/min下低温离心15 min,取上清液测定其中的MDA含量、AsA含量和POD活性。指标测定均采用南京建成生物公司生产的试剂盒按说明书步骤操作,测定原理分别为硫代巴比妥酸(TBA)法、啡罗啉法和愈创木酚法。以每毫克组织蛋白每分钟催化产生1 μ g底物的酶量定义为一个酶活力单位(U)。
1.3 数据处理方差分析采用SPSS16.0软件;绘图采用Excel2003软件。
2 结果与分析
2.1 干旱胁迫对紫花苜蓿MDA含量的影响MDA是质膜过氧化作用的产物之一,其含量一般用来指示膜脂质过氧化的程度[12]。试验中苜蓿地上部分和地下部分的MDA含量均随着干旱时间的延长呈现逐渐增加的趋势(图1)。地上部分增加缓慢,6 h后才有显著变化;地下部分在干旱3 h内增加缓慢,3 h后急速增加,增加速率是之前的13倍,说明此时苜蓿根系已经受到一定程度的过氧化伤害,发生了脂质过氧化作用。干旱6 h,苜蓿地下部分的MDA含量达到最大,为14.54 μ mol/g。在整个干旱过程中,苜蓿地下部分的MDA含量始终高于地上部分,说明根部比地上部分对干旱更为敏感。
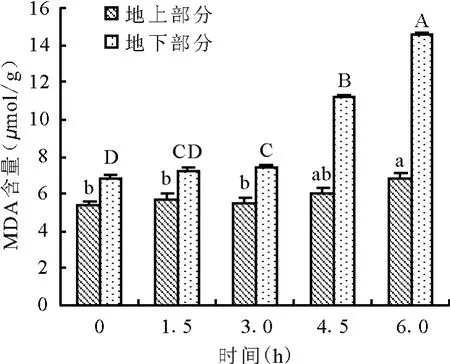
图1 干旱胁迫对紫花苜蓿MDA含量的影响
2.2 干旱胁迫对紫花苜蓿AsA含量的影响AsA在氧化胁迫防御中起重要作用,作为植物体内重要的抗氧化剂,它可通过多种机制来减少活性氧的量,一方面AsA能直接清除超氧阴离子、单线态氧、羟自由基和过氧化氢等活性氧,另一方面AsA能作为抗坏血酸过氧化物酶清除过氧化氢的电子供体,来间接地清除活性氧[13]。随着干旱处理时间的延长,苜蓿地上部分和地下部分的AsA含量均呈逐渐增加的趋势(图2)。干旱4.5 h,地上部分的AsA含量与对照相比有了显著增加;地下部分的AsA含量在3 h前增加缓慢,3 h后增加速率加大,是之前的6.35倍。说明此时苜蓿已经感受到由干旱引起的氧化胁迫,并启动了非酶系统来减轻自身的受害程度。整个过程中,地下部分的AsA含量始终高于地上部分,AsA含量显著增加的时间也短于地上部分,说明根系对干旱胁迫的反应较地上部分更为灵敏。
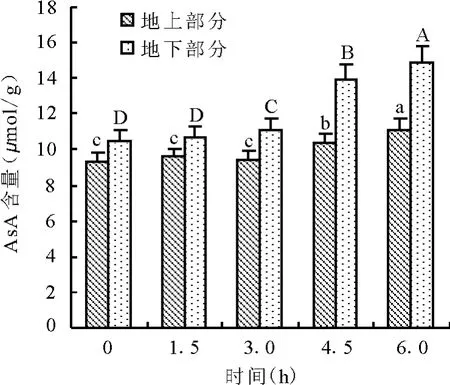
图2 干旱胁迫对紫花苜蓿ASA含量的影响
2.3 干旱胁迫对紫花苜蓿POD活性的影响POD是植物体内一种非常重要的保护酶,可以清除体内的过氧化氢和其他一些活性氧自由基,与其他一些保护酶(如SOD、CAT等)一起保护植物免受氧胁迫伤害。苜蓿地下部分的POD活性随着干旱时间延长呈现出先降低后升高的趋势,地上部分并未发生明显变化(图3)。干旱1.5 h,地下部分的 POD活性与对照相比下降了7.79%,但方差分析并不显著。之后一直呈上升趋势。3 h后上升速率加快,是之前的9.11倍,说明此时苜蓿根部已经感受到活性氧的胁迫并且启动了保护酶系统进行防御。干旱6 h后,POD活性达到最大,比对照增加了81.7%,说明此时正是POD发挥其清除自由基作用的黄金时期。

图3 干旱胁迫对紫花苜蓿POD活性的影响
3 讨论与结论
李文娆等[14]研究发现:紫花苜蓿叶片及根系MDA含量在胁迫初期未发生明显变化,但随着胁迫的延续而逐渐累积,根系MDA含量变化幅度明显大于叶片,与本试验研究结果一致。阿尔冈金叶片及根系的POD活性随着胁迫时间的延长而显著增强,叶片POD活性在胁迫12 h达到最大值,并保持较高活性,根系POD活性在胁迫24 h达到最大值后略有下降,而本试验结果显示苜蓿根部POD活性呈逐渐增加的趋势,地上部分POD活性则无明显变化。可能是干旱处理程度轻,时间短所致。王文斌等[15]研究发现:苜蓿芽中POD活性在氯化钠胁迫前后无显著变化,且明显低于根,认为其具有器官差异性,POD在根中比在芽中可能发挥着更为重要的作用,与本试验的研究结果一致。他们还发现芽中同工酶谱带少于根,各同工酶活性也较弱,认为由此导致芽中的POD活性明显低于根。
吕长平等[16]在对草莓Fragaria ananassa的研究中发现:随水分胁迫程度的加深,抗坏血酸含量不断降低,且抗旱性强的品种高于抗旱性中等和抗旱性弱的品种,其含量与抗旱性呈正相关。但也有研究[17]显示:植物在诸如臭氧、SO2高盐、低温和干旱等逆境中,体内的AsA含量至少会暂时的增加,其原因主要是由于AsA合成酶和再生酶活性的增强。本试验结果表明:在短时间的轻度干旱胁迫下,随着干旱时间的延长,紫花苜蓿地上部分和地下部分的AsA含量均逐渐增加,可能也与其合成酶与再生酶活性增强有关。
本试验(采用改良空气干旱法模拟干旱胁迫)所观察到的紫花苜蓿在干旱胁迫下3种生理物质的动态变化与前人[15,17-18]研究结果一致,说明改良空气干旱法模拟干旱胁迫效果明显且不产生渗透胁迫,可以作为一种模拟方法选用。
[1]陈文新.豆科植物根瘤菌-固氮体系在西部大开发中的作用[J].草地学报,2004,12(1):1-2.
[2]杨世琦,孙兆敏,杨雄平.发展苜蓿草产业促进西北干旱地区农业结构调整[J].西北农业学报,2003,12(4):157-160.
[3]吴洋,李清明,邹志荣,等.CO2浓度倍增和干旱胁迫对黄瓜幼苗叶片转化酶活性及糖代谢的影响[J].西北农林科技大学学报(自然科学版),2008,36(10):121-126.
[4]石永红,万里强,刘建宁,等.干旱胁迫对6个坪用多年生黑麦草品种抗旱性的影响[J].草地学报,2009,17(1):52-57.
[5]余玲,王彦荣,Garnett T,等.紫花苜蓿不同品种对干旱胁迫的生理响应[J].草业学报,2006,15(3):75-85.
[6]Pavet V,Olmos E,Kiddle G,et al.Ascorbic acid deficiency activates cell death and disease resistance responses in arabidopsis[J].Plant Physiology,2005,139:1291-1303.
[7]Antolin M C,Yoller J,Sanchez D M.Efforts of temporary drought on nitrate-fed and nitrogen-fixing alfalfa plants[J].Plant Science,1995,107:159-165.
[8]Shao H B,Chen X Y,Chu L Y,et al.Investigation on the relationship ofproline with wheatantidrought under soil water deficits[J].Colloids and Surfaces B:Biointerfaces,2006,53(1):113-119.
[9]王海宁,张建利,冯林,等.温度和干旱胁迫对3种牧草种子萌发的影响[J].草业科学,2009,26(8):87-92.
[10]唐红,孙吉雄,李福源,等.干旱胁迫对青海游憩草地质量的影响[J].草业科学,2009,26(6):159-165.
[11]万里强,石永红,李向林,等.高温干旱胁迫下三个多年生黑麦草品种叶绿体和线粒体超微结构的变化[J].草业学报,2009,18(1):25-31.
[12]陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989,6(4):211-217.
[13]马春花.干旱胁迫和衰老过程中苹果抗坏血酸代谢的研究[D].杨凌:西北农林科技大学,2007.
[14]李文娆,张岁歧,山仑.苜蓿叶片及根系对水分亏缺的生理生化响应[J].草地学报,2007,15(4):299-305.
[15]王文斌,金润熙,邓西平,等.苜蓿幼苗芽、根器官对盐胁迫的生理生化响应[J].西北农林科技大学学报(自然科学版),2009,37(5):217-223.
[16]吕长平,石雪晖,杨国顺,等.水分胁迫对草莓叶片SOD活性以及MDA和Vc含量的影响[J].湖南农业大学学报,1996,22(5):451-455.
[17]Davey M W,Van Montagu M,Inzé D,et al.Plant L-ascorbic acid:Chemistry,function,metabolism,bioavailability and effects of processing[J].Journal of the Science of Food and Agriculture,2000,80:825-860.
[18]贾根良,代惠萍,冯佰利,等.PEG模拟干旱胁迫对糜子幼苗生理特性的影响[J].西北植物学报,2008,28(10):2073-2079.
