鳕鱼皮水解蛋白亚铁修饰产物(Fe-FPH)结构及营养分析
2010-07-19吴卫平邓尚贵满德慧沈璐璐
吴卫平,邓尚贵,徐 涛,满德慧,唐 艳,黄 薇,沈璐璐
(1.浙江兴业集团有限公司,浙江舟山 316101;2.浙江海洋学院食品与药学学院、医院,浙江舟山 316000)
鳕鱼Gadous macrocephaius,大型冷水性重要经济鱼,名贵食用鱼,全球鳕鱼年捕获量达1 000万t,约占海洋渔业总产量的12%。鳕鱼产品有冷冻鱼片、鱼段、块冻鱼排等,加工过程中产生大量的下脚料,其中仅去除的鱼皮量约占原料的10%。目前,下脚料酶解利用[1-13]被各国广泛研究,但主要用于生产动物饲料,附加产值不高。蛋白铁肽[14]是以水解蛋白和蛋白质多肽吸收理论为基础研发的一种全新功能性食品,产品不仅实现了边角料高附加值利用的产业化问题而且针对人体营养学需要,利用螯合技术,蛋白铁肽中铁元素易于被人体吸收且释放过程能得到有效控制,在满足人体氨基酸需求的同时满足人体对铁的需要,可谓一举多得。本文对鳕鱼皮制取蛋白铁肽进行了研究,并对Fe-FPH进行了营养、结构和食品安全分析。
1 材料与方法
1.1 酶
木瓜蛋白酶(2 000 000 IU/g),食品级,广西南宁庞博生物工程有限公司出品;风味酶(400 000 IU/g),食品级,广西南宁庞博生物工程有限公司出品。2种酶复合后的最适宜水解条件为pH 6.5,45℃,复合比为1:1料液比为1:2,水解时间为4.5 h。复合酶失活条件为90℃、20 min。
1.2 原材料
鳕鱼皮(注意避免脂肪氧化),浙江海力生生物科技有限公司提供。原料清洗干净后分为两部分,一部分作为不脱脂的原料(FM,脂肪含量42.8 g/kg),捣碎匀浆后贮藏于-18℃备用;另一部分经过1 g/kg NaHCO3、1 g/kg NaCl和蒸馏水脱脂、捣碎和匀浆后贮藏于-18℃作为脱脂原料(DM,脂肪含量6.2 g/kg)备用。进行酶水解前,将原料取出并贮放于-4℃的冰箱中过夜。
1.3 工艺流程

1.4 螯合水解液的制备
原料加2倍体积的蒸馏水混匀,混合物的pH约为6.5。螯合水解液制备参照复合酶法[15],仅将复合比改为1:1。水解完成后,将混合液的温度升高到90℃并保持20 min灭酶,冷却至室温,用100目尼龙布过滤去掉未水解组分,然后8000 r/min条件下离心15 min去掉沉淀组分,然后采用截留分子量为6 ku的超滤膜进行超滤分离,收集超滤液并贮放于4℃条件备用。
1.5 螯合物的制备
在不断搅拌、不同的温度、不同的时间等条件下,向超滤液中连续加入1 mol/L FeCl2进行螯合修饰。通过双效浓缩,蒸发量1 000 kg/h,蒸汽压0.09 MPa,蒸发温度70℃,真空度-0.06 MPa,使总固型物达到30%;然后进行瞬时杀菌,杀菌温度130℃,蒸汽压力0.6 MPa,杀菌时间4 ~6 s,出料温度50 ~60℃;最后通过喷雾干燥得到样品,工艺为进料温度50 ~60℃,进风温度205℃,出风温度90 ~95℃。
1.6 分析方法
1.6.1 蛋白质水解度(DH)的测定

公式中h是已断裂的肽键数目,ht是原料蛋白质结构中总的肽键数目,A是水解物中总氨基氮数量(mg/g蛋白质),B是水解物中游离氨基氮数量,C是原料的游离氨基氮数量。B和C的具体数值可用电位滴定法测定。方法如下:
A 10 mL水解物转移到100 mL容量瓶用蒸馏水稀释,然后取20 mL稀释后溶液于200 mL烧杯,加60 mL蒸馏水,用0.05 mol/L NaOH边搅拌边滴定调节pH到8.2,再加入10.0 mL中性甲醛溶液,用0.05 mo1/L氢氧化钠标准溶液滴定至pH 9.2的体积(mL)。

式中:V1为样品稀释再加入甲醛后滴定至终点(pH 9.2)所消耗氢氧化钠标准溶液的体积(mL);V2为空白试验加入甲醛后滴定至终点(pH 9.2)所消耗氢氧化钠标准溶液的体积(mL);M为氢氧化钠标准溶液浓度(mol/L);0.014为氮的毫摩尔质量(g/mmol);m为测定用样品溶液相当于样品的质量(g)。
C用如上方法,仅用10.0 mL未水解物替换原水解物测定。
1.6.2 螯合率的测定
准确称取0.497 g FeSO4·7H2O,溶于100 mL蒸馏水中,加5 mL浓硫酸,微热,溶解后随即加入2%的高锰酸钾溶液至最后一滴红色褪去为止。用水稀释至1 000 mL,摇匀,得到标准溶液,此溶液每mL含100 μg铁。取10 mL此溶液于100 mL容量瓶加蒸馏水至刻度,摇匀,所得溶液每毫升含10 μg铁含铁分别吸取该溶液 0、1.0、2.0、3.0、4.0、5.0 mL 置于 50 mL 比色管。加 1 mL 1 mol/L 的 HCl,1 mL 10%的盐酸羟胺溶液,1 mL 0.12%的邻菲罗啉溶液(现配现用),再加5 mL 10%的醋酸钠溶液。用水稀释至刻度,摇匀,以空白做参比,于510 nm波长测吸光值,并作标准曲线。
每mL水解液实际铁添加量记作A,水解液经无水乙醇沉淀灰化处理后,转移至100 mL容量瓶,吸取5 mL溶液于比色管,测吸光值,参照吸光值计算Fe含量,结果为鳌合铁含量B。螯合率(CR)为:CR=B/A×100%,公式中A(g/kg)为样品中铁的总含量,B(g/kg)为样品中螯合铁的含量。
1.6.3 红外光谱测定
取样品2 mg放入玛瑙研钵中,放入干燥的光谱纯KBr 200 mg,混合研磨均匀(在红外灯下进行),使其粒度在2.5 μm以下,装入压片模具,抽气加压,压力约为60 MPa,维持3 ~5 min,卸掉压力则可得一透明的KBr样品片,利用岛津IR 435红外分光光度计进行定性分析,得到光谱。
1.6.4 氨基酸分析方法[20]
1)样品不经水解进行基本氨基酸分析;
2)样品分别经6 mol/L HCl和4.2 mol/L NaOH水解,然后进行基本氨基酸分析,仪器为日立835-50型高速氨基酸分析仪。
2 结果与讨论
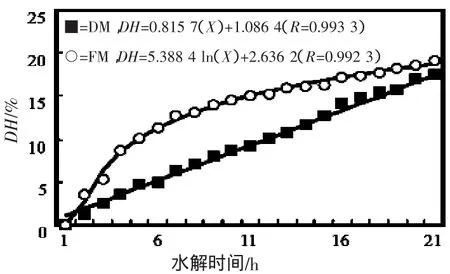
图1 DH与水解时间(X)关系Fig.1 Relationship between hydrolysis time and DH for different raw materials
2.1 原料脂肪含量对水解的影响
对于FM而言,其水解曲线包括了大量肽键被快速断裂的初始阶段(1 ~10 h)和仅有少部分肽键被切断的第二阶段(10 ~20 h),这种变化规律与沙丁鱼[21]、小龙虾[22]、鲱[23]和鲑[24]蛋白的酶水解曲线相似,并且在水解时间超过2 h后的水解过程中,其水解度显著高于DM(图1)。对于DM而言,其DH与水解时间的关系曲线呈现出典型的线性关系。2种原料在水解时存在的显著差异主要是因为脱脂处理也除去了DM的可溶性蛋白和内源酶。
2.2 最优条件确定
2.2.1 DH的确定
如图2所示,无论是FM还是DM在蛋白质水解度为5%时能达到最大螯合率。结果表明螯合所需要的蛋白质水解度为5%,此时的蛋白质水解物能够提供足够的配位数。
2.2.2 螯合pH的确定
如图3所示,无论是FM还是DM其螯合率在pH 4.0 ~7.0的范围内都随着pH的升高而迅速增加,当pH超过7.0时,螯合率迅速降低。在pH 4.0 ~7.0的范围内螯合率的迅速增加主要是因为水解物的-NH2和-COOH的配位能力得到增强,但当pH超过7.0时,Fe2+更容易与反应体系中的OH-结合而形成Fe(OH)2,阻碍了Fe2+与-NH2和-COOH结合形成螯合物。因此,螯合反应适宜的pH应选择为7.0。
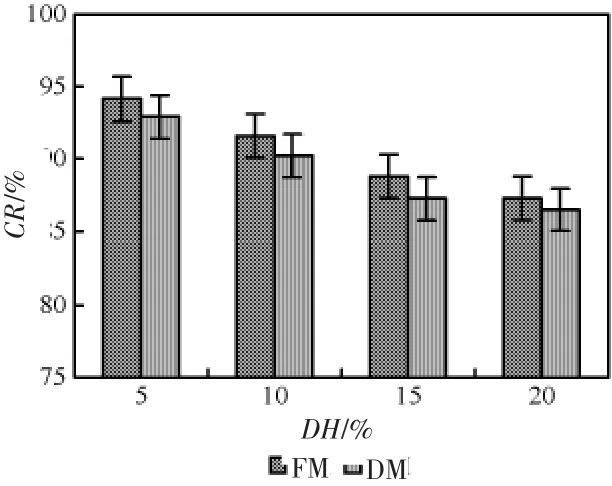
图2 不同处理样品水解度与螯合率的关系Fig.2 Relationship between different DH and CR for different raw materials

图3 螯合率与pH的关系Fig.3 Relationship between different pH and CR for different raw materials
2.2.3 螯合温度与螯合时间的确定
如图4和5所示,在温度为10 ~50℃、螯合时间为15 ~90 min范围内,螯合率没有明显的差异。表明螯合温度与螯合时间对螯合效果没有明显的影响。因此,本研究选择螯合温度为20℃、螯合时间为15 min。

图4 温度对螯合率的影响Fig.4 Relationship between different temperature and CR for different raw materials
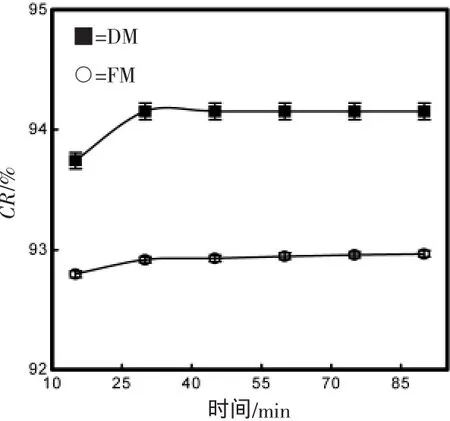
图5 螯合时间对螯合率的影响Fig.5 Relationship between different time and CR for different raw materials
2.3 螯合物的结构分析
如图6所示,活性肽与其鳌合物吸收峰相比,在强弱和位置上有明显的变化,样品在3 130 ~3 030 cm-1铵峰消失,而在1 100 cm-1左右出现了(PtNH2)吸收峰,证明Fe2+与NH2有较强结合;羧基离子反对称振动(γascoo-)于1 650 cm-1附近,羧基离子的对称振动(γascoo-)于1 400 cm-1附近,这两处均有较强吸收峰。反对称振动(γascoo-)是判断-COO-键共价程度的量度,而反对称振动与对称振动的差值γ△υ,是羧基离子与金属离了配位方式的有力判据。样品△υ均在250 cm-1左右,推测亚铁离了与羧基是以单齿共价键的方式结合如图7。

图6 活性肽(左)与蛋白铁肽(右)红外光谱比较Fig.6 Infra-red spectrum of FPH(L)and Fe-FPH(R)

图7 螯合物结构Fig.7 Structure of the Fe-FPH
2.4 氨基酸组成分析
经检测,样品主要以肽链形式存在,游离氨基酸总量占样品的2.595%游离氨基酸种类有苏氨酸、甘氨酸、丙氨酸、胱氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸8种,其中胱氨酸含量为1.054 g/100 g。水解后基本氨基酸组成及含量见表2。表3数据显示鳕鱼皮水解制品的氨基酸价达到理想氨基酸价的59.62%,鉴于原材料为鱼品加工下脚料,因此实现了变废为宝的目的。
2.5 食品安全分析
蛋白铁肽送浙江省海洋水产品质量中心检测,检测结果表明:产品符合食品安全要求,无致病菌检出,重金属等物质低于国家限量标准。另有研究表明蛋白肽有较强的抑菌效果,机制可能是螯合物的肽分子与细菌细胞膜受体蛋白结合,改变细胞质膜通透性,造成膜结构破坏,引起膜内水溶性物质大量渗出,从而导致细菌死亡。
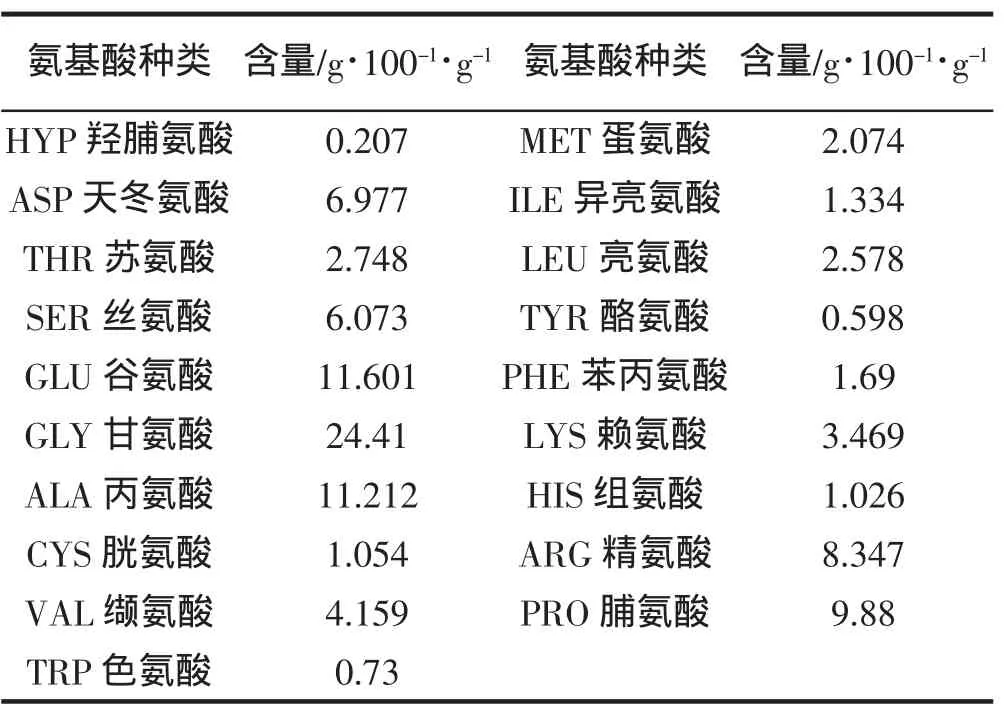
表1 蛋白铁肽氨基酸组成Tab.1 Amino acid composition of the Fe-FPH
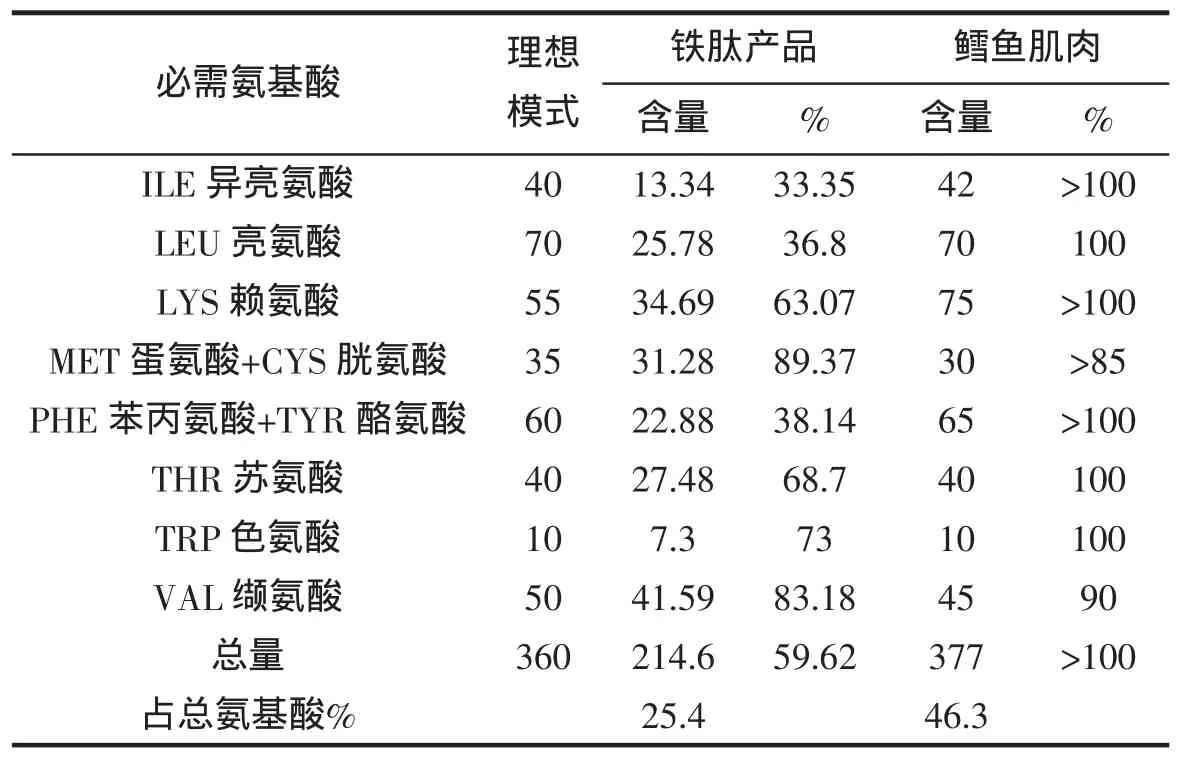
表2 蛋白铁肽产品氨基酸价分析Tab.2 Acid value analysis of the Fe-FPH
3 结论
低值鱼蛋白质复合酶水解曲线可表达为DH=5.388 4 ln(X)+2.636 2 (R=0.992 3,未脱脂)和DH=0.815 7(X)+1.086 4(R=0.993 3,脱脂 )。铁与酶水解物的螯合最适宜条件分别为DH 5%、pH 7.0、温度20℃和螯合时间15 min。样品通过红外光谱分析发现产品螯合稳定。样品基于机体可整体吸收肽分子的理论,根据结合于水解产物上的亚铁进入机体后具有缓慢释放的特性,以鳕鱼皮水解物为铁载体制取蛋白铁肽,克服了传统铁强化产品亚铁不稳定以及改变产品色泽的缺陷;还有效避免机体局部或某时间铁含量过高造成的不利影响,同时解决了水解产物的脱腥难题,经如上工艺获得的鳕鱼皮蛋白铁肽添加剂粗蛋白含量为85.1%,含铁40 254 mg/kg,氨基酸价为59.62,产品无危害致病菌,不仅达到了补铁要求,而且可作为营养品服用。不同调和配方的同类型产品如:鱼蛋白铁肽胶囊、鱼蛋白铁肽片剂、鱼蛋白铁肽冲剂等,大大拓展了产品的市场适应范围和人群适应范围。因此,产品研发成功不仅获得了一种优质保健产品,而且项目的大范围推广还可解决废料再利用和高值化问题,应用范围和经济效益前景颇为可观。
[1]TARR H L A.Possibilities in developing fisheries by-products[J].Food Techol,1948,2:268-277.
[2]FREEMAN H C,HOOGLAND P L.Processing of cod and haddock viscera:1.Laboratory experiments[J].J Fish Res Board Can,1956,13:869-877.
[3]McBRIDE J R,IDLER D R,MacLEOD R A.The liquefaction of British Columbia herring by ensilage,proteolytic enzymes and acid hydrolysis[J].J Fish Res Board Can,1961,18:93-112.
[4]SEN D P,SRIPATHY N V,LAHIRY N L,et al.Fish hydrolysates I:Rate of hydrolysis of fish flesh with papain[J].Food Technol,1962,16:138-140.
[5]HALE M B.Relative activities of commercial-available enzymes in the hydrolysis of fish protein[J].Food Technol,1969,23:107-110.
[6]HALE M B.Using enzymes to make fish protein concentrates[J].Mar Fish Rev,1974,36:15-19.
[7]MOHR V.Fish protein concentrate production by enzymic hydrolysis[M]//ADLER-NISSEN J.Biochemical aspects of new protein food.New York:Pergamon,1977:53-62.
[8]LANGMYHR E.Thesis,The Norwegian Technical University,Trondheim,Norway,1981.
[9]KRISTINSSON H G,RASCO B A.Fish protein hydrolysates:production,biochemical,and functional properties[J].CRC Crit Rev Food Sci Nutr,2000,40:43-81.
[10]KRISTINSSON H G,RASCO B A.Biochemical and functional properties of Atlantic salmon(Salmo salar)muscle proteins hydrolyzed with various alkaline proteases[J].J Agric Food Chem,2000,48:657-666.
[11]KRISTINSSON H G,RASCO B A.Kinetics of the hydrolysis of Atlantic salmon (Salmo salar)muscle proteins by alkaline proteases and a visceral serine protease mixture[J]..Proc Biochem,2000,36:131-139.
[12]LIASET B,LIED E,ESPE M.Enzymatic hydrolysis of by-products from the fish-filleting industry;chemical characterisation and nutritional evaluation[J].J Sci Food Agric,2000,80:581-589.
[13]JEON Y J,BYUN H G,KIM S K.Improvement of functional properties of cod frame protein hydrolysates using ultrafiltration membranes[J].Process Biochemistry,1999,35:471-478.
[14]DENG S G,PENG Z Y,CHEN F,et al.Amino acids composition and anti-anaemia action of hydrolyzed offal protein from Harengula zunasi Bleeker[J].Food Chemistry,2004,87(1):97-102.
[15]DENG S G,PENG Z Y,CHEN F,et al.Hydrolysis dynamics model of protein from Harengula zunasi by compound enzymes[J].J Zhanjiang Ocean University,2004,24(4):28-32.
[16]ZHAO H G,HUANG M R.Aquatic product inspection[M].1st ed.Tianjin:Tianjin Science and Technology Press,1987:165-166.
[17]OSAWA T,NAMIKI M.A novel type of antioxidant isolated from leaf wax of eucalyptus leaves[J].Agric Biol Chem,1981,45:735-73.
[18]OHKAWA H,OHISHI N,YAGI K.Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J].Anal Biochem,1979,95:351-358.
[19]HE N,WANG C L,GU X B,et al.Study on the optimization of the activity of lactobacillin with well test[J].J Tianjin Institute of Light Industry,1999,2:17-20.
[20]DENG S G.Study on Controlled Hydrolysis of Protein from Harengula zunasi Bleeker by Complicated Enzymes[Z].2004:32.
[21]QUAGLIA G B,ORBAN E.Enzymic solubilisation of proteins of sardine(Sardina pilchardus)by commercial proteases[J].J Sci Food Agric,1987,38:263-269.
[22]BAEK H H,CADWALLADER K R.Enzymic hydrolysis of crayfish processing by-products[J].J Food Sci,1995,60:929-934.
[23]HEVIA P,WHITAKER J,OLOTT H S.Solubilization of a fish protein concentrate with proteolytic enzymes[J].J Agric Food Chem,1976,24:383-390.
[24]HORDUR G K,BARBARA A R.Kinetics of the hydrolysis of Atlantic salmon(Salmo salar)muscle proteins by alkaline proteases and a visceral serine protease mixture[J].Process Biochemistry,2000,36:131-139.
[25]UCHIDA K,KAWAKISHI S.Sequence-dependent reactivity of histidine-containing peptides with copper(II):ascorbate[J].J Agric Food Chem,1992,40:13-16.
