解酯耶氏酵母产γ-癸内酯的研究进展
2010-07-17冯春利宋焕禄
冯春利, 任 清, 宋焕禄
(北京工商大学 化学与环境工程学院, 北京 100048)
γ-癸内酯(γ-decalactone, GDL)是一种含有五元内酯环的十碳化合物,分子式为C10H18O2,分子量为170.25[1],结构式如图1.

图1 γ-癸内酯结构式Fig.1 Structural formula of γ-decalactone
γ-癸内酯天然存在于桃子、草莓、椰子、芒果、杏、啤酒、朗姆酒中,也存在于乳制品的风味物质中,已在120多种食物的香气成分中发现了这种化合物. γ-癸内酯具有强烈的果香和奶油香气,稀释时有桃子香气[2]. 1969年,γ-癸内酯被美国食品药品管理局认定为安全的食品和药品添加剂[3],我国GB2760—86规定其为允许使用的食用香料. γ-癸内酯以其具有的诱人香气和低香气阈值(水中为0.08 mg/kg)等特性,在香料工业界得到广泛应用[4].
1 微生物发酵生产天然γ-癸内酯的机理
早在20世纪60年代,Wache等[5]在研究多种微生物的羟基酸代谢产物时就发现,某些微生物具有产生内酯的能力. 此后,生物技术学家就致力于选育高产内酯菌株. 目前,生产γ-癸内酯普遍采用的是生物转化的方法[6],虽然其机理尚未完全确定,但人们通常认为,菌体生产γ-癸内酯的前体物质为18个碳的不饱和羟基脂肪酸,通过β-氧化缩短碳链,经内酯化形成γ-癸内酯. 如解脂耶罗维亚酵母(Yarrowialipolytica),以蓖麻油中的主要成分蓖麻油酸(12-羟基-9-十八碳烯酸,在蓖麻油中的含量在80%以上)(如图2)为底物,经4次β-氧化使碳链缩短,再内酯化生成γ-癸内酯. 生物转化蓖麻油酸产生γ-癸内酯的机理如图3[7].
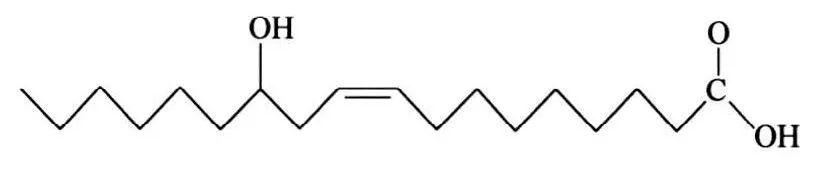
图2 蓖麻油酸(12-羟基-9-十八碳烯酸)结构式Fig.2 Structural formula of ricinoleic acid(12-hydroxy-9-octadecenoic acid)
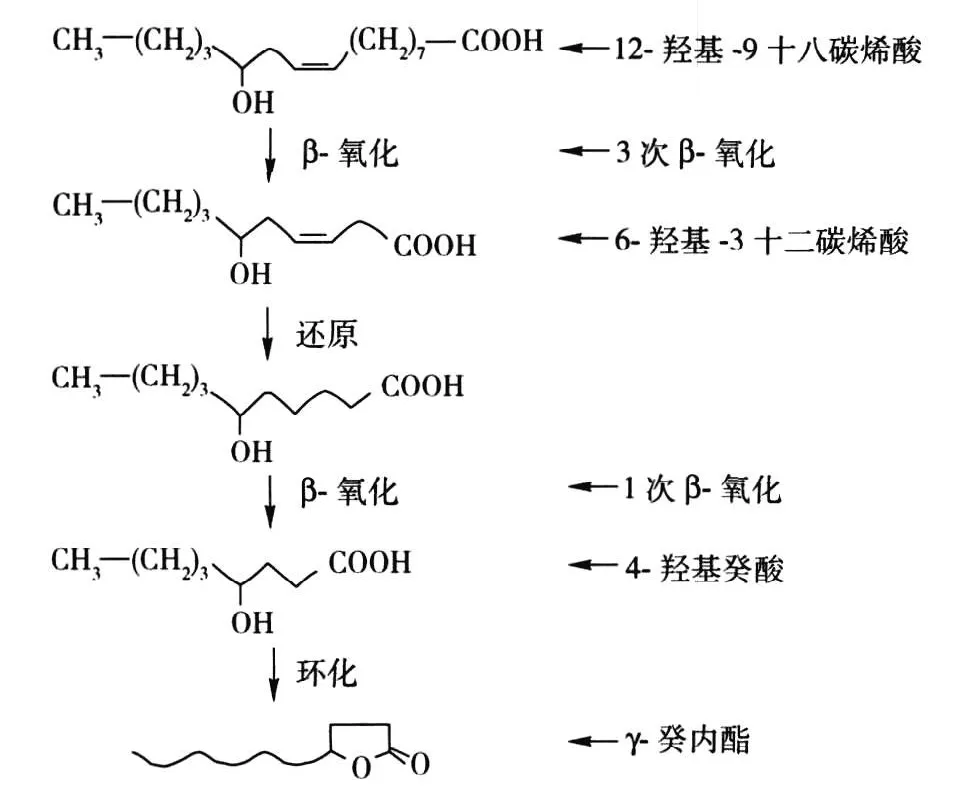
图3 生物转化蓖麻油酸生产γ-癸内酯机理Fig.3 Mechanism of production of γ-decalactone from castor oil acid by biotransformation
2 对发酵生产γ-癸内酯的Yarrowia lipolytica进行的基础性研究
目前一般选用以下菌种发酵产生γ-癸内酯:Yarrowialipolytica[8-11],Sporobolomycesodorus[12-13],Sporidiobolussalmonicolor[14-15],Sporidiobolusspp[16-18],Candidasorbophila,Sporidiobolusruinenii[19],Pichiaguilliermondi[20],Candidatropicalis.
大量实验发现,酵母Yarrowialipolytica非常适应疏水环境,在众多的可以产生γ-癸内酯的菌株中,酵母Yarrowialipolytica的能力是较强的[21]. 苏畅等[22]对SporidiobolusruineniiAs2.1577、SporidiobolussalomonicolorAs2.1482、As2.1550、As2.1574、As2.1603、YarrowialipolyticaAs2.1405、As2.1552这7株菌产生γ-癸内酯的能力进行了研究,结果发现,YarrowialipolyticaAs2.1405产生γ-癸内酯的能力最强,产率为1%.
王勇志等[23]也比较了YarrowialipolyticaAs2.1405、SporidiobolusruineniiAs2.1577、SporidiobolussalmonicolorAs2.1482、SporidiobolusodorusAs2.1574等4株菌的产γ-癸内酯能力,结果表明,YarrowialipolyticaAs2.1405在4株菌中产γ-癸内酯能力最强,可达到210 mg/L,而其他3株菌产γ-癸内酯能力相对较弱,只有YarrowialipolyticaAs2. 1405的1/10~1/4.
闫淑芳等[24]系统地对酵母Yarrowiasp.培养条件中蓖麻油添加时间、溶氧等因素进行了研究. 赵征等[25]对不同氮源、碳源、种龄、接种量、通气量、pH值、表面活性剂、温度、盐离子浓度对发酵的影响进行了研究,并确定了最适培养条件. Kalyani等[26]在2000年报道,通过改变发酵条件,经过96 h和48 h的表面和深层发酵可以分别获得455 mg/L和167 mg/L的γ-癸内酯.
3 Yarrowia lipolytica产γ-癸内酯相关基因的功能研究
过氧化物酶体β-氧化是在酵母将羟基脂肪酸转化为内酯这一生物转化过程中起重要作用的反应[11,27-28]. β-氧化是一个脂肪酸循环氧化的过程,包括3个酶参与的4步反应,代谢机理如图4[29]. 由图4可知,酰基-CoA氧化酶(Acyl-CoA oxidase)、3-酮酰-CoA硫解酶(3-ketoacyl-CoA thiolase)、双功能酶(bifunctional enzyme)是过氧物酶体β-氧化反应过程的3个很重要的酶,其中酰基-CoA氧化酶(Acyl-CoA oxidase)是β-氧化反应过程中的第一步催化酶,被普遍认为是限速酶,其活力高低与γ-癸内酯的产量有直接关系[30-31].

图4 过氧物酶体β-氧化反应及涉及到的酶Fig.4 Enzymes involved in peroxisomal β-oxidation reactions
Yarrowialipolytica中酰基-CoA氧化酶有5个同工酶Aox1-Aox5,分别由POX1-POX5基因编码[32]. Wache等[10]通过敲除其中一个或同时敲除数个POX1-POX5基因,初步研究了5个基因表达的同工酶对产γ-癸内酯的影响,如图5. 研究发现,长链特异性酰基-CoA氧化酶Aox2能够特异性地催化蓖麻油酸生产γ-癸内酯,而短链特异性酰基-CoA氧化酶Aox3的存在会使γ-癸内酯进一步降解,因此改善Yarrowialipolytica酵母产γ-癸内酯的量就围绕着POX3基因进行. Groguenin、Wache[10,33]等人在敲除掉POX3基因后,菌株γ-癸内酯产量提高了4.4倍. 从他们的研究中得知,短链特异性酰基-CoA氧化酶Aox3的活性还可能受到其他3个同工酶Aox1, Aox4, Aox5的影响.
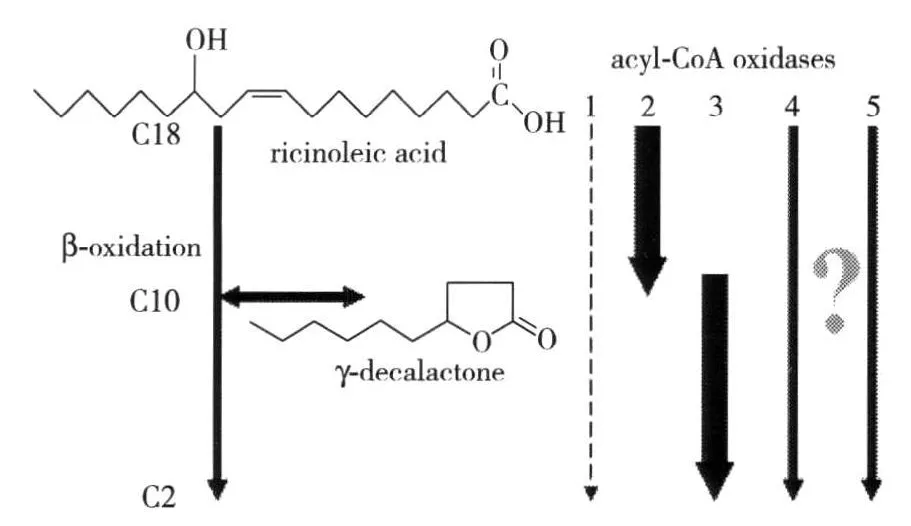
图5 同工酶Aox1-Aox5对生产γ-癸内酯的作用Fig.5 Role of isozyme Aox1-Aox5 on the γ-decalactone production
通过对POXs基因的敲除,Wache等[8,10,33]发现,鉴定其他3个同工酶(Aox1, Aox4, Aox5)的活性是很不容易的:POX1基因在敲除后几乎没有看到酰基-CoA氧化酶的活性有所改变,推测POX1基因对直链酰基-CoA无活性.POX5基因的破坏使得蓖麻油酸(C18)第一步降解受到了影响. 然而,POX4基因在敲除后没有发现对γ-癸内酯产量有大的影响.
为了确认这5个同工酶的活性或非活性,Groguenin、Wache等[10,33]同时敲除掉POX2,POX3,POX5(ΔPOX2、ΔPOX3、ΔPOX5)基因,并且对POX2基因进行多表达. 由于POX2基因的多倍复制的表达效率非常低,从而导致菌体生长受到了严重影响,虽然γ-癸内酯没有进一步降解,但是γ-癸内酯最终产量非常低. 这些结果的产生是由于缺乏了短链特异性酰基-CoA氧化酶Aox3的活性或者是由于降解的比率比生产的比率更低?这一问题至今仍然无法确知.
Nicaud等[34]认为,由于菌体在转化蓖麻油酸为γ-癸内酯的过程中仍然生长,导致了转化率的低下. 为证实此种解释,他们筛选出一株尿嘧啶缺陷型菌株,该营养缺陷型菌株在不含有尿嘧啶的培养基中转化蓖麻油酸甲酯,菌体生长受到了抑制,转化率比原菌株提高了10~20倍.
4 本研究组对构建高产γ-癸内酯的Yarrowia lipolytica的研究情况
4.1 通过对URA3基因的敲除提高γ-癸内酯产量
为了构建高产γ-癸内酯的营养缺陷型Yarrowialipolytica酵母菌. 首先利用基因同源重组的方法敲除掉尿嘧啶合成酶关键基因URA3基因,用尿嘧啶营养缺陷型培养基(SD-URA)添加一定浓度的5-氟乳清酸(5-FOA)和尿嘧啶筛选获得转化子. 得到的尿嘧啶营养缺陷型菌株,在不含有尿嘧啶的发酵培养基中,能够抑制蓖麻油酸的一个旁路代谢途径和细胞生长,使其转回内酯的合成途径,从而提高香味物质γ-癸内酯产量[34].
4.1.1尿嘧啶营养缺陷型菌株的培养基划线验证和分子生物学鉴定
提取营养缺陷型酵母基因组和野生型酵母基因组,用URA3基因上下游引物对其分别进行PCR扩增,并且在含有尿嘧啶20 μg/mL和5-FOA为1 mg/mL的(SD-URA)固体培养基上划线培养. 实验结果见图6、图7。
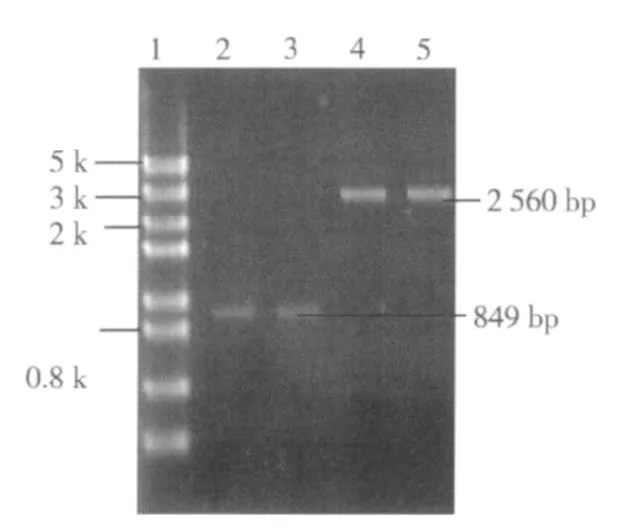
图6 营养缺陷型菌株的分子生物学验证Fig.6 Genetic defects in molecular biology-based authentication

图7 尿嘧啶营养缺陷型菌株的鉴定Fig.7 Identification of Uracil auxotrophic strain
由图6可知,营养缺陷型菌株进行URA3基因PCR扩增得到849 bp片段,而野生型菌株PCR扩增片段仍为2 560 bp. 图7左侧为野生型菌株,未生长,而右侧为获得的营养缺陷型菌株. 由此双重验证了基因敲除成功,构建出了尿嘧啶营养缺陷型菌株.
4.1.2原始菌株和缺陷型菌株的γ-癸内酯产量分析
出发菌株(缺陷型菌株和野生型菌株)生产采用摇床发酵,每隔8 h取样对其γ-癸内酯的产量进行检测,其产量与发酵时间的关系曲线见图8.

图8 野生型菌株和缺陷型菌株γ-癸内酯的发酵生产曲线Fig.8 Yield curve of γ-decalatone for wide-type and uracil auxotrophic strain
从图8可以看出,野生型菌株和缺陷型菌株γ-癸内酯的产量随着菌数增长而不断变化,缺陷型菌株γ-癸内酯的生产趋势和原始菌株的比较接近,但产量比原始菌体高出4.1倍,达到了1 032.9 mg/L.
4.2 敲除解酯耶氏酵母POX3基因提高γ-癸内酯产量
利用酵母本身的铜抗性基因CRF1作为筛选标记,敲除掉影响γ-癸内酯产量的关键基因POX3基因. 通过对转化子和野生型酵母菌目的基因进行PCR扩增,从而验证得到了敲除POX3基因的工业生产菌株.
4.2.1敲除POX3基因菌株(TA1)的分子生物学鉴定
分别提取转化子TA1和野生型酵母基因组,用POX3基因的上下游引物进行PCR扩增. 如图9所示,1,2道为野生型POX3-PCR; 3,4道为转化子POX3-PCR, 转化子不仅提高了铜抗性,而且POX3基因片段由1.97 k长度变为3.4 k长度,故POX3基因成功敲除.

图9 转化子TA1和野生型酵母的POX3-PCRFig.9 PCR verification of recombinant strain and wild type
4.2.2原始菌株和POX3基因敲除菌株(TA1)产γ-癸内酯量的分析
出发菌株(转化子和野生型菌株)采用摇床发酵,每隔8 h取样对其γ-癸内酯的产量进行检测,其产量与发酵时间的关系曲线如图10.

图10 野生型和POX3基因敲除转化子发酵产γ-癸内酯产量曲线Fig.10 Yield curve of γ-decalatone for wide-type and mutant strain TA1
野生型和TA1分别在57,63 h左右达到γ-癸内酯产量最大值,野生型γ-癸内酯产量最大为0.194 g/L,而敲除掉POX3基因后的转化子发酵产γ-癸内酯最大值达到了0.531 g/L.
5 结论与展望
目前,国外对产γ-癸内酯Yarrowialipolytica酵母菌的研究集中于POX1-POX5基因功能研究方面,且取得了较大进展,国内则主要集中在优化菌种的培养条件和培养环境(pH值和溶氧量)等基础研究上. 本实验室的研究目标更加明确,即敲除影响产量的短链特异性酶基因POX3, 构建营养缺陷型菌株,在提高产量的同时还可作为遗传筛选标记,从而为基因改良的进一步研究打好基础.
在下一步工作中,可以对5个同工酶基因的POX3和POX4基因进行敲除,同时构建POX2基因的单表达甚至多表达,从而获得更高产量的γ-癸内酯,可以将基因改造后的菌株进一步进行培养基和培养条件的优化设计,探索工业酵母生产途径,使之更好、更安全、更有效率地应用于工业生产.
