海带抗氧化多酚的制备及活性研究
2010-07-12徐银峰于春光罗红宇
徐银峰,于春光,王 斌,罗红宇
(浙江海洋学院食品与药学学院、医学院,浙江舟山 316004)
抗氧化剂是一类能帮助捕获并中和自由基,从而祛除自由基对人体损害的一类物质,其不仅可以能够防止油脂和食品氧化延长保质期,而且还有许多防病保健功能[1]。因此,抗氧化剂广泛用于食品工业,需求量逐年增加。由于合成抗氧化剂如植物酸(BHA)、2,6-二叔丁基对甲酚(BHT)和特丁基对苯二酚(TBHQ)等的毒性问题[2],以及人们越来越追求绿色环保消费,开发安全、高效的天然抗氧化剂成为食品工业的一项重大课题。
海藻是人类在食品、工业和药用方面的重要资源[3]。近年来,海藻中的次生代谢物质,如萜类、甾醇类、大环内酯类和酚类等已成为研究的热点,特别是多酚类物质因其所具有的抗氧化特性而备受瞩目[4-6]。目前,海带抗氧化活性物质的研究主要集中于海带多糖[7-11],而海带多酚抗氧化活性的研究相对较少。因此,本文以海带科植物日本海带Laminaria japonica为材料,详细研究了海带的提取物和萃取分段组分的体外抗氧化活性与多酚含量,并对活性测定方法的有效性进行了评价,为海带多酚的进一步开发利用提供依据。
1 材料与方法
1.1 材料
新鲜海带采自浙江舟山,取回后立即放入冰箱冷冻保藏。二苯代苦味酰基自由基(DPPH)、Folin-Ciocalteu试剂为Sigma试剂;邻二氮菲、铁氰化钾、三氯乙酸(TCA)、2,6-二叔丁基对甲酚(BHT)、没食子酸(GA)、硫酸亚铁、30%过氧化氢(H2O2)溶液、铁氰化钾、邻苯三酚等均为国产分析纯试剂。柱层析硅胶(200~300目)和GF254薄层层析硅胶板为青岛海洋化工厂生产;所用水均为二次双蒸水。
1.2 方法
1.2.1 抗氧化成分的提取[4]
称取新鲜海带200 g,室温下用1:1的氯仿:甲醇超声提取,过滤,滤渣同上重复提取2次,合并滤液,减压旋转蒸发溶剂得粗提物(MC),称重并计算产率。所得粗提物分散于水中,按1:1的比例依次用石油醚、乙酸乙酯和正丁醇萃取,每种溶剂萃取3次,合并萃取液,置于圆底烧瓶中,旋转蒸发去除溶剂,分别得到石油醚萃取物(PE)、乙酸乙酯萃取物(EA)、正丁醇萃取物(BuOH)和水残留物(Aqueous),称重并计算产率。
1.2.2 总酚含量的测定(Folin-Ciocalteu方法)[12]
取1 mL的提取物溶液用1.5 mL双蒸水稀释,加入0.5 mL 0.1 mol/L Folin-Ciocalteu试剂,混匀1 min后,加入1 mL 20%Na2CO3溶液,混匀后于37℃水浴中恒温30 min,750 nm波长处测定吸光度。利用没食子酸(GA)做标准曲线计算相应的总酚含量(mg GA/g样品提取物干重)。
1.2.3 海带提取物抗氧化活性测定
1.2.3.1 清除 DPPH 自由基的能力测定(DPPH 法)[13]
取海带提取液2 mL及1×10-4mol/L DPPH溶液2 mL加入同一具塞试管中摇匀,在室温下密闭静置30 min,用纯溶剂作参比,于517 nm波长下测定吸光度。根据下列公式计算每种提取液对DPPH自由基的清除率:
清除率=[1-(AS-ASB)/AC]×100%
其中:AS为加提取液后DPPH溶液的吸光度;ASB为提取液的吸光度;AC为未加提取液时DPPH溶液的吸光度。测定抗氧化剂BHT和GA对DPPH自由基的清除率作为对比。
1.2.3.2 清除羟自由基的能力测定(邻二氮菲-Fe2+氧化法)[14]
取浓度为0.75 mmol/L邻二氮菲溶液1 mL于试管中,依次加入2 mL 0.2 mol/L磷酸缓冲液(pH 7.40)、1 mL双蒸水,充分混匀后,加入1 mL浓度为0.75 mmol/L的FeSO4溶液,混匀,加入1 mL质量分数为0.12%的H2O2,37℃水浴90 min,于536 nm处测其吸光度为Ap;用1 mL双蒸水代替1 mL H2O2为Ab;用样品溶液代替1 mL的双蒸水为As。
样品对羟自由基清除率=(As-Ap)/(Ab-Ap)×100%
1.2.3.3 还原能力的测定(铁氰化钾还原法)[15]
取2 mL样品溶液于试管中,依次加入0.2 mol/L磷酸盐缓冲液(pH 6.6)2 mL、1% 铁氰化钾2 mL,充分混匀后在50℃保温20 min,加入2 mL 10%的TCA充分混匀,取出2 mL混合物于试管中,加入2 mL双蒸水和0.4 mL 0.1%FeCl3于试管中反应10 min,700 nm处测定吸光值,吸光值高表明还原力强。
1.2.3.4 超氧阴离子自由基体系(邻苯三酚自氧化法)[16]
取0.05 mol/L pH 8.2的Tris-HCl缓冲液 4.5 mL,置于25℃水浴中预热 20 min,分别加入 1 mL 试样和0.4 mL 25 mmol/L的邻苯三酚溶液,混匀后于25℃水浴中反应5 min,加入8 mol/L HCl 1.0 mL终止反应,以Tris-HCl缓冲液作参比,在299 nm处测定吸光度,计算清除率。空白对照组以1 mL试样溶剂代替样品,每个处理均做3个重复。清除率的计算公式:
超氧阴离子自由基清除率(%)=1([A1-A2)/A1]×100%
其中A1为空白的平均吸光度,A2为试样的平均吸光度。
2 结果与分析
2.1 海带各提取物的提取率
提取率是工业开发利用的一个重要参数,海带各提取物的产率见表1。结果表明由粗提物溶液经液-液分配所得到的4个萃取相的提取率大小顺序为:Aqueous>BuOH>PE>EA。
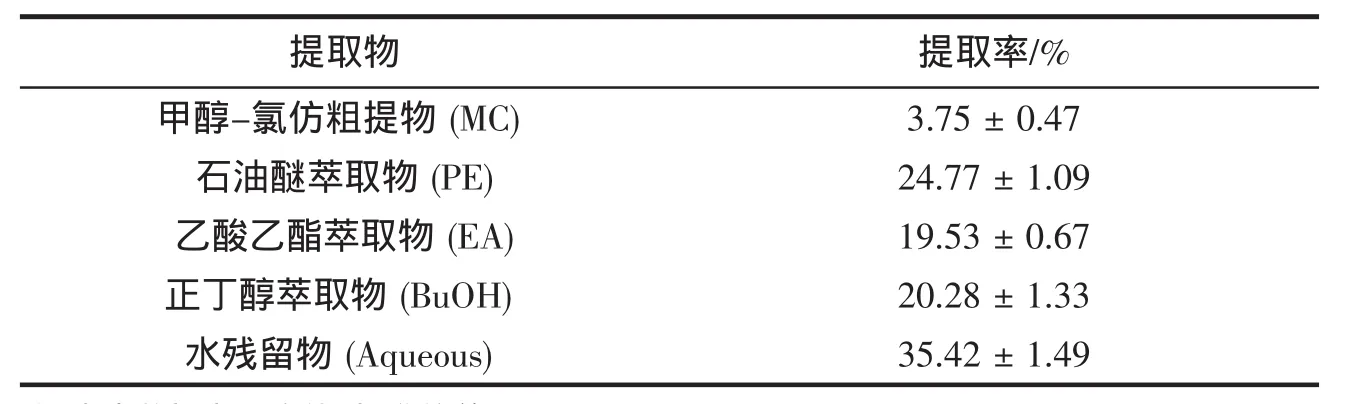
表1 海带氯仿-甲醇提取物的提取率(%海带干重)与萃取部分的提取率(%氯仿-甲醇提取物)Tab.1 Yield of total extract(as%w/w of seaweed on dry weight basis)and fractions(as%of total methanol/chloroform(1:1)extract)of L.japonica
2.2 海带各提取物的抗氧化活性
2.2.1 清除 DPPH 自由基的能力
DPPH在有机溶剂中是一种稳定的自由基,其结构中含有3个苯环,1个氮原子上有1个孤对电子,呈紫色,在517 nm有强吸收。有自由基清除剂存在时,DPPH的单电子被配对而使其颜色变浅,在最大吸收波长处的吸光度变小,而且这种颜色变浅的程度与配对电子数是成化学剂量关系的,因此可用于检测自由基的清除情况,从而评价实验样品的抗氧化能力。不同浓度的海带各提取物和抗氧化剂BHT和GA溶液的清除DPPH自由基的能力大小见表2。
表2结果表明MC对DPPH自由基有一定的清除作用,且其清除能力与浓度成量效关系。4种萃取物中,除了PE外,其它均具有良好的清除作用,其中EA最高,明显高于MC和抗氧化剂BHT的清除作用,且其清除能力也与浓度成量效关系。
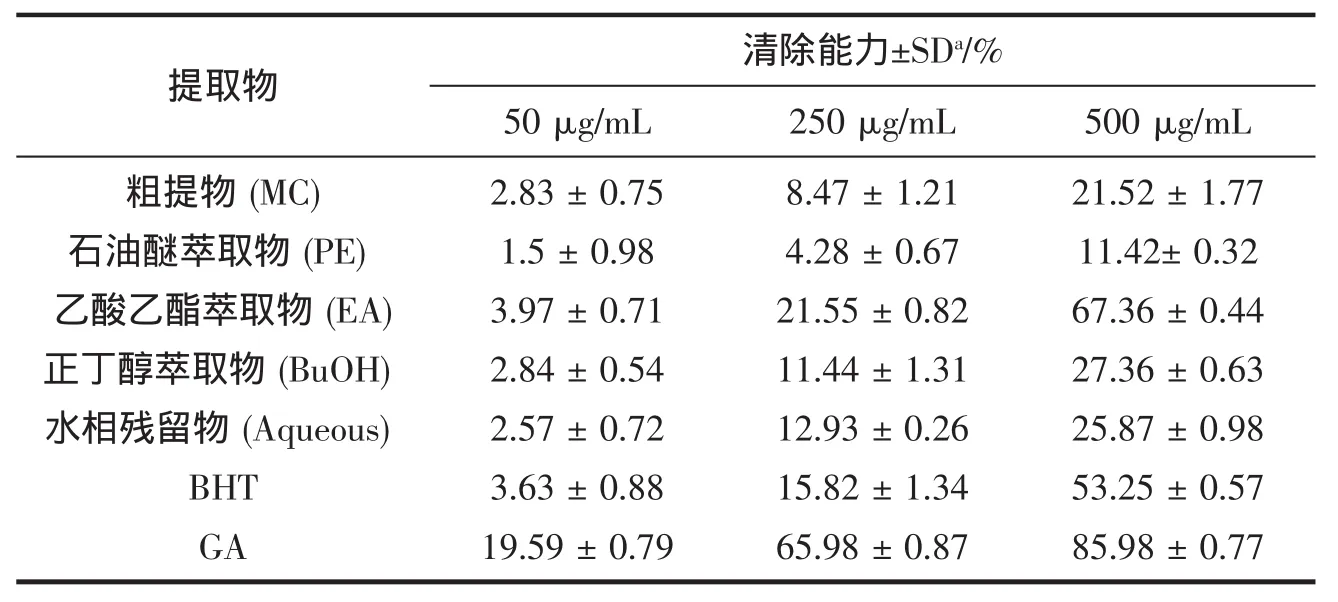
表2 海带提取物清除DPPH自由基的能力Tab.2 DPPH radical scavenging activity(%)of total extract and fractions from L.japonica
2.2.2 清除羟自由基的能力
Fenton反应生成羟自由基,促使邻二氮菲-Fe2+被氧化为邻二氮菲-Fe3+,造成其水溶液在波长510 nm处最大吸收消失,来测算其清除率。表3所列数据表明MC对羟自由基有较强的清除作用,其清除能力与浓度成量效关系。4种萃取物中,EA和Aqueous在所有测定浓度下均高于GA且其清除能力与浓度成量效关系,且EA萃取物在所有测定浓度下均高于BHT的清除能力。
2.2.3 还原能力

表3 海带提取物清除羟自由基的能力Tab.3 Hydroxyl radical-scavenging activities(%)of total extract and fractions from L.japonica
还原能力测量法的原理是铁氰化钾[K3Fe(CN)6]与样品反应,将铁氰化钾还原为亚铁氰化钾[K4Fe(CN)6],K4Fe(CN)6再与 Fe3+作用生成普鲁士蓝,在700 nm波长测定吸光值,吸光值愈高表示还原能力愈强。从表4可以看出MC具有较强的还原能力且与浓度成量效关系。4个萃取物中,除了PE外,其它均具有良好的还原能力,而EA明显高于MC及其它萃取相,比抗氧化剂BHT略强,但是还原能力明显低于GA。

表4 海带提取物的还原能力Tab.4 Reducing power(%)of total extract and fractions from L.japonica
2.2.4 超氧阴离子自由基体系
邻苯三酚在碱性条件下发生自氧化反应,产生稳定浓度的超氧阴离子自由基O2-与中间物,中间物又与超氧阴离子自由基O2-反应,得到一种带有颜色的中间产物,此物对紫外线有一定的吸收能力,引起某一波长处吸光值的线性积累,来反应抗氧化剂清除能力的大小。表5表明MC对O2-有较强的清除作用,其清除能力与浓度成量效关系。4种萃取物中,除了PE外,其它均具有良好的清除作用,其中EA明显高于MC及其它萃取相,且高于抗氧化剂BHT和GA清除O2-的能力。而Aqueous组分清除O2-的能力也高于抗氧化剂BHT。

表5 海带提取物的体外清除O2-的作用Tab.5 The scavenging effect(%)on O2-of(%)of total extract and fractions from L.japonica
2.3 海带提取物的总酚含量与抗氧化活性的分析
表6表明粗提物和4种萃取物均含有一定量的酚类成分,其中 EA 总酚含量最高(36.5 mg/g),而 PE 含量最低(11.3 mg/g),该结果与海带提取物与萃取分段部位的抗氧化作用相一致,表明酚类成分是提取物中抗氧化成分的重要组成部分。

表6 海带提取物和萃取分段部位多酚含量(mg GA/g海带提取物干重)Tab.6 Phlorotannin content of total extract and fractions from L.japonica
2.4 海带提取物体外抗氧化活性方法的相关性分析
4种方法测定的海带提取物的抗氧化活性的相关性分析如表7所示,结果表明4种方法测定的海带提取物用量与抗氧化活性之间均具有较好的相关性。其中,提取物清除DPPH自由基能力的相关性最高(R=0.987),其次是清除O2-能力的相关性(R=0.982),而总提取物与还原能力的相关性最差(R=0.946),因此 DPPH 法是测定海带抗氧化活性量效关系最合适的方法。

表7 海带提取物体外抗氧化活性方法的相关性分析Tab.7 Correlation between phlorotannin contents and antioxidative activities of extractions from L.japonica
3 结论
(1)在海带的氯仿-甲醇粗提物(MC)、石油醚萃取物(PE)、乙酸乙酯萃取物(EA)、正丁醇萃取物(BuOH)和水残留物(Aqueous)中,EA有最强的DPPH自由基、羟自由基和超氧阴离子自由基的能力和最强的还原能力,且其清除能力与浓度成量效关系。
(2)总酚含量与海带各提取物的抗氧化活性之间具有一定的相关性,因此,多酚类物质可能是海带各提取物的主要抗氧化成分之一。
(3)4种方法测定的海带各提取物的抗氧化活性的灵敏度分析表明4种方法测定的海带各提取物用量与抗氧化活性之间均具有很好的相关性,且DPPH法是测定海带抗氧化活性的最有效的方法。
[1]万素英,赵亚军,李 琳.食品抗氧化剂[M].北京:中国轻工业出版社,1998:212-224.
[2]GORDAN M H.Dietary antioxidants in disease prevention[J].Natural Product Reports,1996,13(4):265-273.
[3]纪明侯.海藻化学[M].北京:科学出版社,1997.
[4]WANG Bin-gui,ZHANG Wei-wei,DUAN Xiao-juan,et al.In vitro antioxidative activities of extract and semi-purified fractions of the marine red alga,Rhodomela confervoides(Rhodomelaceae)[J].Food Chemistry,2009,113(4):1 101-1 105.
[5]DUAN X J,ZHANG W W,LI X M,et al.Evaluation of antioxidant property of extract and fractions obtained from a red alga,Polysiphonia urceolata[J].Food Chemistry,2006,95(1):37-43.
[6]CHANDINI S K,GANESAN P,BHASKAR N.In vitro antioxidant activities of three selected brown seaweeds of India[J].Food Chemistry,2008,107(2):707-713.
[7]张全斌,于鹏展,周革非,等.海带褐藻多糖硫酸酯的抗氧化活性研究[J].中草药,2003,34(9):824-826.
[8]赵 雪,薛长湖,王静凤,等.海带岩藻聚糖硫酸酯低聚糖对小鼠肝损伤的保护作用[J].中草药,2003,25(3):286-289.
[9]梁桂宁,谢 露,胡世凤,等.海带多糖对应激小鼠肾组织抗氧化能力的影响[J].现代医药卫生,2006,22(18):2 783-2 984.
[10]朱海波,王长海,郑秋生.海带多糖对四氯化碳致小鼠肝损伤的保护作用[J].烟台大学学报:自然科学与工程版,2008,21(3):204-208.
[11]李兆杰,薛长湖,陈 磊,等.低分子量海带岩藻聚糖硫酸酯的清除活性氧自由基和体内抗氧化作用[J].水产学报,2001,25(1):64-68.
[12]VELIOGLU Y S,MAZZA G,GAO L,et al.Antioxidant activity and total phenolics in selected fruits,vegetables,and grain products[J].Journal of Agricultural and Food Chemistry,1998,46:4 113-4 117.
[13]张尊昕,杨伯伦,刘谦光,等.野葛根异黄酮成分的超声萃取及抗氧化作用[J].食品科学,2002,23(5):31-33.
[14]金 鸣,蔡亚欣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-556.
[15]DORMAN H J D,KOSAR M,KAHLOS K,et al.Antioxidant properties and composition of aqueous extracts from Menthaspecies,hybrids,varieties,and cultivars[J].Journal of Agricultural and Food Chemistry,2003,51:4 563-4 569.
[16]徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,1991:502-504.
