八氢番茄红素合成酶(PSY2)基因果实特异表达载体的构建
2010-06-29刘顺枝朱雪娇杨礼香王小兰
刘顺枝,朱雪娇,杨礼香,王小兰
(广州大学生命科学学院,广东广州,510006)
番茄红素是一种重要的类胡萝卜素,它广泛存在于水果及蔬菜中,在番茄、杏、番石榴、西瓜、番木瓜、红葡萄柚、红肉脐橙中均含有较多的番茄红素,尤以番茄中的含量为最高。八氢番茄红素合成酶(PSY)是植物类胡萝卜素生物合成途径中促进番茄红素合成的上游的关键酶,催化两分子的GGPP缩合形成八氢番茄红素,PSY基因最早在番茄中分离鉴定,目前从番茄中分离得到PSY1和PSY2,其中,PSY1基因在番茄果实和花中特异性表达,而PSY2基因则主要在番茄叶片中表达[1]。除番茄和玉米外,现已分离出PSY基因的植物还有辣椒(X68017)、拟 南 芥 (L25812)、 番木瓜 (ABG72805)、 枸杞(AAW88383)、葡萄柚(AF152892)等。 近年来,番茄红素的抗氧化活性的发现,以及在流行病学研究中Lyp浓度与前列腺癌、食道癌、胰腺癌、胃肠癌、乳腺癌、膀胱癌等的发生率呈负相关,引起了科研人员的密切关注[2]。植物番茄红素基因工程取得了可喜的进展。Burkhardt等[3]将黄水仙PSY基因在水稻胚乳特异性启动子控制下进行过量表达,结果获得胚乳中积累八氢番茄红素的稻米。Bramley等[4]将番茄PSY基因反义导入番茄,结果GGPP积累,而类胡萝卜素含量大大下降,表明PSY基因在番茄类胡萝卜素合成中起到了限速作用。PSY是番茄红素生物合成途径中的第一个关键酶,通过基因工程手段克隆其编码基因成为基因育种改变植物中番茄红素含量的首选目的基因。目前,番茄PSY2基因已经克隆,但尚未见到有人通过PSY2蛋白在植物果实中特异表达进而改善果实品相达到改良番茄品质的研究报道。本研究拟构建PSY2基因的番茄果实特异性启动子植物表达载体,转化根瘤农杆菌,为进一步转化番茄,获得番茄红素含量高,且表达PSY2蛋白的番茄果实打下一个良好的基础。
1 材料与方法
1.1 试验材料
番茄(Lycopersicon esculentumcv)“华丰”品种种子由广州市蔬菜研究所邱漫宇副研究员惠赠。大肠杆菌E.coliDH5α、农杆菌LBA4404、EHA105和植物表达载体pBI101.2由华南植物园张美实验室提供。克隆载体质粒pMDl8-T、PrimeScriptTMOne Step RT-PCR Kit Ver.2、Taq DNA 聚合酶、T4 DNA连接酶、限制性内切酶、TRIzol试剂盒购自TaKaRa公司,DNA纯化回收试剂盒及其他相关试剂购自上海生工生物工程技术有限公司。
1.2 试验方法
①PSY2基因和质粒pBI101.2重组载体的构建。a.PSY2基因的引物设计。根据已发表的番茄PSY2基因序列EF534739,用生物软件DNAStar设计了该基因的上下游引物(由上海生工合成,分别命名为PSY2F,PSY2R),分别引入BamHⅠ和SacⅠ限制性酶切位点,引物序列如下。

b.RT-PCR扩增目的基因PSY2。利用Takara的试剂盒(PrimeScriptTMOne Step RT-PCR Kit Ver.2),本试验采用王小兰等[5]的方法提取番茄幼苗总RNA,并以此为模板进行RT-PCR反应,反应产物通过1%琼脂糖凝胶电泳检测并切胶回收。
c.PSY2基因和pBI101.2的连接、筛选及鉴定。回收后的PSY2基因和pBI101.2质粒分别用BamHⅠ和SacⅠ双酶切后,切胶回收酶切后的pBI101.2质粒大片段和PSY2基因片段,通过T4 DNA连接酶16℃连接过夜。将连接产物转化到大肠杆菌E.coliDH5α菌株中,挑取Kan抗性克隆进行BamHⅠ和SacⅠ双酶切验证。将验证成功的重组质粒送上海生工进行序列测定,连接正确的重组质粒命名为pBIPSY2。
②番茄E8启动子与重组质粒pBIPSY2的连接。a.番茄E8启动子的引物设计。根据Deikman等[6]报道的番茄Cherry种的果实特异性E8启动子序列,用生物软件DNAStar设计2条PCR引物,分别为 E8F:5′GCAAGCTTA GGAATTTCACGAAATCG3′引入 HindIII酶切位点;E8R:5′CGGGATCCTCTTT TGCACTGTGAATGAT3′引入BamHⅠ酶切位点。
b.PCR扩增番茄E8启动子。采用CTAB法提取番茄基因组DNA,并以此为模板进行PCR。反应产物通过电泳检测并切胶回收。
c.E8启动子与克隆载体pMDT-18的连接。将pMDT-18载体与回收的E8片段16℃反应过夜,连接产物转化E.coliDH5α,涂布在含Amp的LB培养基上,挑选单菌落于LB液体培养基中,37℃培养过夜,少量抽提质粒,用于PCR鉴定。并命名为pMDTE8。
d.E8启动子和pBIPSY2的连接、筛选及鉴定。将构建好的pMDTE8和pBIPSY2质粒分别通过HindIII和BamHⅠ双酶切后,切胶回收pBIPSY2质粒大片段和E8启动子片段,通过T4 DNA连接酶16℃连接过夜。将质粒转化到大肠杆菌E.coli DH5α菌株中,对Kan抗性克隆进行PCR验证,将PCR验证成功的重组质粒送上海生工进行序列测定,连接正确的重组质粒命名为pBEPSY2。
③重组质粒pBEPSY2转化农杆菌。从大肠杆菌 E.coliDH5α菌株中提取 pBI101.2、pBEPSY2质粒,采用冻融法将其转化入根瘤农杆菌中,挑取抗Kan和Gent的克隆,以提取的质粒为模板,进行PCR验证。
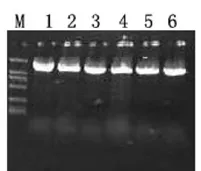
图1 番茄PSY2基因的RT-PCR产物电泳图谱
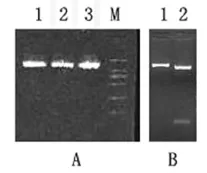
图2 pBIPSY2的PCR鉴定图谱A及pBIPSY2的酶切鉴定图谱B
2 结果与分析
2.1 pBIPSY2质粒的构建
①目的基因PSY2的扩增 利用引物(PSY2F和PSY2R),以番茄幼苗总RNA为模板,进行逆转录扩增,得到一如图1所示的条带特异,大小约1.5 kb的基因。
②目的片段PSY2与表达载体pBI101.2的连接 将RT-PCR扩增后得到的目的片段进行电泳、切胶回收,然后将分别用限制性内切酶BamHI和SacI完全酶切的PSY2目的片段与pBI101.2进行连接、转化、筛选。将PSY2基因与pBI101.2质粒连接转化后得到重组植物表达载体用引物PSY2F和PSY2R扩增,得到如图2A所示,所挑选的克隆均扩增出约1.5 kb的产物;进一步经BamHI和SacI酶切鉴定,结果如图2B所示,与未酶切的质粒(2B中的1号点样孔)对比可知,酶切的载体有两个片段,说明载体pBI101.2插入了外源片段。测序结果表明,我们插入的目的片段是一全长1 446 bp,包含一个1 224 bp完整阅读框的PSY2基因,证明目的片段PSY2与表达载体pBI101.2连接成功。
2.2 E8启动子与重组表达载体pBIPSY2的构建
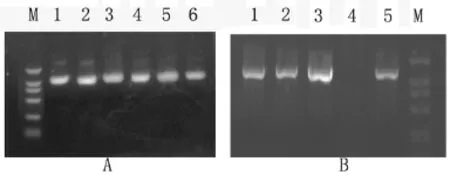
图3 果实特异性E8启动子重组质粒PCR鉴定图
①E8启动子片段的扩增 以CTAB法提取的番茄基因组DNA为模板,PCR法扩增E8启动子片段,经1%琼脂糖凝胶电泳,得到一个1 100 bp左右的电泳条带,如图3A所示,条带清晰特异。为使接下来的克隆继续进行,首先将扩增得到的E8启动子与T载体进行连接,经筛选、测序后证明,扩增的序列与Deikman等[6]报道的番茄果实特异性E8启动子序列完全一致,说明启动子区在不同品种中是高度保守的。根据E8引物设计时加入的限制性内切酶BamHI和HindIII,将E8片段从重组T载体上切下来,与同样经限制性内切酶BamHI和HindIII切除35S启动子的重组植物表达载体pBIPSY2进行过夜连接,经转化,PCR筛选,如图3B所示,得到含有E8片段的阳性克隆,说明E8启动子区已成功连接入植物表达载体pBIPSY2中,我们命名为pBEPSY2。将pBI101.2、pBEPSY2质粒采用冻融法分别转化根瘤农杆菌感受态细胞,挑取抗Kan和Gent的克隆提取质粒后进行PCR验证。保存pBI101.2和pBEPSY2质粒成功转化的根瘤农杆菌LBA4404和 EHA105。
3 小结与讨论
植物启动子在植物发育的时空调控中有着十分重要的作用。目前,普遍应用的植物启动子是能启动外源基因在植物细胞中有效表达的组成型强启动子CaMV35s,但是这类启动子调控的基因表达既没有组织特异性,也不受发育时期的影响,而组织特异性表达启动子,不仅可以提高外源基因的表达量,有目的地调节转基因植物果实的发育或种子的营养或改善其品质。E8启动子是Lincoln等[7]于1987年发现的番茄果实特异性启动子,它是乙烯应答性基因的启动子,Deikman等[6]通过试验证实-409~-263 bp可控制E8基因在果实成熟过程中特异表达。因此,选择包含-409~-263 bp在内的1 100 bp的E8启动子调控区进行基因表达的调控,理论上对于番茄品质的改良是可行的。事实上,已有的试验也证明E8启动子能引导目的基因在番茄等果实中高效地定向表达,是一种新型的果实特异性启动子。Fraser等[8]将Erwinia uredovor的八氢番茄红素合成酶CrtB基因导入番茄,在果实特异性启动子的调控下,发现果实中番茄红素较之于对照提高了1.8倍;Krasnyanski等[9]将E8启动子与报道基因uidA相连,导入番茄中,通过对T0,T1植株果实和叶子中β-葡糖醛酸糖苷酶活性的分析,发现E8控制的uidA基因只在番茄果实里表达。这些早期的试验为今后作物类胡萝卜素品质改良提供了良好的典范。
番茄是我国重要的果菜之一,但生态环境的改变以及城市工业进程加快,致使产区引种的番茄品种,其适应性与抗病性也每况愈下。青枯病是严重为害多种茄科植物的一种细菌性病害,国内外对蔬菜青枯病的防治作了大量的研究,但在抗病育种工作中,还存在着抗病性与产量、品质等优良性状的矛盾以及抗性丧失等问题,八氢番茄红素合成酶是植物类胡萝卜素生物合成途径中促进番茄红素合成的上游的关键酶,从理论上说,将该酶基因从植物体内克隆出来,构建超量表达载体,再转移到植物中去,通过基因工程的手段可以提高植物番茄红素的含量,增加植物产品的营养品质。本研究针对广州市农业蔬菜所获得的对青枯病产生强抗但在番茄果实成熟后期颜色不转变这一现象,构建果实特异表达启动子调节的PSY2基因的表达载体,以期利用基因克隆的手段,增加番茄果实中番茄红素的含量,改善番茄品相,为获得商品化的抗青枯病品种奠定基础。
[1]朱长甫,陈星,王英典.植物类胡萝卜素生物合成及其相关基因在基因工程中的应用[J].植物生理与分子生物学学报,2004,30(6):609-618.
[2]李京,惠伯棣,裴凌鹏.番茄红素——被关注的功能因子[J].食品科学,2005,26(8):461-464.
[3]Burkhardt P K,Beyer P,Wunn J,et al.Transgenic rice(Oryza sativa)endosperm expressing daffodil(Narcissus pseudonarcissus)phytoene synthase accumulates phytoene,a key intermediate of provitamin A biosynthesis[J].Plant J,1997,11(5):1 071-1 078.
[4]Bramley P.Regulation of carotenoid formation during tomato fruit ripening and development [J].J Exp Bot,2002,53(377):2 107-2 113.
[5]王小兰,刘顺枝,姚焱,等.水稻OsWNK基因超量表达载体的构建及转化[J].广州大学学报:自然科学版,2009,8(4):31-34.
[6]Deikman J,Kline R,Fischer R L.Organization of ripening and ethylene regulatory regions in a fruit specific promoter from tomato[J].Plant Physiol,1992,100:2 013-2 017.
[7]Lincoln J E,Cordes S,Read E,et al.Regulation of gene expression by ethylene duringLycopersicon esculentum(tomato)fruit development[J].Proc Natl Acad Sci USA,1987,84(9):2 793-2 797.
[8]Fraser P D,Romer S,Shipton C A,et al.Evaluation of transgenic tomato plants expressing an additional phytoene synthase in a fruit-specific manner[J].Proc Natl Acad Sci USA,2002,99(2):1 092-1 097.
[9]Krasnyanski S F.In vitro cellular&developmental[J].Biology Plant,2001,37(4):427-433.
